质粒DNA的分离纯化
在基因工程中,质粒是携带外源基因进入细菌中扩增或表达的重要运载体,是重组DNA技术中必需的工具。而质粒的分离纯化则是最常用、最基本的实验技术。质粒分离重点考虑如何将之与性质相似的基因组DNA相互分开,在常用的分离方法中,几乎都利用了质粒分子量小和闭合环状超螺旋结构性质。质粒DNA分离方法有碱裂解法、煮沸法、去污剂(Triton/SDS)裂解法、CsCl-EB(氯化铯—溴乙啶)密度梯度平衡离心法、羟基磷灰石柱层析法、质粒DNA释放法及商业化的试剂盒等。前两种方法比较剧烈,适于小质粒,第三种方法比较温和,一般用来分离大质粒(>15 kb)。羟基磷灰石柱层析法利用核酸的带电性,可用于纯化。
1.碱裂解法
碱裂解法是小量制备DNA较好的方法,基本原理是:利用质粒较小且为超螺旋共价闭合环状分子,与染色体DNA在拓扑学上有很大差异将其分离。即在碱性(pH=12~12.5)条件下,DNA分子均变性,恢复中性时,线性染色体DNA由于两条链分开且基因组分子量大,单链互相无规则缠绕,不能准确复性,就与其他成分共沉淀;而质粒DNA分子小且两条闭合环状分子及时变性,也较紧密地缠绕在一起,能准确复性而留于上清溶液中。
碱裂解法获得DNA纯度可达到基因工程操作的要求,提取率高,能快速获得超螺旋DNA,常用于高拷贝数质粒的分离提取。质粒的大量制备可在用微量制备的方法提取后,再采用聚乙二醇沉淀等方法纯化。
2.煮沸法
煮沸法利用加热处理DNA溶液时,线状染色体DNA容易发生变性,共价闭环的质粒DNA在冷却时即恢复其天然构象,变性染色体DNA片段与变性蛋白质和细胞碎片结合形成沉淀,而复性的超螺旋质粒DNA分子则以溶解状态存在液相中,通过高速离心(12 000 g)将两者分开。然后可用5%十六烷基三甲基溴化铵(CTAB)选择性沉淀DNA,进一步用乙醇洗涤、沉淀,保存于TE缓冲液中。煮沸法适用于快速提取质粒DNA并进行鉴定,也适用于大量提取,对纯度要求高的,可作进一步纯化处理。
3.CsCl-EB密度梯度平衡离心
CsCl是一种大分子量的重金属盐,长时间超速离心时,在管中形成1~1.805 2 g/cm3自上而下增加的密度梯度。含有细胞裂解液的体系在长时间超速离心平衡后,DNA的沉降速度与扩散速度达到平衡,染色体DNA、质粒、RNA以及蛋白质等不同浮力密度的物质可在管内不同位置形成区带。RNA可与Cs+结合,因此密度最大,沉积管底,蛋白质漂浮于液面上。(https://www.daowen.com)
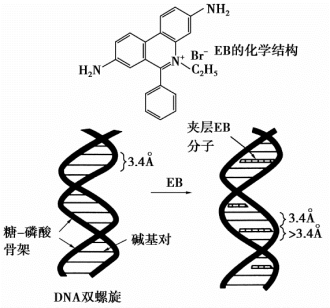
图8-2 EB与DNA结合方式示意图
密度梯度平衡离心后,不同物质区带示意图如图8-3所示。该法可以简便地将几种大分子分离开,所获得DNA纯度高,因此也可用于染色体DNA的分离。但是需要超速离心机,设备成本较高。
根据质粒大小和结构与基因组DNA的区别,还可以采用阴离子交换色谱(如DEAEsepharose 4B)或分子筛色谱(如Sephacel S-100),也可选用一些特定的商品化的柱子。凝胶电泳也是一种分离不同分子量DNA的手段。
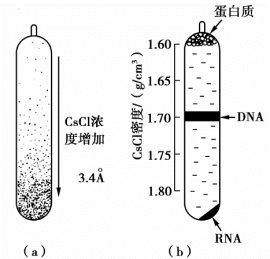
图8-3 CsCl-EB密度梯度平衡离心分离示意图
4.DNA的纯化
质粒从细菌中分离出来以后,可用于DNA片段酶切回收、内切酶图谱分析、细菌转化、亚克隆及探针放射性标记等实验。但是对于一些DNA纯化要求高的实验,如哺乳类动物细胞转染、转基因动物操作等,需要进一步提高质粒DNA的纯度。这种纯度要求不但包括细菌染色体DNA、RNA及蛋白质的去除,而且还要选择质粒DNA的不同分子构型。一般根据后续实验对DNA的质量要求和具体条件加以选择。经酚/氯仿提取纯化的质粒DNA,为了进一步纯化共价闭环(cc)质粒DNA,可采取以下方法:①CsCl-EB梯度平衡超速离心法;②离子交换或凝胶过滤柱色谱法;③分级聚乙二醇沉淀法;④琼脂糖凝胶电泳片段分离法(见“核酸电泳”部分)。其中方法①较常用,但该方法成本高昂且费时,小实验室往往难以实现。方法②可通过选择不同色谱介质,在核酸分离纯化时有更多的应用,设备无特殊要求,只是操作比较麻烦。方法③比较经济简单,纯化的质粒DNA可适用于细菌转化、酶切,尤其对碱裂解法提取的质粒纯化效果更好。凝胶电泳分离是核酸分离纯化及鉴定的常规方法,尤其适宜小片段。
