真核生物的基因表达调控
与原核生物基因表达调控类似,真核生物基因表达调控也可在多个水平上进行。但由于真核生物基因组庞大、细胞结构复杂,因此,其基因表达调控机制远比原核生物复杂,研究也就困难得多。就目前所知,真核生物基因表达调控至少在以下四个方面与原核生物显著不同:①转录激活与转录区染色质特定结构相关联;②以更加灵活、经济、便捷的正控制调节方式为主;③转录与翻译在时间与空间上是分离的;④有更多、更复杂的调控蛋白参与调控过程。
1.DNA水平的调控
真核生物基因表达在DNA水平的调控主要通过以下四种方式实现。
(1)染色质结构对基因表达的调控作用 染色质结构影响基因表达是真核生物基因的特有现象。真核生物基因通常与组蛋白结合成核小体结构。形成的核小体再经高度螺旋压缩成的染色质储存于细胞核内,维持基因组稳定性,保护DNA免受损伤,关闭基因的转录。去除组蛋白后,染色质松弛,核小体解体,基因转录开启。研究发现,在转录较为活跃的区域,组蛋白相对缺乏,对脱氧核糖核酸酶(DNase I)高度敏感,出现DNase I超敏位点。超敏位点常位于基因的5′端或3′端侧翼区,甚至在转录区内。由此可见组蛋白在维持染色质结构、调节基因表达中的重要作用。另外,组蛋白的结构变化也可导致基因表达的变化。如组蛋白N端丝氨酸磷酸化,或组蛋白中丝氨酸和精氨酸的乙酰化,使组蛋白带的正电荷减少,与DNA结合力减弱,有利于转录。有些调节蛋白可以取代组蛋白H1和H5而竞争性地与DNA结合,从而解除组蛋白对基因表达的抑制作用。
(2)基因修饰 在真核生物基因表达调控中,甲基化起着重要作用。DNA中的胞嘧啶经甲基化成为5′甲基胞嘧啶(m5C),常出现在基因5′端侧翼序列的CG富含区。一般认为,基因的甲基化与基因的表达负相关。因此,转录活性高的基因CG富含区中甲基化程度一般较低。
通常认为甲基化影响基因表达的机制是:通过影响DNA中的顺式因子与转录因子的结合,使基因不能转录或阻止转录复合物的形成。
(3)基因重排 基因重排是指某些基因片段改变原有序列,并通过调整有关基因片段衔接序列,重新组成一个完整的转录单位。比如免疫球蛋白分子就是许多基因片段进行重排和拼接加工的产物。有限的基因片段通过不同的组合方式可以形成约108种不同的免疫球蛋白分子,这也是免疫球蛋白分子多样性的分子生物学基础。基因重排是DNA水平调控的重要方式之一。
(4)基因扩增 细胞在发育分化或环境改变时,由于对某种基因产物的需要量剧增,单纯靠调节其表达活性不足以满足需要时,常通过基因扩增的方式来增加这种基因的拷贝数,以满足需要。这是调控基因表达的一种有效方式。基因扩增的机制目前仍不清楚,多数人倾向于认为是基因的反复复制;也有人认为是姊妹染色单体间发生了不对称交换,使一些细胞中某种基因拷贝数增多。
2.转录水平的调控
转录水平的调控是真核生物基因表达调控中最重要的环节,主要调控环节是转录起始。调控主要通过反式作用因子、顺式作用元件和RNA聚合酶相互作用来完成。调控机制涉及反式作用因子的激活以及反式作用因子与顺式元件的作用等。
(1)反式作用因子调节转录起始 首先是反式作用因子的功能调节,特定的反式作用因子被激活后,可以启动特定基因的转录。反式作用因子的激活通过以下几种方式实现。
①表达式调节。反式作用因子一旦合成便具有活性,随后被迅速降解。这一类反式作用因子只是在需要时才合成,并通过蛋白质水解迅速降解,不能积累。
②反式作用因子的共价修饰。有两种常见的方式,即磷酸化—去磷酸化和糖基化。
a.磷酸化—去磷酸化。许多反式作用因子在合成后可在细胞内持续存在较长时间,其功能是通过磷酸化和去磷酸化实现的。
b.糖基化。糖基化也是反式作用因子活性调节的一种方式。细胞内的许多转录因子都是糖蛋白,其合成后的初级产物是无活性的,须经糖基化修饰后才能转变成具有活性的糖蛋白。由于糖基化与磷酸化的位点都是在丝氨酸和苏氨酸残基的羟基上,故两种修饰可能是竞争性的。
③配体结合。许多激素受体也是反式作用因子,它们本身对基因转录无调节作用。只有当激素进入细胞,并与受体结合后,才能结合到DNA上调节基因的表达。
④蛋白质复合物的形成与解离。这是许多细胞内活性调节的一种重要形式。有些反式作用因子与另一蛋白质形成复合物后,才具有调节活性。如c-myc蛋白,主要位于细胞核中,可与DNA结合。c-myc蛋白具有螺旋—环—螺旋和碱性亮氨酸拉链结构域。这两种结构都以异源二聚体形式发挥作用,单一的c-myc蛋白结合靶DNA的效率很低,需要与其配对蛋白max构成异源二聚体,才能调节基因表达。
(2)反式作用因子与顺式元件的结合 反式作用因子结合的顺式元件包括上游启动子元件和远距离的增强子元件。上游启动子元件位于转录起始位点上游-10~-200 bp。在这个区域有多个顺式调控元件(包括TATA盒),每个元件为8~15个核苷酸,结合一种特定的反式作用因子。
反式作用因子被激活后,即可识别上游启动子元件和增强子中的特定序列,对基因转录发挥调节作用。大部分反式作用因子在被激活以后与顺式元件结合,但也可能有一些反式作用因子是先期结合到DNA后,才被激活发挥调节功能的。
(3)反式作用因子的组合式调控作用 每一种反式作用因子结合顺式元件后虽可发挥促进或抑制作用,但反式作用因子对基因表达的调控不是由单一因子完成的,通常是几种不同的反式作用因子控制一个基因的表达(称为组合式基因调控),一种反式作用因子也可以参与调控不同的基因表达。反式作用因子的数量是有限的,反式作用因子的组合式作用方式使有限的反式作用因子可以调控不同基因的表达。每一调节蛋白单独作用于转录所产生的影响可以是正调控,也可以是负调控,不同因子的组合,决定一个基因的转录。实际上,净效应不是简单加和的结果,在某些情况下,两个调控蛋白结合到DNA上后,可以相互作用改变各自的活性。
在这种正控制组合式的复合体中,只要有一个反式作用因子的基因没有转录、翻译,复合体就不能形成,受它们调控的靶基因就处于关闭状态。与原核生物基因表达的负控制系统相比(必须合成特异的阻遏蛋白才能关闭靶基因的表达),这种正控制组合式复合体具有更为灵活、经济的调控效益。
3.转录后水平调控
尽管转录水平的调控是基因表达调控最重要的调控方式,然而,大量的研究表明,在RNA转录后同样存在着多样化的调控机制。转录后水平的调控一般是指对转录的前体mRNA产物进行一系列修饰、加工,主要包括mRNA“加帽”、“加尾”、“剪接”、胞内定位以及mRNA稳定性调节等。
(1)“加帽”和“加尾”的调控 真核生物mRNA的初级转录产物经过加帽(capping)过程,在5′端形成一个特殊结构——7-甲基鸟苷三磷酸(m7GpppN)。帽子结构对维持mRNA稳定和防止mRNA被核酸酶降解具有重要作用。此外,帽子结构也为蛋白质合成提供识别标志,从而促进蛋白质合成起始复合物的生成,提高翻译效率。研究发现,没有甲基化的帽子(如GpppN-)以及用化学或酶学方法脱去帽子的mRNA,其翻译活性显著下降;帽子结构的类似物,如m7GMP等能抑制有帽子的mRNA的翻译,但对没有帽子的mRNA的翻译没有影响。(https://www.daowen.com)
真核生物中除组蛋白基因的mRNA外,其他结构基因的成熟mRNA的3′端都有由50~150个腺苷酸组成的多聚腺苷酸尾,即poly(A)尾。它是在转录后加上去的,这一过程称为加尾。绝大多数结构基因的最后一个外显子中都有一个保守的AATAAA序列。这个序列对于mRNA转录终止和加poly(A)尾是必不可少的。此位点下游有一段GT丰富区或T丰富区,它与AATAAA序列共同构成poly(A)加尾信号。mRNA转录至此部位后,产生AAUAAA和随后的GU(或U)丰富区。RNA聚合酶结合的延长因子可以识别这种结构并与之结合,然后在AAUAAA下游10~30个碱基部位切断RNA,并加上poly(A)尾。poly(A)具有保持mRNA稳定、延长mRNA寿命的功能。一般规律是,poly(A)尾越长,其mRNA越稳定,寿命越长;反之,则不稳定,易被降解。
(2)mRNA选择性剪接对表达的调控 真核生物基因的特点之一是含有内含子序列。在mRNA成熟过程中,切除内含子并将其与外显子拼接在一起的过程称为mRNA剪接。关于RNA剪接的研究是20世纪80年代以来生物化学和分子生物学领域中最有生机的研究课题之一。内含子与外显子的概念是相对的,外显子(一个或几个)可以在成熟的mRNA中保留,也可通过剪接过程除去;同样,内含子也可能被保留在成熟的mRNA中。这就是所谓的选择性剪接。例如,极低密度脂蛋白受体(VLDLR)的由该受体基因的第16个外显子编码的,但在某些组织中或某些疾病条件下却发现同时存在该外显子被剪切的Ⅱ型受体,两种类型的受体在结合能力和稳定性上都有所不同,提示了选择性剪接可能具有调控意义。
通过选择性剪接,一个基因在转录后可以产生两个或两个以上的mRNA,由此翻译成两个或更多的同源异型蛋白质。因此,有限的基因可以产生更多的蛋白质表型,使调控更加精细,也再次修正了“一个基因,一条肽链”的基因概念。
(3)RNA编辑的调控 RNA编辑是一种较为独特的遗传信息加工方式,即转录后的mRNA在编码区发生核苷酸修饰改变的现象。这种编辑多将C编辑为U,或插入若干串联U等。核苷酸的改变导致mRNA模板信息改变,从而产生氨基酸序列不同的蛋白质。这有利于扩大遗传信息,适应个体生存环境。由向导RNA(gRNA)介导的RNA编辑机制假说,是现代DNA定点修饰技术的重要理论基础。
①核苷酸替换。最典型的例子是载脂蛋白B的RNA编辑。体内存在两种载脂蛋白B(Apo-B):Apo-B100和Apo-B48。由于Apo-B100的mRNA中某一CAA突变为UAA,C→U替换(C→U替换可能是通过胞嘧啶脱氨酶的作用来实现的),使编码谷氨酰胺的密码子变为终止子,从而使翻译过程提前终止,产生Apo-B48。Apo-B48只保留了Apo-B100分子N端的部分结构域,缺少Apo-B100 C端的LDI。
②核苷酸的插入或缺失。锥虫线粒体的细胞色素氧化酶亚基Ⅱ的基因与人类基因相比,在相当于编码第170位氨基酸处有一个移码突变,这一编辑的实现通过gRNA介导插入4个U,而使其转录产物恢复到正常的阅读框架,产生相应功能蛋白质。
(4)mRNA转运调节 同位素标记实验观察到,大约只有20%的mRNA进入胞浆,留在核内的mRNA约50%会在1 h内降解。虽然目前尚不清楚将mRNA运出核的控制机制,但有证据表明,mRNA出核受到细胞调控,因为mRNA通过核膜孔是主动运输过程;同时,大多数mRNA需经过加帽、加尾,并在剪接完成后才能被运输。
mRNA通过核膜孔转运至胞质中的位置也具有特异性,有的被直接运到内质网,在内质网膜上完成肽链的合成;有的则可能被运到细胞质中,由游离的核糖体进行翻译。
4.翻译水平的调控
翻译水平的调控主要是控制mRNA的稳定性和mRNA翻译的起始频率。
(1)翻译起始调控 蛋白质生物合成过程中,起始阶段最为重要。许多蛋白质因子可以影响蛋白质合成的起始,如真核生物起始因子-2(eukaryotic initiation factor,eIF-2)受磷酸化影响。当eIF-2的3个亚基之一被磷酸化后,活性降低。eIF-2的磷酸化是由一种cAMP依赖蛋白激酶所催化。血红素因能抑制cAIVIP依赖的蛋白激酶的活化,防止或减少eIF-2磷酸化后失活,从而促进蛋白质的合成。
(2)mRNA稳定性对翻译的影响 mRNA是蛋白质合成的模板。一般来说,一种特定蛋白质合成的速率同细胞质内编码它的mRNA水平成正比。mRNA的稳定性与其种类和结构有关。
细菌细胞内,大部分mRNA不稳定,半衰期约为3 min。由于细菌的mRNA迅速合成、迅速降解,所以细菌可以通过调整基因表达,对环境变化做出快速反应。而在真核细胞中,mRNA的稳定性差别很大。有些mRNA的半衰期长达10 h以上,而有些则只有30 min或更短。不稳定mRNA多是编码调节蛋白的,这些蛋白质的水平在细胞内变化迅速,利于调控。
目前发现,许多不稳定mRNA的3′端含有一段富含AU的序列,这可能是引起mRNA不稳定的原因。mRNA3′端约50 bp的富含AU的序列称为ARE(AU-rich element),该元件含多次重复的AUUUA序列,如图2-19所示。ARE的存在导致poly(A)尾的脱腺苷酸化,进而mRNA被降解。
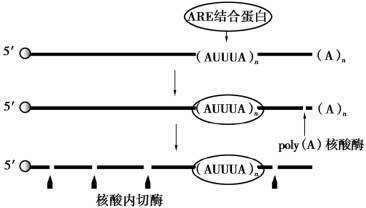
图2-19 ARE引发mRNA的降解
5.翻译后水平的调控
mRNA翻译的产物——新生多肽链大多数是没有生物活性的,必须经过加工、修饰才能成为有活性的蛋白质。加工、修饰过程包括信号肽的切除、多肽的修饰和剪接,这些均属翻译后水平的调控。
(1)信号肽的切除 信号肽由15~30个疏水氨基酸残基组成,具有疏水性。它的作用是使蛋白质从内质网膜进入高尔基体。一旦蛋白质进入高尔基体,信号肽就被信号肽酶水解。切去信号肽后,前蛋白质就变成有生物活性的蛋白质了。例如,胰岛素在含信号肽时由110个氨基酸残基组成,这种胰岛素称为前胰岛素原。在信号肽作用下,前胰岛素原由内质网进入高尔基体。在高尔基体内腔壁上信号肽被水解,转变为由86个氨基酸残基组成的胰岛素原,然后切去C端部分肽段成为成熟的胰岛素,最终被排出胞外。目前发现,几乎各种分泌性蛋白质均含有信号肽。
(2)新生肽链的修饰 新生肽链的修饰是调节蛋白质活性的重要方式,其主要的修饰方式有磷酸化、羟基化、糖基化、乙酰化等。
蛋白质的磷酸化修饰是一种广泛存在的修饰方式。通过蛋白激酶催化将ATP的末位磷酸基转移到多肽链的丝氨酸、苏氨酸和酪氨酸残基上,从而改变多肽链的结构与活性。通常情况下,磷酸化的蛋白质活性增强;但有时也会出现磷酸化后蛋白质活性降低的情况。磷酸化的蛋白质也可以在磷酸酯酶催化下脱磷酸,因此,可通过磷酸化—脱磷酸化这一平衡调控蛋白质活性。
许多膜蛋白、识别蛋白和分泌蛋白均带有一个或数个糖基,被称为糖蛋白或糖基化蛋白。这些糖基具有重要的生理功能,如抵御蛋白酶的攻击、增加蛋白质的水溶性、辅助蛋白质在细胞中的定位等。糖基化位点通常是在蛋白质的特定序列,通过糖基与蛋白质中天冬氨酸、丝氨酸或苏氨酸的N或O连接形成。
(3)肽链的剪接与正确折叠 新生肽链的一级结构是由遗传信息决定的,是蛋白质最基本的结构,一级结构的改变将导致其功能的改变,它决定着蛋白质的空间结构。然而,近年来不少研究发现,新合成的肽链可以通过多肽的剪辑被切成数个片段,然后再按一定顺序连接起来,形成有活性的蛋白质。如发现伴刀豆蛋白前体由5个部分组成,在成熟过程中,N端信号肽、C端残余9肽和中间15个氨基酸的连接肽均被切除。
肽链的一级结构也决定着蛋白质的空间结构。而蛋白质的空间结构则与其生物学功能直接相关。空间结构的形成涉及肽链的正确折叠。一些与空间结构有关的特异性酶,如蛋白质二硫键异构酶等,通过催化反应,影响肽链的正确折叠。此外,一类被称为分子伴侣的物质对蛋白质正确构象的形成也有重要作用。所谓分子伴侣是指能帮助新生肽链折叠,使之成为成熟蛋白质,但本身并不参与共价反应的物质。目前所知的分子伴侣大部分为蛋白质。如伴侣素60家族以及热休克蛋白70、90家族等。分子伴侣具有酶的特征但又与酶不同,其作用机制现在还没有一致认识,但已受到人们的广泛重视。
