核酸提取的主要步骤
提取纯化核酸总的来说分为四大步骤:样品的前处理;细胞的破碎;核酸的分离纯化,除去与核酸结合的蛋白质及多糖脂等杂质;核酸的沉淀浓缩,除去其他杂质核酸,获得均一的样品。
1.样品的前处理
新鲜的动植物组织材料,经清洗去掉非组织材料杂质。少量样品可用液氮冻结,然后快速碾磨成粉末状。动物细胞培养物有的需用胰酶消化,再离心沉淀,必要时用预冷的PBS液漂洗,收集沉淀的细胞。液体培养的单细胞微生物直接离心沉淀收集菌体,重悬浮在含有EDTA的葡萄糖低渗溶液,避免细胞裂解。
2.细胞的破碎
细胞的破碎有多种方法,包括物理方法、化学方法、酶法等。常用的物理方法有超声波法、匀浆法、液氮破碎法、Al2O3粉研磨法等。由于物理方法容易导致DNA链的断裂,因此对大分子量DNA,一般采用化学方法和酶法,如采用去污剂(SDS,0.5%~1.25%)和溶菌酶或蛋白酶K1在Tris-HCl(pH=8.0)的EDTA溶液中,温和裂解。EDTA(5 mmol/L)可与Mg2+结合,从而抑制核酸水解酶,是核酸制备中防止酶解的重要手段。蛋白酶,去污剂在使细胞充分裂解的同时,也可使核蛋白复合体破碎,从而使更多的核酸释放出来,溶解于提取缓冲液中。为充分裂解细胞,消化蛋白,此过程可在室温60℃条件下进行。以上条件主要是对DNA提取,为了除去混杂的RNA,此时也可加入适量RNA酶。但若是提取RNA,则从裂解开始就应抑制RNA酶活性,这是成败的关键。
3.核酸的分离纯化(https://www.daowen.com)
核酸纯化最关键的步骤是去除蛋白质,要将核酸与紧密结合的蛋白质分开,而且还要避免核酸降解。从细胞裂解液等复杂的分子混合物中纯化核酸,则要先用某些蛋白水解酶消化大部分蛋白质后,再用有机溶剂抽提。从核酸溶液中去除蛋白质常用酚/氯仿抽提法,这个方法的基本原理是:交替使用酚、氯仿这两种不同的蛋白质变性剂,以增加去除蛋白杂质的效果。因为酚虽可有效地变性蛋白质,但它不能完全抑制RNA酶(RNase)的活性,而且酚能溶解10%~15%的水,从而能溶解一部分poly(A)RNA,因此DNA提取时一般采用饱和酚。克服这两方面的局限,对于RNA提取显得更加重要。为此可混合使用酚与氯仿,氯仿还能加速有机相与液相分层,去除植物色素和蔗糖。在氯仿中加入少许异戊醇的目的在于减少蛋白质变性操作过程中产生的气泡。最后用氯仿抽提处理,是为了去除核酸溶液中的痕量酚。如果下一步骤中酶反应的条件要求严格,最可靠的方法是再用水饱和的乙醚抽提一次,以彻底去除核酸样品中的痕量酚与氯仿,然后在68℃水浴中放置10 min使痕量乙醚蒸发掉。酚/氯仿萃取原理示意图如图8-1所示。
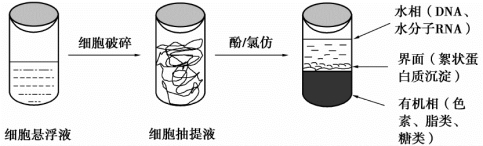
图8-1 酚/氯仿萃取原理示意图
4.核酸的沉淀浓缩
核酸沉淀常用乙醇沉淀法。无水乙醇结合核酸分子所结合的水,使核酸沉淀,且乙醇易挥发除去,对后续酶切操作影响甚微。微量的DNA,可加入中等浓度的单价阳离子促进沉淀。如加入Na+,中和了DNA分子上的负电荷,减少了DNA分子间的同性电荷相斥力,易聚合形成的钠盐DNA沉淀可经离心回收。回收的核酸可按所需浓度,再溶于适当的缓冲液中。甚至对低至皮克量的DNA或RNA也可定量回收。
以上是核酸DNA在提取时所用的主要步骤,具体的染色体DNA、细胞器DNA、病毒DNA(RNA)及质粒DNA在提取方法上又有所不同。
