细菌人工染色体(BAC)载体
细菌人工染色体(BAC)又称为F黏粒,是由Mel Simon等于1992年构建。BAC实际上是一种质粒载体,它与一般质粒载体的差别在于其复制单元的性质。每个BAC环状DNA分子中携带一个抗生素抗性标记(Cmr)、一个来源于大肠杆菌F因子的严谨型控制的复制子oriS、一个促进DNA复制的由ATP驱动的解旋酶(RepE)以及三个确保低拷贝质粒精确分配至子代细胞的基因位点。
BAC载体的低拷贝性可以避免嵌合体的产生,减小外源基因的表达产物对宿主细胞的毒副作用。
第一代BAC载体不含那些能够用于区分携带重组子的抗生素抗性细菌菌落与携带空载体的细菌菌落的标记物。新型的BAC载体含有能通过颜色反应鉴别携带插入片段的重组子的lacZ′基因(α-互补),LacZ′基因有限制性内切酶酶切位点,并设计了用于回收克隆DNA的NotⅠ酶切位点和用于克隆DNA片段体外转录的Sp6启动子和T7启动子。NotⅠ是识别位点十分稀少的限制性内切酶,重组DNA通过NotⅠ消化后,可以得到完整的插入片段。Sp6、T7是来源于噬菌体的启动子,用于插入片段末端核苷酸序列的测定。此外,新型载体还插入一个携带有噬菌体cosN位点的400 bp片段。cosN位点可被λ噬菌体末端酶切割为黏末端,因而能像传统的黏粒一样在克隆后包装,转染而成平均容量为40 kb的高效克隆载体,它也为指纹图谱的构建提供了方便,并且包含有细菌噬菌体P1的loxP位点的42 bp片段插入到cosN与克隆位点间。
BAC载体的克隆与常规的质粒克隆载体相似。不同的是,BAC载体装载的是大片段DNA,一般在100~300 kb。使用BAC载体制备外源大片段时关键步骤有两步,其一是大片段DNA的制备,首先将目的细胞用琼脂糖凝胶包埋起来,然后对包埋细胞总DNA作原位限制性酶切,经脉冲场凝胶电泳从凝胶中分离出目的大小的酶切DNA片段。这样可以保证目的DNA片段是经限制酶切割来的而不是断裂来的。其二是高质量BAC载体的制备和处理。载体的纯度和去磷酸化的质量是决定载体质量的重要因素,高质量的载体才能充分与外源DNA片段连接。载体与目的DNA片段连接后,通过电转化导入大肠杆菌,为了防止外源真核DNA中重复序列之间发生染色体内重组,BAC应在重组缺陷的宿主如DH108中扩增。在氯霉素抗性、IPTG和X-gal诱导琼脂筛选转化菌株。(https://www.daowen.com)
随着基因工程的发展,BAC载体又被改造成既可用于基因组文库构建又能进行遗传转化的双功能载体。1996年,Hamilton等在BAC和Ti质粒的基础上构建成了可用于植物大片段转化的双元T-DNA载体BIBAC2。这种质粒保持了F因子的复制功能区,方便载体的构建和基因组文库鉴定,同时质粒中也包含了为农杆菌介导的植物转化所需的元件(图6-11)。
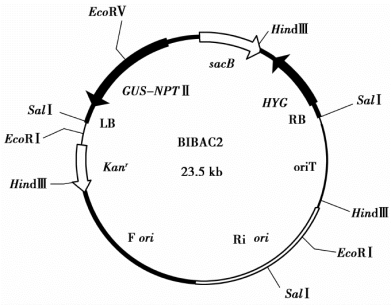
图6-11 BIBAC2载体基因图谱
