实时荧光定量PCR过程的监测检测模式
实时荧光定量PCR过程的监测检测模式实际上就是实时荧光定量PCR过程中使PCR产物带上荧光标记,然后进行荧光检测的方法。荧光检测模式可以分为非特异性荧光检测和特异性荧光检测两种类型。非特异性荧光检测模式主要是SYBR GreenⅠ检测模式;特异性荧光检测模式有水解探针(Taq Man)检测模式、分子信标检测模式、荧光谐振能量传递检测模式和LUX引物检测模式等。
1.SYBR GreenⅠ检测模式
SYBR GreenⅠ能与双链DNA结合,与核酸结合后的最大吸收峰在蓝绿可见光区(波长约为497 nm),发射荧光波长最大约为520 nm,适合用可见光系列仪器对荧光进行观察。SYBR GreenⅠ与核酸的结合位点是双链DNA的小沟部位,而且只有和双链DNA结合后才会发出荧光,变性时DNA双链分开,SYBR GreenⅠ无荧光;复性和延伸时形成双链DNA,SYBR GreenⅠ发出荧光。SYBR GreenⅠ检测模式就是在此这个阶段采集荧光信号,从而保证荧光信号的增加与PCR产物的增加完全同步的。
①SYBR GreenⅠ的缺点:由于SYBR Green I结合双链DNA没有特异性,不能识别特定的双链DNA分子,只要是双链的DNA就会结合并发出荧光,对PCR反应中的非特异性扩增或引物二聚体也会产生荧光,因此,由引物二聚体、单链二级结构以及错误的扩增产物引起的假阳性会影响定量的精确性,不能真实反映目的基因的扩增情况。通过测量升高温度后荧光的变化可以帮助降低非特异产物的影响,由解链曲线来分析产物的均一性可提高SYBR GreenⅠ定量的准确性。
②SYBR GreenⅠ的优点:SYBR GreenⅠ能与所有的双链DNA结合,不必因为模板不同而设计特异性荧光探针,因此其通用性好,使用方便。与特异性荧光探针相比,只需要设计常规的PCR引物,因而价格相对较低。由于一个PCR产物可以与多个染料分子结合,因此SYBR GreenⅠ的灵敏度很高。利用荧光染料可以指示双链DNA熔点的性质,通过熔点曲线分析可以识别扩增产物和引物二聚体,因而可以区分非特异扩增,进一步地还可以实现单色多重测定。SYBR GreenⅠ检测模式适用于对检测灵敏度要求高,而对定量准确度要求稍低的定量PCR。
2.水解探针检测模式
水解探针是一种寡核苷酸探针,与目标序列上游引物和下游引物之间的序列配对,荧光基团连接在探针的5′末端,而淬灭基团则连接在3′末端,常见的为Taq Man探针(图5-5)。常用的荧光基团有FAI、TET、JOE、HEX和VIC,常用的淬灭基团有TAMRA和DABCYL。当完整的探针与目标序列配对时,荧光基团发射的荧光因与3′端的淬灭基团接近而被淬灭。在进行延伸反应时,聚合酶的5′外切酶活性将探针切断,使得荧光基团与淬灭基团分离而发出荧光,形成荧光信号,一分子荧光信号的产生就代表一分子产物的生成。随着扩增循环数的增加,释放出来的荧光基团不断积累,因此荧光强度与扩增产物的数量成正比,并且探针检测的荧光的积累与循环数成正比。
Taq Man探针检测模式的特点:Taq Man探针适合各种具有5′外切酶活性的耐热聚合酶,可应用于基因检测、病毒定量、细胞因子基因定量、癌细胞基因微突变检测等,其结果都具有高特异性与高敏感性,但只适合于一个特定的目标,不易找到本底低的探针,探针需要委托公司标记,且价格较高。
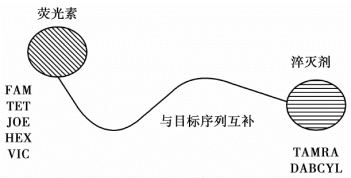
图5-5 Taq Man探针的结构示意图
3.分子信标检测模式
分子信标是一种在靶DNA不存在时形成茎环结构的双标记寡核苷酸探针。在此发夹结构中两端的序列互补,因此位于探针一端的荧光基团与探针另一端的淬灭基团紧紧靠近。在此结构中,荧光基团被激发后不是产生光子,而是将能量传递给淬灭剂,这一过程被称为荧光谐振能量传递。由于“黑色”淬灭剂的存在,由荧光基团产生的能量以红外光而不是可见光形式释放出来。如果第二个荧光基团是淬灭剂,其释放能量的波长与荧光基团的性质有关,常用的荧光基团有FAI和Texas Red。(https://www.daowen.com)
分子信标的茎环结构(图5-6)中,环一般为15~30 bp,并与目标序列互补;茎长度一般为5~7 bp,且有一段相互配对形成茎的结构。荧光基团连接在茎臂的一端,而淬灭剂则连接于另一端。分子信标必须非常仔细地设计,以便它在复性温度下,模板不存在时形成茎环结构,模板存在时与模板配对。与模板配对后,分子信标将成链状而非发夹状,从而使荧光基团与淬灭剂分开,当荧光基团被激发时,它发出自身波长的光子。由于是酶切作用的存在,所以与Taq Man探针一样分子信标也是积累荧光。
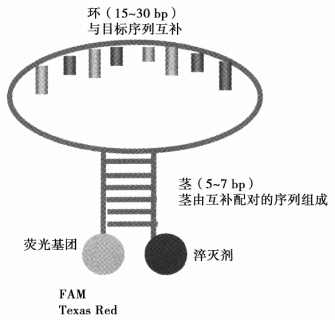
图5-6 分子信标结构示意图
分子信标检测模式的特点是:分子信标能特异性地检测感兴趣的目标DNA,可用于单核苷酸多态性的检测,特别适用于检测点突变,但它只能用于一个特定的目标,设计比较困难,而且价格较高。
4.荧光谐振能量传递检测模式
荧光谐振能量传递(FRET)探针,又称双杂交探针,由两条相邻探针组成:在一条探针的5′端标记FAM荧光基团,另一探针的3′端标记Red 640荧光基团。当复性时,探针结合在模板上,FAM基团和Red 640基团相邻,激发FAM产生荧光,作为Red 640基团的激发光被吸收,使Red 640发出波长为640 nm的荧光。当变性时,探针游离,两基团距离远,不能产生640 nm的荧光。由于FRET探针是靠近发光,所以检测信号是实时信号,非累积信号。FRET探针是罗氏的发明专利,常用的荧光基团是LC-Red 640和LC-Red 705。
5.LUX引物检测模式
LUX引物是一项利用荧光标记的引物实现定量检测的新技术。LUX引物检测模式是一种单标引物检测方法,只在定量PCR的一对引物中任意一条引物的3′末端连接有荧光基团。LUX引物被设计为带有末端回文结构,并在3′末端标记荧光素,这样,这条引物在游离状态下可形成茎环结构,而这种DNA构象本身具有淬灭荧光基团的特性,所以不需要在另一端标记淬灭基团就可实现荧光淬灭。在模板存在的情况下,引物与模板配对,发夹结构打开,产生荧光信号。
与Taq Man探针和分子信标相比,LUX引物利用自身的二级结构实现淬灭,不需要荧光淬灭基团,也不需要设计专门的探针,只需在引物的5′末端添加互补的序列,在3′末端标记荧光素,既节省了成本又给实验设计提供了宽松的条件。由于没有探针控制特异性,因此,LUX引物检测模式的特异性要弱于探针技术;但非特异性扩增或引物二聚体对其没有影响,所以特异性要强于SYBR GreenⅠ。LUX引物最大的特点是使用单荧光标记引物,因此它很容易实现在同一PCR管里同时对多个不同目标的检测。由于目前LUX引物只有FAM、JOE和Alexa Fluor 546三种荧光标记,所以它只能实现同时对3个不同目标的检测。
LUX引物是一个相对较新的技术,具有高灵敏度、中特异性和低成本的特点,但其引物的二级结构淬灭是否完全;背景如何;这种发夹结构淬灭是否和G淬灭(就是临近的G碱基会增强荧光淬灭效果)原理相似;发夹结构状态下的荧光强度与变性打开到引物延伸合成这几步之间荧光信号的变化如何;所以其应用还有待在实践中进一步检验。
能用于实时荧光PCR定量的检测方法很多,各有优缺点,我们应根据实验的需要和当前的实验条件选择适合自己的方法。
