实时荧光定量的原理
1.传统的PCR定量方法
传统的PCR在扩增反应结束之后可以通过凝胶电泳的方法对扩增产物进行定性的分析,也可以通过荧光标记物或放射性核素掺入标记后的光密度扫描来进行定量的分析。无论定性还是定量分析,分析的都是PCR终产物。传统的定量PCR方法主要有以下方法。
(1)非竞争内参照法
在同一个PCR反应体系(即同一个PCR管)中加入两对引物,同步扩增靶DNA序列和用基因工程方法合成的内标DNA序列。在靶序列被扩增的同时,内标也被扩增,通过比较两种序列的扩增量来对靶DNA序列进行定量。在实验中其中一个引物用荧光标记,在PCR产物中,内标与靶序列的长度不同,二者的扩增产物可用电泳或高效液相分离开来,分别测定其荧光强度,以内标为对照定量分析待检测靶序列。
该方法只能对靶序列和内标以相同的量存在时才能准确进行定量,只能对指数扩增期的PCR产物进行定量。
(2)竞争性内参照物
竞争性内参照物是通过竞争性模板来实现定量。竞争性模板是通过将靶序列内部突变产生一个新的内切酶位点来获得的,这样就可以在同样的反应条件下,同一个试管中,用同一对引物(其中一个引物为荧光标记),同步扩增靶序列和内参照序列。扩增后用内切酶消化PCR产物,竞争性模板的产物被酶解为两个片段,而待测模板不被酶切,故可通过电泳或高效液相色谱将两种产物分开,分别测定荧光强度,根据已知模板推测未知模板的起始拷贝数。
(3)PCR-ELISA法
利用地高辛或生物素等标记引物,扩增产物被固相板上特异的探针所结合,再加入抗地高辛或生物素酶标抗体—辣根过氧化物酶结合物,最终酶使底物显色。常规的PCR-ELISA法只是定性实验,若加入内标,做出标准曲线,也可实现定量检测目的。
由于传统定量方法都是终点检测,而PCR经过对数期扩增到达平台期时,检测重现性差。同一个模板在96孔PCR仪上做96次重复实验,所得结果有很大差异,因此无法直接从终点产物量推算出起始模板量。传统的定量PCR技术的难点主要在于:第一,如何确定PCR正处于线性扩增范围内(只有在此范围内PCR产物信号才与初始模板的拷贝数成比例);第二,一旦线性扩增范围确定以后,如何找到一个合适的方法检测结果。加入内标后,可部分消除终产物定量所造成的误差,但在待测样品中加入已知起始拷贝数的内标,则PCR反应变为双重PCR,双重PCR反应中存在两种模板之间的干扰和竞争,尤其当两种模板的起始拷贝数相差比较大时,这种竞争会表现得更为显著。由于待测样品的起始拷贝数是未知的,所以无法加入合适数量的已知模板作为内标,也正是这个原因,传统定量方法虽然加入内标,但仍然只能算是一种半定量、粗略定量的方法,而且传统定量PCR还存在劳动强度大、定量不准确、重复性差的缺点。
正因为是传统的定量PCR方法无法满足精确定量的要求,特别是未经PCR信号放大之前的起始模板量的定量,所以实时荧光定量PCR技术应运而生。
2.实时荧光定量PCR技术的原理
PCR反应中目标DNA扩增量可用
![]()
计算。其中,Y代表扩增产物量,M代表反应起始的模板拷贝数,X代表扩增效率(X=参与复制的模板/总模板),n代表扩增循环数。PCR扩增效率理论值为100%,当X=100%时,扩增量可用Y=M×2n计算,PCR产物随着循环的进行成指数增长。在实际的PCR反应中,扩增效率通常X小于1,而且X在整个PCR扩增过程中不是固定不变的,当M在1~105拷贝、循环次数n≤30时,X是相对稳定的,原始模板以相对固定的指数形式增加,适合定量分析,这也就是所谓的扩增指数增长期。随着循环次数n的增加(n>30次),X会逐渐减少,Y就呈非指数形式增加,最后进入平台期,当X为0时,扩增产物量Y就不再增加。通常一个PCR反应无论反应体系起始模板含量多少,当扩增速率趋于稳定后,最终扩增片段的含量基本上是一样的,所以一定PCR体系中待扩增DNA片段起始拷贝数越大,则指数扩增过程越短,到达平台期越快,反之,到达平台期越慢。(https://www.daowen.com)
任何干扰PCR指数扩增的因素都会影响扩增产物的量,使PCR扩增终产物的量与原始模板数之间没有一个固定的比例关系,通过检测扩增终产物很难对原始模板进行准确定量,而荧光定量PCR则是利用PCR扩增过程产物的增加和起始的关系来对起始模板进行准确定量的。
实时荧光定量PCR是目前确定样品中DNA(或cDNA)拷贝数最敏感、最准确的方法。它具有特异性强,灵敏度高,可直接对产物进行定量,解决PCR污染问题,自动化程度高,操作简单等特点。
在实时荧光定量PCR反应中,引入了一种荧光化学物质,随着PCR反应的进行,PCR反应产物不断累积,荧光信号强度也等比例增加。每经过一次循环,就收集一次荧光强度信号,这样我们就可以通过荧光强度变化来监测产物量的变化,从而得到一条荧光扩增曲线图(图5-2)。
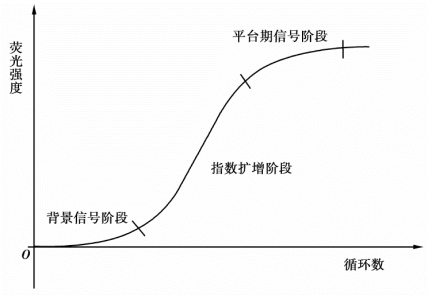
图5-2 荧光曲线示意图
一般而言,荧光扩增曲线可以分成三个阶段:荧光背景信号阶段、荧光信号指数扩增阶段、平台期信号阶段。在荧光背景信号阶段,扩增的荧光信号被荧光背景信号所掩盖,我们无法判断产物量的变化。而在平台期信号阶段,扩增产物已不再呈指数增加。PCR的终产物量与起始模板量之间没有线性关系,所以根据最终的PCR产物量不能计算出起始DNA拷贝数。只有在荧光信号指数扩增阶段,PCR产物量的对数值与起始模板量之间才存在线性关系,我们可以选择在这个阶段进行定量分析。
通常利用荧光扩增曲线拐点、扩增曲线整体平行性和基线三方面来作为判断扩增曲线是否良好的指标。良好的标准是曲线拐点清楚,特别是低浓度样本指数期明显,曲线指数期斜率与扩增效率成正比,斜率越大扩增效率越高;标准的基线平直或略微下降,无明显的上扬趋势;各管的扩增曲线平行性好,表明各反应管的扩增效率相近。
基线是指在PCR扩增反应的最初数次循环里,荧光信号变化不大,接近一条直线,这样的直线即是基线。
荧光阈值是指在荧光扩增曲线上人为设定的一个值,它可以设定在荧光信号指数扩增阶段的任意位置上,一般将PCR反应前15次循环的荧光信号作为荧光本底信号,荧光阈值是PCR的3~15次循环荧光信号标准差的10倍。荧光阈值原则上要大于样本的荧光背景值和阴性对照的荧光最高值,同时要尽量选择进入指数期的最初阶段,并且保证回归系数大于0.99,荧光信号超过阈值才是真正的信号。
C t值是指PCR扩增过程中,扩增产物的荧光信号达到设定的阈值时所经过的扩增循环数。PCR循环在到达C t值所对应的循环数时,即刚刚进入指数扩增期,此时微小误差尚未放大,因此C t值的重现性极好,即同一模板不同时间扩增或同一时间不同管内扩增,得到的C t值是恒定的。荧光阈值、C t值荧光曲线的关系如图5-3所示。
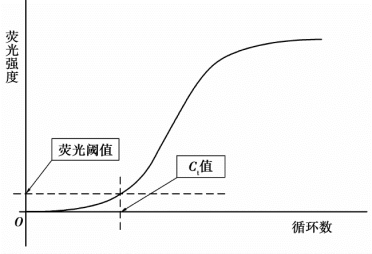
图5-3 荧光阈值、C t值和荧光曲线的关系示意图
研究表明,每个模板的C t值与该模板的起始拷贝数的对数存在线性关系,固定荧光信号值后,模板数就与循环数成反比,初始DNA量越多,荧光达到阈值时所需要的循环数就越少,即C t值越小。利用已知起始拷贝数的标准品可作出标准曲线,其中横坐标代表起始拷贝数的对数,纵坐标代表C t值,因此,只要获得未知样品的C t值,即可从标准曲线上计算出该样品的起始拷贝数(图5-4)。
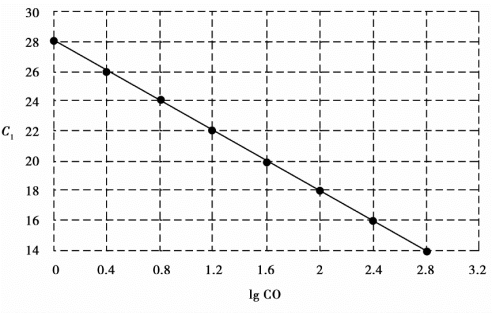
图5-4 起始拷贝数的对数(lg CO)和C t值标准曲线图
