CRISPR/cas9技术的其他几种应用
1.碱基转换
人类的大多数疾病都是基因的点突变引起的。改造后的CRISPR/Cas9系统可以实现碱基转换,虽然基因敲入的方法可以用来制作点突变的细胞模型或者动物模型,但是敲入效率不高,基因敲入的方法更难以纠正体内的基因突变。有研究者将dCas9和胞嘧啶脱氨酶(AID)偶联在一起,可以定点地将胞嘧啶和鸟嘌呤随机地向其他3个碱基转变。如果在细胞培养液中加入尿嘧啶DNA糖基化酶抑制剂,dCas9-AID可以将胞嘧啶单一地向胸腺嘧啶转换。有研究者首次运用dCas9-AID对ABL基因进行了耐药突变筛选,伊马替尼能够抑制ABL的激酶活性,是治疗慢性粒细胞白血病(ABL)的常规药物,运用dCas9-AID和一组sgRNA对ABL基因的第6号外显子进行突变筛选,找到了抗伊马替尼的新突变。
2.表观遗传调控
改造后的CRISPR/Cas9系统可用于表观遗传调控研究。DNA的甲基化和组蛋白的甲基化/乙酰化在表观遗传学中发挥着非常重要的作用,对基因组特定位点进行表观遗传修饰,有助于了解这些位点的表观遗传是否调控了相关基因的表达。在CRISPR/Cas9技术之前,科学家们运用TALE和羟化酶的催化结构域(TET1)结合,实现了定点去DNA甲基化修饰;运用TALE和赖氨酸特异性去甲基酶(LSD1)融合,实现了对组蛋白H3 K4和H3 K9的去甲基化修饰。Hilton等将dCas9和乙酰化转移酶P300的催化结构域结合,在基因组中实现了对组蛋白H3(Lys27)的定点乙酰化修饰;Kearns等人将dCas9和赖氨酸特异性去甲基酶(LSD1)融合,实现了定点去除组蛋白H3 K4和H3 K9甲基化的修饰。
3.内源基因的转录调控
改造后的CRISPR/Cas9系统可用于调控基因的表达。有研究显示,在大肠杆菌和哺乳动物细胞中,dCas9靶向结合基因的启动子区会阻碍转录因子/RNA聚合酶结合到启动子上,从而抑制了基因的转录。单纯的dCas9抑制基因转录的效率较低,而将dCas9与具有转录抑制功能的KRAB或者是SID效应蛋白连接在一起,会提高抑制效果;同理,把dCas9和VP64或者P65转录激活功能域相融合,能够激活内源基因的表达。一般情况下通过单个sgRNA上调基因表达的作用较小,通过多个sgRNA同时靶向一个启动子区域会显著增加基因表达。
4.全基因组范围内的遗传筛选
人类基因组计划完成后,接下来的工作是要研究所有注释基因的功能。对基因组内所有基因进行高通量的功能筛选可以快速找到想要的基因。运用CRISPR/Cas9技术能够实现全基因组范围内的筛选,筛选原理是对每个基因设计3~10条sgRNA,利用芯片一次合成数万条覆盖整个基因组sgRNA库,把这些sgRNA连接到慢病毒载体上,然后包装病毒、感染细胞、控制滴度使一个细胞只得到一条sgRNA,也就是只敲除一个基因,在适当的筛选条件下测试筛选前后sgRNA的丰度变化,进而找出感兴趣的基因(图4-3)。在CRISPR/Cas9技术出现之前,科学家们运用RNAi或者shRNA技术进行全基因组范围内高通量的功能筛查,但是这两种方法只能敲低基因的表达,而不能敲除,没有CRISPR/Cas9技术筛选灵敏。除了对基因进行高通量的筛选,zhu等运用DNA片段敲除技术成功地对癌细胞中的长非编码RNA(lncRNA)进行了高通量的功能筛选。随后有研究者把dCas9与转录激活因子(VP64和p65)或抑制因子KRAB连接,开发出了覆盖全基因组的转录抑制(CRISPRi)和转录激活(CRISPRa)文库,实现了对人类所有基因表达的调控筛选。
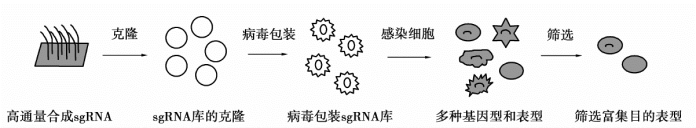
图4-3 全基因组范围内的遗传筛选流程
