二、λ噬菌体载体
λ噬菌体载体是最早使用的克隆载体之一,也是迄今为止研究得最为详尽的一种大肠杆菌双链DNA噬菌体载体,在重组DNA中被广泛应用。
1.λ噬菌体载体的生物学特性
λ噬菌体是一种中等大小的温和噬菌体,由DNA(λDNA)和外壳蛋白质组成。其外形特征类似于蝌蚪,由头和尾组成。头部呈等轴的二十面体,直径约54 nm,λDNA被包裹在其中;尾部无尾鞘,长150 nm,主要由衣壳蛋白组成。
λ噬菌体DNA是一条线性双链DNA分子,长度为48 502 bp。在其两端的5′末端各带有一个长为12个碱基(序列为5′GGGCGGCGACCT3′)的单链互补黏性末端。一旦进入宿主细胞,单链互补黏性末端便配对形成双链环状DNA分子,这种由黏性末端结合形成的双链区段称为cos位点。随后环状DNA的两切口在宿主细胞的DNA连接酶和促旋酶的作用下,形成封闭的环状双链,充当转录的模板。
λ噬菌体基因组DNA至少含有61个基因,其中有一半左右参与了噬菌体生命周期活动,这类基因称为λ噬菌体的必要基因;另一部分基因,当它们被外源基因取代后,并不影响噬菌体的生命功能,这类基因称非必要基因,如J基因至N基因之间的DNA序列以及P基因至Q基因之间的序列。取代了非必要基因的外源基因,可以随宿主细胞一起复制和增殖,这一点在基因工程中是非常重要的。为了介绍方便,将λ噬菌体基因组人为地划分为三个区域:①左侧区,从A基因到J基因,包含外壳蛋白的全部编码基因;②中间区,从J基因到N基因,这个区又称为非必需区,包含一些与重组有关的基因、使噬菌体整合到染色体的int基因,以及把原噬菌体从宿主染色体删除下来的xis基因;③右侧区,位于N基因的右侧,包含全部的主要调节基因以及噬菌体的复制基因(O、P)和溶菌基因(S、R)(图6-3)。
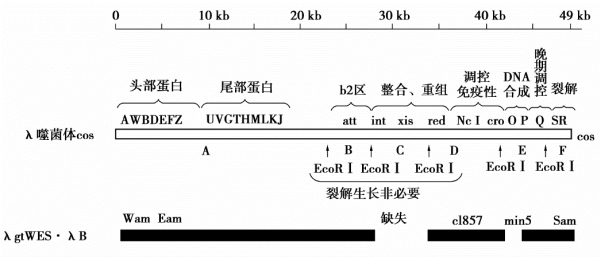
图6-3 λgtWES.λB噬菌体载体的构建
λ噬菌体具有溶菌和溶源两条生长途径。当λ噬菌体感染宿主细胞后,双链DNA分子通过cos而成环状。只有一部分细胞进入裂解循环时,λ噬菌体进行溶菌生长途径,借助于宿主的复制和转录系统的功能,环状DNA分子在宿主细胞内复制若干次,合成大量的噬菌体基因产物,形成子代噬菌体颗粒,成熟后使细菌裂解,释放出许多新的有感染能力的病毒颗粒。其他大多数感染的细胞进入溶源状态,λ噬菌体进行溶源生长途径,噬菌体DNA在特定的位点整合到宿主染色体DNA中,与宿主染色体形成一体,并随宿主染色体的复制而复制,随宿主的分裂繁殖而传递给下一代细菌。
2.λ噬菌体载体的构建
在基因工程中,λ噬菌体载体是最主要的一种载体。然而野生型的λ噬菌体并不适于直接用作基因克隆的载体,一方面λDNA基因组大而复杂,特别是其中具有多个基因克隆常用的限制酶识别位点(如5个BamH I位点、6个BglⅡ位点和5个EcoR I位点等);另一方面,λ噬菌体外壳只能接纳相当于基因组大小75%~105%的DNA分子。因此必须对野生型λDNA进行改造使之成为理想的基因克隆载体。对野生型的λ噬菌体的改造主要包括以下几方面。
①去除λDNA非必需区,增加承载外源DNA片段的容量。这是改造λDNA的首要目标。为此,改造中可以删除入噬菌体的非必需区,使入噬菌体载体可插入长5~20 kb的外源DNA片段,而不影响其感染力。这样改造后的λ噬菌体载体比质粒载体具有更大的装载能力。
②去除多余的限制酶切割位点,确定1~2个单酶切位点作为克隆位点。以野生型λ噬菌体为例,其DNA上有65种限制酶酶切点,除Apa I、Nae I、Nar I、Nhe I、SnaB I、Xba I和Xho I等7种限制酶各有一个切点外,其余都多于2个。有些酶切点在λ噬菌体增殖所必需的基因区域内。因此,在构建克隆载体时,对于某种限制性内切酶来说,只能保留1~2个单酶切位点作为克隆位点,用于插入或替换外源DNA片段,而必需区内的这种酶的识别序列必须用点突变或甲基化酶处理等方法使之失效,避免外源DNA片段的插入或替换。
③λDNA的非必需区装入选择标记基因,以方便对重组子进行筛选。在构建λ噬菌体载体时,所使用的选择标记不同于质粒的,质粒主要用抗生素抗性基因作标记,而在λ噬菌体载体中主要利用λ噬菌体的生物学特性来作选择标记。λ噬菌体中的选择标记主要有c I基因失活、Spi筛选、LacZ基因失活。
a.c I基因失活。基因c I是λ噬菌体的抑制基因,由其编码的蛋白质是一种阻遏物,能同操纵基因OL和OR结合,使参与溶菌周期的所有基因失去活性,从而促进λ噬菌体进入溶源状态;基因c I活性降低则会促进λ噬菌体进入裂解循环。如果外源DNA片段插入基因c I中,那么基因c I失活,使λ噬菌体进入裂解生长状态,结果将会形成清晰的噬菌斑。不同的噬菌斑形态学特征上的差别可作为重组体筛选的标志。
b.Spi筛选。野生型λ噬菌体在带有P2原噬菌体的溶源性E.coli中的生长会受到限制的表型,称作Spi+,即对P2噬菌体的干扰敏感。这种生长抑制作用受λ噬菌体red和gam两个重组基因编码的产物控制。当λ噬菌体中这两个参与重组的基因被外源DNA取代后,则获得了Spi-表型,可以在P2溶源性E.coli中生长并形成噬菌斑。因此,通过λ噬菌体载体DNA上的red和/或gam基因的缺失或替换,可在P2噬菌体溶源性细菌中鉴别重组和非重组λ噬菌体。但是这种筛选方法具有一定的局限性,只能用P2原噬菌体溶源性细菌作为受体菌。
c.LacZ基因失活。LacZ基因也可用于λ噬菌体载体,通过插入或替换载体中的β-半乳糖苷酶基因片段,在IPTG/X-gal平板上可通过噬菌斑的颜色筛选重组噬菌体。
④建立重组的λDNA分子的体外包装系统,高效地感染受体细胞。
λ噬菌体改造成基因工程中使用的载体,目的是把外源DNA片段插入载体中,并使它导入受体细胞。完成这一过程最简单的方法是用重组体DNA分子直接感染大肠杆菌,使之侵入宿主细胞内。这种由宿主细胞捕获噬菌体(病毒)DNA的过程称为转染;以噬菌体颗粒为媒介转移遗传物质的过程,特称为转导;而将质粒等外源DNA制剂引入细胞的过程,称为转化。从本质上看,λDNA的转染作用同质粒DNA的转化作用并无原则上的差别,但在一般情况下,转化得到的是转化子菌落,转染得到的是噬菌斑。相对于转化作用,转染是一个低效的过程,很难满足一般的实验要求。所以在基因操作中,λ重组体DNA的直接转染并不常用。目前主要应用体外包装技术,将λ重组体DNA包装进噬菌体颗粒,再转导受体细胞,这样便提高了外源DNA片段导入细胞的效率。
所谓λDNA的体外包装,就是在试管中完成噬菌体在宿主细胞内的全部组装过程。建立体外包装系统的关键是筛选获得D基因和E基因缺失的入噬菌体突变株D-和E-。而λ噬菌体突变株D-和E-是一对互补的头部突变型噬菌体。将这两种不同突变型的噬菌体提取物混合起来,就能够在体外装配成有生物活性的噬菌体颗粒。当λ噬菌体突变株D-和E-分别感染受体菌时,二者均能复制λDNA分子,但不能把λDNA包装成噬菌体颗粒。当两个受体细胞合成的蛋白质混合后,则D蛋白和E蛋白彼此互补,能有效地将复制的λDNA分子包装成为成熟的噬菌体颗粒。上述突变株的受体菌经诱导培养后可提取用于包装全部蛋白质,成为λDNA分子的体外包装系统。用体外包装形成噬菌体颗粒的方法将重组体DNA导入受体菌,每微克DNA可形成106个噬菌斑,比不包装的裸露DNA分子的效率高100~10 000倍。
3.λ噬菌体载体种类
随着体外包装技术和寡聚核苷酸合成技术的发展,人们已经构建了许多λ噬菌体的派生载体,可以归纳成两种不同的类型:插入型载体和置换型载体。
(1)插入型载体
通过特定的酶切位点允许外源DNA片段插入的载体称为插入型载体。由于λ噬菌体对所包装的DNA有大小的限制,因此一般插入型载体设计为可插入6 kb(最大为11 kb)外源DNA的片段。(https://www.daowen.com)
插入型载体又分为两种类型:①c I基因插入失活。如λgt10、λNM 1149等载体,在c I基因上有EcoR I及HindⅢ的酶切位点,外源基因插入后将导致c I基因失活。c I基因失活后噬菌体不能溶源化,产生清晰的噬菌斑;相反,则产生浑浊的噬菌斑。因此可利用不同的噬菌斑形态作为筛选重组体的标志。②lacZ基因插入失活。如λgt11、Charon2、Charon16A载体,在非必需区引入lacZ基因,在lacZ基因上有EcoR I位点,插入失活后利用X-gal法筛选(蓝白斑筛选)。
(2)置换型载体
允许外源DNA片段替换非必需DNA片段的载体,称为置换型载体,又称取代型载体。这类载体是在λ噬菌体基础上改建而成的,由左臂、右臂以及左右臂之间的一段填充片段组成,其中左臂包含使噬菌体DNA成为一个成熟的、有外壳的病毒颗粒所需的全部基因,全长约20 kb;右臂包含所有的调控因子、与DNA复制及裂解宿主菌有关的基因,这个区域约长12 kb;中间填充片段约长18 kb,这一段DNA可以被外源片段置换而不会影响λ噬菌体裂解生长的能力。置换型λ噬菌体是使用最广泛的载体。一般情况下,置换型载体克隆外源片段的大小为9~23 kb,常用来构建基因组文库。随着多克隆位点技术的应用,现在许多常用的λ噬菌体载体都带有多克隆位点,两个多克隆位点区往往以反向重复形式分别位于DNA的填充片段两端。当外源DNA插入时,一对克隆位点之间的DNA片段便会被置换掉,从而有效提高克隆外源DNA片段的能力。
λNM781是替换型载体的一个代表。在λNM781载体中,可取代的EcoR I片段,编码有一个supE基因(大肠杆菌突变体tRNA基因),由于这种λNM781噬菌体的感染,宿主细胞lacZ基因的琥珀突变便被抑制,能在乳糖麦康基琼脂培养基上产生红色的噬菌斑,或是在X-gal琼脂培养基上产生蓝色的噬菌斑。如果这个具有supE基因的EcoR I片段被外源DNA取代,那么所形成的重组体噬菌体,在上述这两种指示培养基上都只能产生无色的噬菌斑。
4.柯斯质粒载体
柯斯质粒载体是一类人工构建的含有λDNA cos序列和质粒复制子的特殊类型的载体,也称为黏粒载体,即由质粒和λ噬菌体的黏性末端构建而成。借用cos-(黏性尾巴)作字头、质粒的-mid作字尾,故称cosmid。柯斯质粒是1978年J.Coffins及B.Hohn等发明的,比λ噬菌体具有更大的克隆能力,在真核基因的克隆中起到了巨大的作用。
(1)柯斯质粒载体的构成
柯斯质粒载体是一种环状双链DNA分子,大小为4~6 kb。它由四部分组成,即质粒的复制起点、一个或多个限制性核酸内切酶的单一切割位点、抗性标记基因和λ噬菌体的黏性末端片段。来自λDNA部分的片段除了提供cos位点外,在cos位点两侧还具有与噬菌体包装有关的DNA短序列,这样就能够包装成有感染性的噬菌体颗粒。
柯斯质粒载体兼具有λ噬菌体的高效感染能力和质粒易于克隆选择的优点。外源DNA片段插入到柯斯质粒载体特定位置,便形成重组的柯斯质粒,就可以包装到噬菌体颗粒中。由于缺失λDNA复制起点,这时噬菌体颗粒不能像λ噬菌体颗粒一样复制,但是有感染力,可以携带重组DNA进入宿主细菌细胞中。进入细胞后,柯斯质粒DNA可以利用质粒的复制起点像质粒一样复制。柯斯质粒载体克隆能力为31~45 kb,是早期构建基因组文库的首选载体。图6-4是常用的柯斯质粒载体pHC79的基本结构。
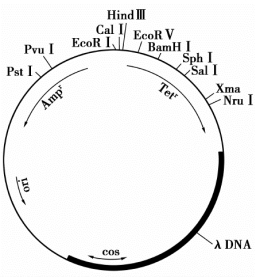
图6-4 柯斯质粒载体pHC79的结构图
(2)柯斯质粒载体的特点
目前已经在基因克隆通用的质粒载体的基础上,发展出了许多不同类型的柯斯质粒载体。柯斯载体的特点大体上可归纳为以下四个方面。
第一,具有λ噬菌体的特性。由于柯斯质粒载体不含λ噬菌体裂解生长、溶源性途径和DNA复制系统,所以不会产生子代噬菌体。但是,此载体含有一个cos位点,在A蛋白的作用下,cos位点被切开,提供体外包装必需的cos末端。柯斯质粒载体在克隆了合适长度的外源DNA,并在体外被包装成噬菌体颗粒之后,可以高效地转导对噬菌体敏感的大肠杆菌宿主细胞。进入宿主细胞之后的柯斯质粒DNA分子,便按照λ噬菌体DNA同样的方式环化起来。但由于柯斯质粒载体不含有λ噬菌体的全部必要基因,因此它不能够通过溶菌周期,无法形成子代噬菌体颗粒。
第二,具有质粒载体的特性。柯斯质粒载体具有质粒复制子,因此在宿主细胞内能够像质粒DNA一样进行复制,并且在氯霉素作用下,同样也会获得进一步的扩增。此外,柯斯质粒载体通常也具有抗生素抗性基因,可作重组体分子表型选择标记,其中有一些还可带上基因插入失活的克隆位点。
第三,具有高容量的克隆能力。柯斯质粒载体的分子一般只有5~7 kb。按λ噬菌体的包装限制(38~52 kb),可以插入到柯斯质粒载体上并能被包装成噬菌体颗粒的最大外源DNA片段可达45 kb左右。同时,由于包装限制,柯斯质粒载体的克隆能力还存在着一个最低极限值。如果柯斯质粒载体自身大小为5 kb,那么插入的外源DNA片段至少要有33 kb,才能包装形成具有感染性的噬菌体颗粒。由此可见,柯斯质粒载体适用于克隆大片段的DNA分子。
第四,具有与同源序列的质粒进行重组的能力。柯斯质粒载体能与共存于同一宿主细胞中的带有共同序列的质粒进行重组,形成共合体。当一个柯斯质粒载体与带有不同抗药性标记的质粒转化同一宿主细胞时,便可筛选到具有相容性复制起点的共合体分子。
(3)柯斯质粒载体克隆基因的基本程序
柯斯质粒载体具有质粒载体的性质,可以按照一般质粒克隆载体进行操作,转化宿主细胞,可在宿主细胞内进行自我复制。实际上,使用柯斯质粒载体主要是利用其λ噬菌体载体性质。但是使用柯斯质粒克隆载体的程序与使用入噬菌体克隆载体的程序有所不同。在λ噬菌体的正常生命周期中,它会产生由数百个λDNA拷贝,通过cos位点彼此相连而组成的多连体分子。同时,λ噬菌体还有一种位点特异的切割体系,叫作末端酶或Ter体系,它能识别两个距离适宜的cos位点,把多连体分子切割成单位长度的片段,并把它们包装到λ噬菌体头部中。Ter体系要求被包装的DNA片段具有两个cos位点,而且两个cos位点之间的距离要保持在38~54 kb,这些条件对柯斯质粒克隆外源基因进行体外包装是非常重要的。
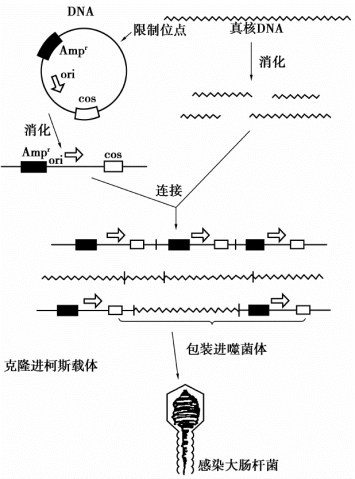
图6-5 柯斯质粒载体进行基因克隆的基本程序
应用柯斯质粒载体克隆外源DNA的一般程序是(图6-5):先用适当的限制性核酸内切酶部分水解真核DNA,产生平均大小为40~45 kb的DNA片段,与经同样的限制性内切酶酶切的柯斯质粒载体线性DNA分子进行连接反应。由此形成的连接物群体中,有一定比例的分子是两端各带一个cos、中间外源DNA片段长度在40~45 kb的重组体。这样的分子同λ噬菌体裂解生长晚期所产生的DNA分子类似,可作为λ噬菌体Ter功能的一种适用底物。当与λ噬菌体外壳包装物混合时,它能识别并切割这种两端由cos位点包围着的40~45 kb长的真核DNA片段,并把这些分子包装进λ噬菌体的头部。当然,由包装形成的含有这种DNA片段的λ噬菌体头部则不能够作为噬菌体生存,但它们可以用来感染大肠杆菌。感染之后,可将这种真核DNA-cos杂种分子注入细胞内,并通过cos位点环化起来,然后按质粒分子的方式进行复制并表达其抗药性基因,使宿主获得抗性,最后获得大肠杆菌菌落,而不是噬菌斑。
