基因编辑的执行手段
1.基因敲除
基因编辑在利用CRISPR/Cas9做基因敲除时,sgRNA的选择至关重要。要破坏一个基因的功能,理想的情况是在基因编码重要功能域的位点设计sgRNA,但是大多数情况下研究者不知道此段基因编码了哪些重要功能域。在编码区的最前端接近起始密码子ATG的区域设计sgRNA进行编辑,移码突变会造成整个基因无法表达。但是有些情况下,这个基因会从后面的ATG开始表达,表达出来的蛋白依然能够行使功能。如果编辑的位点过于靠近编码区的后端,那么前面很长的蛋白就会被表达,就可能依然保留其功能。Doench等通过分析多个基因发现,在编码区起始位点长度的5%~65%区域内设计sgRNA可以最大可能地敲除基因。有些基因包括多个转录本,要把sgRNA设计在它们共同的区域,才能敲除所有的转录本,注意不要把sgRNA设计在基因的内含子区,要根据编码区进行设计。编码区是多个外显子拼接在一起的序列,sgRNA不要跨在两个外显子上,因为研究者最终编辑的是基因组DNA,两个外显子在基因组上是被内含子分开的,跨两个外显子的sgRNA序列在基因组中是不存在的。
2.调控CRISPR/Cas9系统
在研究中有时需要对Cas9的表达进行精确调控,从而阐明特定时间内的基因在生物体中的功能;有时还需要在特定的组织或者器官中表达Cas9,以阐释组织特异性的基因在个体发育中的功能。基于上述需求,科学家们开发出了多西环素诱导的CRISPR/Cas9系统,在小鼠以及人类胚胎干细胞(hES)中实现了对Cas9表达的时间控制。有研究者将Cas9蛋白分成两个失活的片段,并且分别连接上光控蛋白,当蓝光照射时,两个光控蛋白连接到一起,Cas9核酸酶功能随之恢复,停止光照,Cas9蛋白会再度分开,这样就可以通过光照从时间和空间上对内源基因的表达进行调控。
3.基因敲入
基因敲入是经常要用到的一项重要技术,比如要研究患者携带的基因突变是否具有致病性,就需要将这个点突变引入细胞或动物中制作模型;要研究一个基因在哪个组织中表达,就需要在这个基因上面连上GFP报告基因。在做基因敲入时,需要将一个与编辑位点同源的DNA供体和CRISPR/Cas9共同转染到细胞中,细胞内的修复系统修复DNA双链断裂时,会将供体上携带的点突变或者转基因拷贝到双链断裂处。这个供体模板可以是质粒DNA,也可以是单链Oligo DNA。利用质粒DNA作供体时,敲入的效率比较低,需要在供体上加入标记基因,标记基因与点突变一同被引入到基因组上,通过药物筛选或者流式分选的方法将敲入的细胞筛选出来,这样效率就大大提高了。编辑完成后,标记基因需要移除以免影响基因表达。移除的方法是设计时在标记基因的两端加上LoxP位点,在细胞中瞬时表达Cre重组酶就可以去除标记基因了。去除后,基因组中会留下一个34 bp的LoxP位点,所以设计的时候需要把标记基因及LoxP位点放在内含子区。因为转染效率,不是所有的细胞都会去除标记基因。所以一般都用嘌呤霉素抗性基因和单纯疱疹病毒胸苷激酶(HSV-tk)融合的基因作为标记基因,嘌呤霉素抗性基因用作正向筛选,HSV-tk在去除标记基因时用作负向筛选,加上更昔洛韦就可以杀死含有标记基因的细胞。用质粒DNA作供体的优点是:可以将大片段的转基因敲入细胞中,经过筛选后效率很高,缺点是:构建载体比较麻烦,而且需要两步(敲入和去除标记基因)才能得到细胞系。
单链DNA也可以作为基因敲入的供体。单链DNA供体在DSB两边的同源臂长度以40~50 bp为佳。利用单链DNA可以把点突变和短的DNA序列整合到基因组中,但它无法将较大的基因敲入基因组,因为目前Oligo合成的长度一般少于150 bp。单链DNA比较短,容易大量转入细胞中,在一些实验中取得了较高的敲入效率,最高可达60%。单链DNA合成成本低、速度快,编辑完成后不需要去除标记基因,但这种方法也有明显的局限,即突变的敲入效率受CRISPR/Cas9切割位点的影响,单链DNA上的突变位点与切割位点小于10 bp才能实现有效的敲入,很多情况下找不到理想的切割位点。敲入效率也受细胞类型的影响,很多情况下效率太低难以筛选到阳性克隆。有研究表明,加入DNA ligase IV的抑制剂Scr7可以提高同源重组的效率,DNA ligase IV是NHEJ途径的关键酶,抑制了NHEJ途径就会促进HR途径,但每种细胞对Scr7浓度的耐受程度不同,提高的效率也相差很大,从二三倍至十几倍,需要花时间摸索最佳的条件,所以很少有人使用。另外,NHEJ途径被Scr7抑制后是否会增加基因组的突变需要进一步研究。无论用单链DNA还是用质粒DNA做基因敲入,都需要在供体上CRISPR/Cas9识别的位置加上几个同义的碱基突变,以免敲入成功后又被CRISPR/Cas9破坏了。
除了上述两种常用的基因敲入方法,还有其他几种方法值得借鉴。有研究发现,通过NHEJ方法可以有效地将外源基因定点整合到基因组。利用NHEJ途径插入外源基因时,需要在供体质粒上引入编辑位点,基因组和供体质粒同时被切断,供体质粒DNA会被连接到基因组上,但是这种连接有正反两个方向。细胞中除了经常提及的NHEJ和HR修复途径,还有一个微同源性末端连接(MMEJ)修复途径,它依靠5~25 bp的同源序列将DNA两端融合在一起。有研究者在供体质粒上设计了两个20 bp的同源臂,基因编辑技术同时切断基因组DNA质粒和供体质粒,供体质粒会通过MMEJ定向整合到基因组。但是这两种方法的效率都不高,最近有两个课题组发现,把同源臂增加到600~800 bp可以显著提高敲入效率。随着研究的深入,更多的新方法会被发明出来。
4.CRISPR/Cas9导入细胞
CRISPR/Cas9可以对体外培养的细胞系或者原代细胞进行编辑,也可以对受精卵和体内细胞进行编辑。编辑不同的对象需要采取不同的方法将CRISPR/Cas9导入到细胞中。编辑体外培养细胞时,有很多种方法可以将CRISPR/Cas9质粒导入到细胞中,常用的方法是Lipofactamine、PEI和电转。Lipofactamine和PEI简单廉价,是首选方法;电转成本比较高,但是效率高。这几种方法都是瞬时转染,细胞培养1周后质粒就会丢失。某些类型的细胞只有用病毒的方法才能转进去,常用的病毒载体包括逆转录病毒、慢病毒、腺病毒和腺相关病毒(adeno-associated virus,AAV)。其中逆转录病毒和慢病毒会整合到基因组,可以长期表达转基因,优点是可以提高编辑效率,缺点是整合过程中可能会导致额外的基因突变,长期表达CRISPR/Cas9也会增加脱靶的效率。AAV主要以非整合形式表达转基因,但是会有少量整合的情况发生。AAV载体在机体中产生的免疫排斥小,是基因治疗的理想载体。有研究发现,一个较小的Cas9蛋白可以包装在AAV病毒中,这给基于CRISPR/Cas9的基因治疗带来了希望。腺病毒不会整合到基因组,对某些类型的细胞转染效率较高。上述几种方法都有各自的优缺点,需要研究人员根据实验需要选择合适的方法。
建立单克隆细胞系一般都采用瞬时表达sgRNA和Cas9的方法,质粒导入到细胞中2~4 d后,将细胞稀释成单细胞重新种到培养皿中培养,形成克隆后鉴定编辑是否发生。有的细胞不能形成克隆,需要将单细胞种到96孔板中培养。有些细胞转染效率低,需要在质粒上同时表达GFP,通过流式细胞仪分选出转染成功的细胞会提高编辑效率。最常用的CRISPR/Cas9质粒如PX458(同时表达GFP)、PX459(同时表达puromycin抗性基因)等,均可从Addgene公司购买。
利用CRISPR/Cas9敲除基因时,瞬时表达的方法编辑时间短,编辑效率一般为3%~30%;利用病毒的方法可以长期提高编辑效率,但是病毒整合到基因组上就无法去除了。理想的方法是编辑时间可控,编辑后细胞不再含有CRISPR/Cas9等外源基因。附着体载体不整合到基因组,但可以随着细胞的复制而复制,就像普通质粒可以在细菌中复制一样。在嘌呤霉素的筛选作用下附着体载体一直保留在细胞中,外源基因长期稳定地表达,可以长期编辑细胞。嘌呤霉素筛选还可以富集转染成功的细胞,即使转染效率很低的细胞也能够实现高效的编辑;编辑完成后,去除筛选药物,附着体载体会在1周内迅速丢失,细胞中不再表达外源基因。附着体CRISPR的编辑效率一般在80%以上,附着体CRISPR还可以实现高效的多基因敲除和基因组片段敲除。
如果编辑的目的是制作动物模型,则需要对动物的受精卵进行编辑。受精卵中储备了大量的mRNA,很少有新的基因转录发生,因此不能使用DNA质粒表达Cas9和sgRNA,需要将sgRNA和Cas9在体外转录成mRNA,通过显微注射的方法导入细胞中。制作基因编辑的小鼠和斑马鱼请参考Jaenisch和Burgess实验室的方法。
5.提高CRISPR/Cas9的特异性
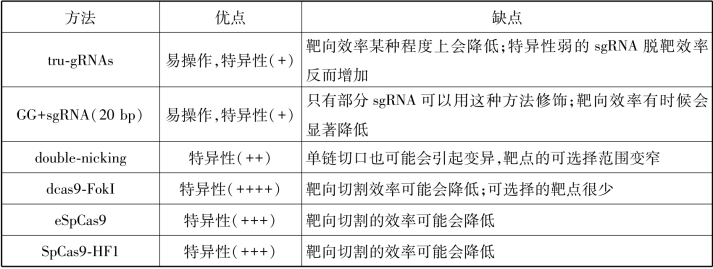
提高CRISPR/Cas9特异性的方法除了选择特异的sgRNA序列外,还有其他方法。5′末端截短的sgRNA(Tru-sgRNA)也可以提高Cas9的特异性。Tru-sgRNA一般只有17或18 bp和靶向序列互补配对,短的sgRNA可能无法和错配的DNA序列结合,因而能够提高特异性。在sgRNA的5′端额外加入两个G,即5′GG+sgRNA(20 bp),也可以提高靶向特异性,但这两种方法有时候会严重降低靶向切割效率。
双切口(double-nicking)技术是最早报道的提高特异性的方法。Cas9蛋白具有两个核酸酶结构域,分别是RuvC和HNH,每个结构域分别负责切断一条DNA单链,一个结构域突变后不影响另外一个结构域的切割功能,在RuvC结构域引入D10A突变后,Cas9只能切断单链(single-strand break,SSB)DNA。如果在DNA上设计两个sgRNA,引导Cas9分别切断两条单链DNA,就会形成双链断裂,因为识别的DNA序列变长了,所以特异性就提高了。单个sgRNA脱靶后只能切割产生单链DNA断裂,被修复后一般不会产生突变。有两个课题组将RuvC、HNH突变后,Cas9完全失去了切割功能,但是保留了靶向结合DNA的功能,被称为dCas9(dead Cas9)。将dCas9和Fok I融合为核酸酶,类似于前面介绍的ZFN和TALEN,单个dCas9-FokI脱靶后不会切割DNA,从而进一步提高了特异性。但是这两种方法都有其局限性,它们需要两个sgRNA活性都高才能有效地发挥功能,且后者对两个sgRNA距离有严格的条件要求,FokI酶才能形成二聚体发挥作用,这样的位点在基因组中非常少,因此这些方法没有得到广泛应用。
2015年,张锋和Keith实验室通过对SpCas9蛋白的改造提高特异性,两个实验室采用了不同的策略,但都达到了提高特异性的目的。SpCas9与DNA结合时,它上面的正电荷氨基酸形成一个凹槽,与负电荷的DNA结合,这种结合是非特异性的。张锋实验室在凹槽区域用中性电荷氨基酸来代替正电荷的氨基酸,得到的SpCas9叫作eSpCas9,它与DNA非特异性的结合力减弱,脱靶效应被降低。与此同时,Keith实验室采取另外一种原理降低脱靶效应。当SpCas9核酸酶与DNA结合时,SpCas9上的一些氨基酸会和DNA的磷酸骨架之间形成氢键,增加SpCas9和DNA之间的非特异性结合力。如果将形成氢键的氨基酸替换为不能形成氢键的氨基酸,得到的SpCas9称为SpCas9-HF1,它与DNA非特异性的结合力减弱,从而降低脱靶效应。这两种方法虽然降低了脱靶效应,但是有时也会降低靶向切割的效率。高特异性Cas9可能会在临床应用方面发挥重要作用,关于各种提高特异性方法的总结见表4-3。
表4-3 提高CRISPR/Cas9特异性的方法