肺泡性蛋白沉积症和遗传性表面活性物质代谢异常疾病
(一)肺泡性蛋白沉积症
肺泡性蛋白沉积症(pulmonary alveolar proteinosis,PAP)又称肺泡磷脂沉着症(pulmonary alveolar phospholipidosis),是一种原因不明的少见慢性肺疾病,其特点为肺泡内有富含脂质的过碘酸雪夫(PAS)染色阳性蛋白物质沉着,这些物质被称作表面活性物质,是磷脂和各种表面活性蛋白的混合物。由于肺泡腔和呼吸道内堆积过量的表面活性物质,致使肺的通气和换气功能受到严重影响,导致呼吸困难。呼吸困难是肺泡蛋白沉积症最为突出的临床表现。儿童阶段的PAP有3种类型:遗传性PAP,原发性的PAP或特发性的PAP,继发性的PAP。
1.病因及发病机制 遗传性PAP主要指基因疾病,即编码粒细胞巨噬细胞集落刺激因子(granulocyte macrophage colony stimulating factor,GM-CSF)受体的α、β链的基因(CSF2RA或CSF2RB)突变所致GM-CSF受体的α、β链的表达缺陷均可引起早期发病的PAP。下述的如肺泡表面活性物质蛋白B(surfactant protein B)基因的突变致表面活性物质蛋白B的缺陷,表面活性物质C、ABCA3的基因突变均可引起PAP的改变,过去称为先天性致死性PAP。原发性的PAP则由机体产生了抗GM-CSF的自身抗体,而GM-CSF可调节巨噬细胞的清除表面活性物质的功能。在成人的原发性的PAP的血清、支气管肺泡灌洗液中有高滴度的GM-CSF抗体IgG1、IgG2的检出,该自身抗体可封闭GM-CSF与其受体的结合,从而抑制了巨噬细胞的功能和表面活性物质的清除。这一自身抗体在年长儿的原发性的PAP中有发现,但未在先天性的PAP中发现。
继发性的PAP,如继发于肿瘤、免疫抑制,如无机粉尘(铝、二氧化硅)、有机粉尘锯末等有毒气体或感染。可能的机制:①正常或异常的肺泡内物质生成过多(包括磷脂和板层小体)。②肺泡巨噬细胞数目减少或功能受损,使其对磷脂蛋白的清除功能异常;肺泡巨噬细胞分解板层小体的能力受损。③肺泡Ⅱ型细胞的过度增生和破坏。
2.病理特点 大体检查可见多数大小不等的、坚实的灰色或灰黄色结节,位于全肺的胸膜下,以致肺质量增加。有时肺切面有黄白色液体渗出。PAP最主要的病理改变是肺泡腔内充填微小颗粒状的过碘酸雪夫(PAS)染色阳性的无细胞物质。冰冻切片显示病肺的肺泡腔内含有丰富的脂类物质,ORO(Oil Red O)染色或苏丹黑染色清晰可辨。此外,在颗粒状物质内常有胆固醇结晶,有时在微小颗粒体之间出现较大的致密而坚实的PAS染色阳性的凝块。肺泡Ⅱ型细胞呈增生性变化,而肺巨噬细胞常呈泡沫状外观,特别是在肺的外周组织尤为明显。镜下可见肺泡内充满颗粒状嗜伊红沉着物,糖原染色及过碘酸雪夫反应阳性,而奥辛兰(alcine blue)染色阴性,电镜检查可见肺泡内蛋白样物质含板层小体,其性质与Ⅱ型肺泡上皮细胞的细胞质相同,特殊染色在肺泡碎屑有糖类、蛋白质及多量磷脂。肺泡上皮有增生,但肺泡间隔无炎症及纤维化。
3.临床表现 遗传性的PAP,可发生于1~9岁,甚至更晚,症状主要为气短、呼吸困难、乏力,可有发绀、杵状指(趾)。原发性的PAP起病可急可缓,运动不耐受是最常见的首发表现,若未予诊断,则可表现为进行性呼吸困难和咳嗽。可伴发热、无力、体重减轻、胸痛、咯血及食欲减退,后期可出现发绀、杵状指(趾)。继发感染时痰可呈黄色脓性。肺部体征少,仅有少许散在湿啰音或胸膜摩擦音。
4.辅助检查 实验室检查可见血清IgA降低。
(1)X线表现:典型X线胸片可见弥漫性羽毛状浸润,从肺门弥散到肺周缘,呈蝴蝶状,略似肺水肿。有些患儿开始时呈结节状阴影,从两下叶浸润进展为整个大叶实变。病灶之间有代偿性肺气肿或形成小透亮区。纵隔明显增宽,X线酷似肺水肿,但无K-B线。
(2)胸部CT检查:尤其是高分辨CT对PAP有很大诊断价值。病变肺组织常呈磨玻璃样改变,小叶间隔增厚,可呈铺路石样的改变。
(3)肺功能测定:显示限制性通气功能障碍,肺活量下降,呈弥散功能障碍。动脉血气示血氧饱和度减低及慢性呼吸性的酸中毒。
(4)支气管肺泡灌洗液(BALF)检查:典型的肺泡灌洗液呈乳状或浓稠浅黄液体。在光镜下见炎细胞间有大量形态不规则、大小不等的嗜酸性颗粒状脂蛋白样物质,PAS染色阳性。
5.诊断与鉴别诊断 确诊需经支气管镜作肺活检及病理检查。BALF检查结合病史和临床表现、胸部影像学的检查,可对大多数PAP患儿做出诊断。进一步可行SP-B、SP-C、ABCA3以及CSF2RA或CSF2RB的基因突变的筛查,还可用乳胶凝集试验检测血中和支气管肺泡灌洗液的GM-CSF抗体的含量,对后天获得的PAP的诊断有较高的敏感和特异性。鉴别诊断时应注意除外肺水肿、肺纤维化、结节病、肺含铁血黄素沉着症、肺真菌病及卡氏肺囊虫病等。
6.治疗 无特效治疗,肾上腺皮质激素无效。原发性的PAP可用GM-CSF替代治疗有较好的疗效。成人有试用蛋白溶解酶雾化吸入或间歇正压呼吸器吸入。近年来行支气管肺灌洗术,是已被证明有效的治疗方法。用每升含10g乙酰半胱氨酸和7500U肝素的生理盐水行肺灌洗清除肺泡内物质,曾收到良好的效果。单纯的生理盐水灌洗可获同样效果。支气管肺泡灌洗通过BAL将沉积在肺泡的表面活性物质排出,从而改善肺通气和换气功能,很多情况下仅能暂时缓解症状,需定期反复进行。其他治疗如肺移植及骨髓移植。
(二)遗传性表面活性物质代谢异常疾病
肺泡表面活性物质是磷脂和蛋白质的复杂混合物,表面活性物质在肺泡空气界面形成一层薄膜,在每个呼气末保持低表面张力和防止肺泡塌陷。这层表面活性物质薄膜的伸展和稳定需要表面蛋白B和C。分泌后,表面蛋白质和脂质被呼吸道上皮细胞回收再循环利用。ATP结合盒转运子A3(ABCA3)是ABC家族的成员,ABCA3的主要功能是运输表面活性物质的重要脂质。
表面活性蛋白B(surfactant protein B,SP-B)、表面活性蛋白C和ABCA3基因的突变可以引起儿童间质性肺疾病,其组织病理学表现多种多样,包括脱屑性间质性肺炎(DIP)、婴儿慢性肺泡炎(CPI)、肺泡蛋白沉积症(PAP)和非特异性间质性肺炎(NSIP)。
1.表面活性蛋白B缺乏症
(1)基因学:表面活性蛋白B缺乏症(SP-B deficiency)这是一种常染色体隐性遗传病,表面活性蛋白B基因是位于人的第二染色体上。这个大约9.5kb基因编码一个2kb mRNA转录本。已识别30多个隐性的SP-B基因功能缺失的突变导致SP-B的完全和部分缺失。最常见为121 ins2基因突变,即在基因位置密码子121的g.1549的GAA替换C。此点突变导致移码并在第6外显子产生提前终止翻译的密码子,生成一种易变RNA转录物,使pro SP-B及成熟SP-B缺乏,并引起SP-C前体蛋白的不完全表达。这一突变的基因频率估计为1/3000~1/1000。这一突变占表面活性蛋白B缺乏症的70 。此基因突变来自其父母,无自发突变。
。此基因突变来自其父母,无自发突变。
(2)发病机制:SP-B缺乏症导致异常的表面活性物质成分和功能以及板层小体的结构破坏。卵磷脂的成分和合成在体外正常,但在受影响的婴儿用同位素示踪其表面活性物质的前体研究发现,与其他慢性肺病相似,卵磷脂存在一定程度的减少。SP-B缺乏的同时有SP-C的不完全加工,导致6kD的SP-C前体(氨基末端侧翼12个氨基酸)的存在,而未加工的SP-C前体在体外抑制表面活性物质的功能,因而进一步加重了SP-B缺乏症的表面活性物质功能缺失。
(3)病理特点:可表现为最初描述的初生儿的肺泡蛋白沉着症,但并不是所有的患儿均表现为肺泡蛋白沉着症,一些SP-B缺乏症的121 ins2的突变的纯合子在肺移植时其肺部病理表现为肺泡腔内大量的肺泡巨噬细胞的聚集如脱屑性间质性肺炎(DIP),以及很少的肺泡蛋白沉着。其他发现包括非特异性的不同程度的肺纤维化和肺泡细胞的增生。超微结构的发现包括管状髓磷脂的缺乏、板层小体的紊乱和异常出现的多囊体的聚集,均说明了异常的脂质和分泌。
(4)临床表现:SP-B缺乏症是一罕见的疾病,可在不同的种族中发现。临床估计发生率为每百万活产儿中有1例。见于足月儿,生后不久即出现呼吸窘迫综合征的临床特点和影像学特征,且快速进展,用表面活性物质替代和辅助通气治疗疗效不佳,大多在出生后3~6个月死亡。(https://www.daowen.com)
(5)影像学:胸片与早产儿肺透明膜病相似,显示弥漫的模糊和支气管征。
(6)诊断:SP-B基因突变的确定,酶联染色测定支气管分泌液显示SP-B缺乏和SP-C前体增加。肺组织免疫组化显示SP-B缺乏和SP-C前体增加。
(7)治疗:唯一有效的治疗是肺移植。SP-B缺乏症的婴儿对表面活性物质的替代物显示一过性反应、对激素无反应。
(8)预后:如果无肺移植,几乎所有的患儿均死亡。
2.表面活性蛋白C基因异常和肺部疾病
(1)基因学:表面活性蛋白C(surfactant protein C,SP-C)是由8号染色体上的SFTPC基因编码的。这个大约3.5kb的基因编码一个0.9kb的转录本,然后转录为191或197的氨基酸前蛋白。SP-C的前多肽经过一系列的蛋白水解切割产生35氨基酸的疏水的成熟的SP-C蛋白。超过35个显性表达的SFT-PC基因突变可引起从新生儿到成年人的急性和慢性的肺疾病。大约55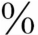 的突变的病例为自发的突变和散发的病例。其余的为遗传性的。这些突变可发生于整个基因的任何部位,包括错义、片段移位、插入、缺失和拼接位点的突变。最常见的突变为位于g.1295的T转为C,导致密码子73(173 T)的苏氨酸代替异亮氨酸。这个突变与25
的突变的病例为自发的突变和散发的病例。其余的为遗传性的。这些突变可发生于整个基因的任何部位,包括错义、片段移位、插入、缺失和拼接位点的突变。最常见的突变为位于g.1295的T转为C,导致密码子73(173 T)的苏氨酸代替异亮氨酸。这个突变与25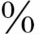 的SP-C基因突变的疾病相关。p.173 T的突变在散发病例和遗传的病例均有发现。还有ISV4+1G>C的突变,BRICHOS显性基因突变,如c.298 G>A(G100S)、A116D的SP-C基因突变。
的SP-C基因突变的疾病相关。p.173 T的突变在散发病例和遗传的病例均有发现。还有ISV4+1G>C的突变,BRICHOS显性基因突变,如c.298 G>A(G100S)、A116D的SP-C基因突变。
(2)发病机制:成熟的SP-C和LPS的相互作用,提示SP-C参加肺的监管。在SP-C敲除的小鼠有肺泡的持续炎症和肺泡结构性的进行性改变。在间质性肺疾病的患儿缺乏SP-C。SP-C的功能是建立在基于其特殊的结构和疏水性,但插入磷脂膜时,SP-C可干扰脂质的包装,促进脂质在膜内的运动。SP-C的生物生理特性取决于其膜整个版图的螺旋的结构,胜于其氨基酸顺序。前驱蛋白在成熟的SP-C的介导下形成非共价的聚体。SP-C基因的突变,可导致误叠的前SP-C在肺泡Ⅱ型上皮细胞的细胞质的如内质网、高尔基体的聚集,导致细胞压力反应的激活,随后的细胞损伤和凋亡。突变的频率与突变致疾病的关系不详。
在成人的一项100例的特发性肺纤维化的病例中,只有1例为SP-C基因173T的突变,说明在老年患儿的发生率低38。然而在一项639例的足月婴儿的原因不明的急性和慢性的肺疾病中,52(8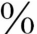 )例有SP-C基因的突变。大约一半的基因突变为新生的突变,另一半为遗传其父母一方。
)例有SP-C基因的突变。大约一半的基因突变为新生的突变,另一半为遗传其父母一方。
(3)病理特点:组织学上表现多为NSIP、DIP、特发性肺纤维化、PAP以及CPI。在成人多诊断为特发性肺纤维化。与SP-B基因突变相比,这些病理表现并非SP-C基因突变特异的类型。肺泡Ⅱ型上皮细胞的超微结构的检查偶尔会发现排列紊乱的板层小体和聚集的电子致密核心的小囊泡一起出现。这些聚集包含免疫反应的SP-C前体,也代表了错误折叠和误转的聚集体。
(4)临床表现:表面活性蛋白C基因突变是引起婴儿、儿童甚至到成年急、慢性肺部疾病的少见原因。散发的SP-C基因的突变通常在患有严重特发性间质性肺炎的儿童中发现。临床表现多样,可表现为与SP-B缺乏症一样的新生儿期的RDS。也可为小婴儿、儿童或直到成年起病的渐进性的呼吸功能不全、低氧血症和生长困难,可有咳嗽、气短、肺部爆裂音,杵状指(趾)。肺部高分辨CT可见磨玻璃影和肺外周的囊泡影。临床症状轻重不一,疾病的严重性和病程与基因突变的特异性无关。即使同一家族同一突变,其疾病的严重性和起病年龄也可能不同。
(5)诊断:明确诊断要靠DNA测序来确定SFT-PC基因的突变。鉴别诊断在新生儿期需与RDS鉴别。起病较晚的婴儿和儿童,还需要与病毒或非细菌性肺炎鉴别,还需要与化学、吸入肺炎、免疫介导的肺疾病等鉴别。
(6)治疗:一些病例可自行改善,一些病例用激素治疗后改善,另一些需要肺移植。
(7)预后:难以预测,因为疾病的严重性、病程与基因突变的类型无关。
3.ABCA3缺乏症
(1)基因学:ATP结合盒转运子A3(ATP bindingcassette transporter A3,ABCA3)的基因突变为常染色体隐性遗传。ABCA3是一选择性表达的1704个氨基酸蛋白,它在板层小体的膜上发现。最初报道ABCA3基因突变是足月新生儿致命性肺疾病的一个原因,其临床表现类似于SP-B缺乏症。Bullard等取得195个病因学不明的患有慢性肺疾病的儿童DNA样本,结果发现4名脱屑性间质性肺炎患儿中的3名(分别为16岁、23岁、11岁)有ABCA3两个等位基因的突变,都有相同的错义突变(E292V)。
(2)发病机制:ABCA3位于板层小体内,具有运输表面活性物质的磷脂的作用,其功能缺失可干扰板层小体的生物合成而引起间质性肺疾病。内质网局部ABCA3突变蛋白的部分或完全的表达可导致受影响细胞的死亡。
(3)病理特点:随着年龄的不同,组织病理学特征可有PAP、DIP和NSIP。在所有ABCA3突变的肺活检样本中,电子显微镜可看到板层状小体缺乏或异常即反常位置的电子密度包涵体的板层小体异常如“煎蛋样”的特征。
(4)临床表现:多种多样,起病的年龄从出生到四岁之间。有的与SP-B缺乏的婴儿相似,在婴儿早期就会出现严重的不可逆转的呼吸衰竭。有的处于慢性稳定状态或者进展为间质性肺疾病,常见的表现为咳嗽、肺内湿啰音、生长发育迟缓和杵状指(趾)。肺CT可发现磨玻璃样改变、囊泡影。
(5)诊断:临床怀疑是诊断的关键。应该尽早做开胸肺活检和基因检测。开胸肺活检所检测到的肺部疾病的严重性程度随着年龄的不同有所差异。因为ABCA3基因有30个外显子,等位基因的变异性的程度限制了分子生物学的诊断。电镜下致密的板层状小体可协助诊断。
(6)治疗:体外实验应用糖皮质激素可增加ABCA3的表达,但临床有待进一步证实。
(7)预后:许多没有进行肺移植患儿也可以存活到生命的第二个十年。有些患儿的病情比较轻,但这种突变可能会导致严重的呼吸功能不全而死亡。
