病理生理和发病机制
(一)甲状腺的胚胎发育
在妊娠第3周,胎儿甲状腺起始于前肠上皮细胞突起的甲状腺原始组织,妊娠第5周甲状舌导管萎缩,甲状腺从咽部向下移行,第7周甲状腺移至颈前正常位置。妊娠第10周起,胎儿脑垂体可测出TSH,妊娠18~20周脐血中可测到TSH。
胎儿甲状腺能摄取碘及碘化酪氨酸,耦联成三碘甲腺原氨酸(T3)、甲状腺素(T4),并释放甲状腺激素至血循环。妊娠8~10周,甲状腺滤泡内出现胶状物,开始合成T4。妊娠20周时T4水平升高,但在20周前胎儿血清中TSH、T3、T4、游离T3(FT3)、游离T4(FT4)水平均十分低,甚至测不出。胎盘不能通过TSH,很少通过甲状腺激素,说明胎儿的垂体-甲状腺轴与母体是彼此独立的。至妊娠中期,胎儿下丘脑-垂体-甲状腺轴开始发挥作用,TSH分泌水平渐增高,一直持续至分娩。TSH在母亲整个孕期均无明显变化,羊水中TSH在正常情况下测不出。由于胎儿血T4在TSH影响下渐渐升高,甲状腺素结合球蛋白(TBG)的浓度也同时升高。抗甲状腺药,包括放射性碘,可自由通过胎盘,所以患甲亢的母亲妊娠期接受抗甲状腺药物治疗后娩出的新生儿,可患甲状腺功能减低症合并甲状腺肿。
新生儿TSH正常值逐日变化,生后不久,为30~90分钟,由于冷环境刺激,血中的TSH突然升高,于3~4天后降至正常,在TSH影响下,T3与T4在生后24~48小时内亦升高。了解以上这些激素浓度的生理性变化,才能正确地估价新生儿期的甲状腺功能。
(二)甲状腺激素的合成和分泌(图6-1)
甲状腺激素的合成分以下几个步骤。
1.碘在甲状腺的浓集 食物中的碘经肠道吸收后以无机碘化物形式进入血液,通过甲状腺上皮细胞膜上碘泵浓集,进入细胞内。此时的碘化物是无机碘。
2.碘化物的氧化及酪氨酸的碘化 在过氧化酶的作用下,碘化物氧化成活性碘,并与酪氨酸结合成单碘酪氨酸(MIT)及二碘酪氨酸(DIT)。
3.碘酪氨酸的偶联 两分子DIT缩合成一分子T4,MIT、DIT各一分子缩合成一分子T3。T4与T3均是甲状腺激素。
4.甲状腺激素的分泌 酪氨酸的碘化及T3、T4的合成,均是在球蛋白分子上进行的,此种球蛋白称为甲状腺球蛋白(TG),经溶酶体的蛋白水解酶作用,释放出T3、T4和TG,透过滤泡细胞膜和血管壁进入血液,发挥生理效应。

图6-1 甲状腺激素的合成和分泌
甲状腺激素分泌入血后,绝大部分和血浆蛋白质结合,约75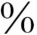 的T4和TBG结合,约15
的T4和TBG结合,约15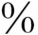 和甲状腺素结合前白蛋白(TBPA)结合,约10
和甲状腺素结合前白蛋白(TBPA)结合,约10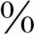 和白蛋白结合。T365
和白蛋白结合。T365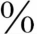 ~70
~70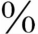 与TBG结合,约8
与TBG结合,约8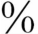 与TBPA结合,其余与白蛋白结合。仅0.03
与TBPA结合,其余与白蛋白结合。仅0.03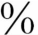 T4和0.3
T4和0.3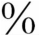 T3呈游离状态。T3的活性比T4强3~4倍,机体所需的T3约80
T3呈游离状态。T3的活性比T4强3~4倍,机体所需的T3约80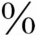 是T4经周围组织5-脱碘酶的作用转化而来。
是T4经周围组织5-脱碘酶的作用转化而来。
(三)甲状腺激素的分泌调节(图6-2)
甲状腺的功能受下丘脑、腺垂体和血中T3、T4浓度的调节,三者组成一个反馈系统。下丘脑的神经分泌细胞产生促甲状腺激素释放激素(TRH),释放到垂体门脉系中,兴奋腺垂体产生TSH,TSH再兴奋甲状腺分泌T3、T4。血中游离T3、T4过高时,抑制TSH的分泌,过低时TSH分泌增多,从而兴奋甲状腺的分泌。上述反馈系统使血中T4、T3保持动态平衡,以保证机体的正常物质代谢和生理活动。
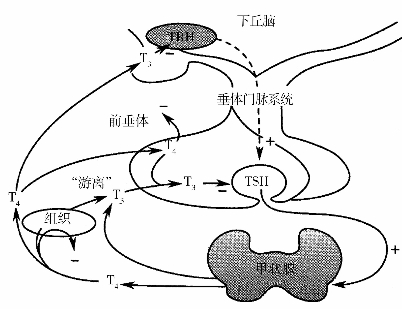
图6-2 甲状腺激素的分泌调节
(四)甲状腺激素的生理作用
1.产热作用 甲状腺激素能刺激物质氧化、使氧化磷酸化作用加强,促进新陈代谢。
2.蛋白质代谢 生理剂量的甲状腺激素使蛋白质和核酸合成增加,氮的排泄减少,若给大剂量甲状腺激素则抑制蛋白质的合成,血浆、肝、肌肉中游离的氨基酸浓度增高。
3.糖代谢 甲状腺激素能促进小肠吸收葡萄糖和半乳糖,并使脂肪组织和肌肉组织摄取葡萄糖的速度增加,还可加强儿茶酚胺和胰岛素对糖代谢的作用,使细胞儿茶酚胺受体对肾上腺素的敏感性增强。(https://www.daowen.com)
4.脂肪代谢 甲状腺激素可以增强脂肪组织对儿茶酚胺、胰高糖素的敏感性,这些激素的作用都是通过腺苷酸环化酶系统,活化细胞内的脂肪酶,促使脂肪水解。
5.水盐代谢 甲状腺激素具有利尿作用,甲低时细胞间液增多,并聚积大量清蛋白与黏蛋白,称为黏液性水肿。
6.对生长发育 甲状腺激素通过对蛋白质的合成作用能促进生长,与生长激素一起在促进生长方面具有协同作用。甲低患者生长缓慢,骨龄发育落后。
7.促进大脑发育 胎儿脑细胞数目在妊娠末3月增长最快,出生后第一年仍快速增长。在脑细胞增殖、分化期,甲状腺激素必不可少,尤其是妊娠后半期与生后第一年期间更为重要。甲低发生越早,脑损害越重,且常不可逆。
(五)根据发病机制分类
散发性先天性格甲低和地方性先天性甲低。
1.散发性先天性甲低 病因及发病率见表6-2,多见于甲状腺发育不全或者异位。
甲状腺发育不良包括甲状腺缺如、发育不良、异位等,其中约1/3病例甲状腺可完全缺如。甲状腺异位为甲状腺在下移过程中停留在异常部位(如舌下至正常甲状腺部位),形成部分或完全丧失功能的异位甲状腺。目前尚未明确阐明先天性原发性甲低的分子病因学,但一些研究已表明,其发病可能与某些在甲状腺胚胎发育和分化中发挥作用的基因变化有关,例如调控甲状腺胚胎发育的甲状腺转录因子Ⅰ(thyroid transcription factor-Ⅰ,TTF-Ⅰ)、甲状腺转录因子Ⅱ(thyroid transcription factor-Ⅱ,TTF-Ⅱ)、Pax8基因及促甲状腺激素受体基因(TSH-R)等,甲状腺特异转录因子的靶基因NIS、TG、TPO等,这些基因的改变也可导致甲状腺发育不良。
表6-2 散发性先天性甲低的病因及发病率

甲状腺激素合成途径障碍多为常染色体隐性遗传病。甲状腺激素的合成需各种酶参与(钠碘转运体、过氧化物酶、耦联酶、脱碘酶及甲状腺球蛋白合成酶),任何因素引起酶的先天缺陷都可导致甲状腺激素水平低下。
2.地方性先天性甲低 主要发生在缺碘地区,多见孕妇饮食缺碘,致使胎儿在胚胎期即因碘缺乏而导致先天性甲低。随着我国广泛使用碘化食盐作为预防措施,其发病率已明显下降,碘缺乏在我国已经基本控制,但在个别地区还可见到。
(六)根据血清TSH浓度分类
1.TSH浓度增高
(1)原发性甲低:包括甲状腺缺如、甲状腺发育不良、甲状腺异位、甲状腺激素合成障碍、碘缺乏等。
(2)暂时性甲低:包括孕母在服用抗甲状腺药、未成熟儿等。
2.TSH浓度正常或降低
(1)下丘脑,垂体性甲低。
(2)低甲状腺结合球蛋白。
(3)暂时性甲低,可见于未成熟儿、非甲状腺疾病等情况。
