10.2.5 实际气体的状态方程
2026年01月14日
10.2.5 实际气体的状态方程
理想气体状态方程是在温度不太低、压强不太大的情况下对实际气体状态理想化、抽象化的结果。实验事实证明,在几十个大气压的压强范围内,许多气体的行为都近似地符合理想气体状态方程,但当压强很高时,这个方程与气体实际行为之间的偏差很大。表10.1中列出了1 mol氦气在0℃时不同压强下的实验数据。
表10.1 1 mol氦气在0℃时不同压强下的体积
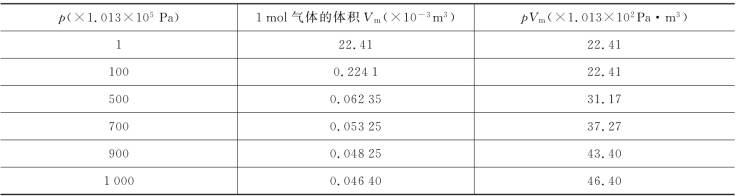
由表10.1可以看出,在0℃时,高压下的p V m值并不为恒值。因此,人们对实际气体也进行了许多理论和实验的研究工作,导出了若干个接近于实际气体的状态方程。其中最简单、最有代表性的是范德瓦耳斯方程。
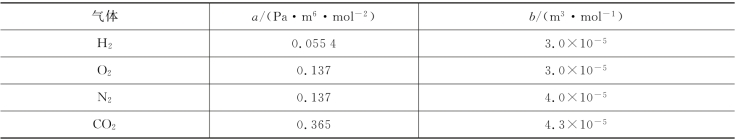
采用理想气体的微观模型时,人们假设理想气体分子都是质点,除碰撞的瞬间外分子之间无相互作用。而实际气体不同于理想气体的是:气体分子具有体积,气体分子之间有相互作用,这种相互作用在分子相距较近时为排斥力,而分子相距较远时为吸引力。范德瓦耳斯正是考虑了理想气体模型的这两点缺陷,对理想气体状态方程进行了修正。对于温度为T、压强为p、体积为V的1 mol气体,范德瓦耳斯方程为
 (https://www.daowen.com)
(https://www.daowen.com)
表10.2 一些气体的范德瓦耳斯修正量的实验值
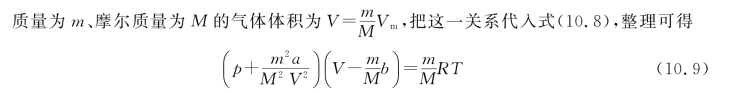
这就是适用于任意质量气体的范德瓦耳斯方程。
由于范德瓦耳斯对物理学的突出贡献,他荣获了1910年的诺贝尔物理学奖。
