10.4.3 理想气体的内能
从微观观点来看,系统的内能是系统中所有分子的能量的总和,它包括系统内所有分子的热运动的动能、分子内原子的振动动能、分子间的相互作用势能以及原子内电子的能量和核内能量。在通常温度下,原子内部的能量是不变的,故在计算内能的改变时可不用考虑。对于理想气体,忽略了分子间的相互作用,所以只需计算分子本身各种运动(平动、转动和振动)的能量。设一定理想气体的分子总数是N,根据能量均分定理,由式(10.21)可求出ν摩尔理想气体的内能为

理论分析说明,对于结构简单的分子,如单原子、双原子分子,在室温下常可忽略其振动,只计其平动和转动。
由以上可知,一定量的某种理想气体的内能完全决定于气体的热力学温度。应该指出,这一结论与“不计气体分子之间的相互作用力”的假设是一致的,所以有时也把“理想气体的内能只是温度的单值函数”这一性质作为理想气体的另一定义。一定质量的理想气体在不同的状态变化过程中,只要温度变化相等,它的内能的变化量也相同,而与过程无关。以后,我们在热力学中,将应用此结果计算理想气体的热容的量值。
![]()
1.热力学系统的微观量和宏观量平衡态
热力学系统由大量无规运动的粒子组成,简称系统。微观量是描述系统中单个粒子运动状态的物理量。宏观量是描述系统整体特性的物理量。
一个与外界没有联系的孤立系统,不管它开始时处于何种状态,经过一段时间以后,都会达到一个宏观性质不随时间变化的状态,这样的状态称为平衡态。平衡态的气体常用宏观量压强p、体积V和温度T等状态参量描述。
2.理想气体的状态方程
3.理想气体的压强公式
4.理想气体的能量
分子平均平动动能为
每个分子的平均总能量为
ν摩尔理想气体的内能为
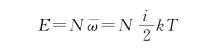
式中,i=t+r为分子自由度,t=3为平动自由度,r为转动自由度。单原子分子r=0,i=3;双原子分子r=2,i=5;多原子分子r=3,i=6。
