不同类型高血压危象的发病机制及相应的治疗选择
传统处理高血压危象的策略主要集中在快速地降低血压。这种策略忽略了不同类型高血压危象发病机制的不同,因而有效性较低,甚至有害。下面重点讨论不同类型高血压危象的发病机制及相应的治疗选择。
1.卒中
80%以上急性缺血性卒中患者均有血压升高,经常发生在既往有高血压病史者,甚至药物控制的患者中。这种情况下,血压的控制目前存在争议。主要原因在于即使不用额外的降压药物,血压一般在发病4d内逐渐降至发病前水平。
脑血流量(cerebral blood flow,CBF)的自身调节取决于脑灌注压(cerebral perfusion pressure,CPP)和脑血管阻力(cerebrovascular resistance,CVR)之间的相互作用,即:CBF=CPP/CVR=(平均动脉压-静脉压)/CVR。正常情况下,静脉压可以忽略不计,因此CPP就等于动脉压。当系统动脉压降低或局部静脉压增高引起颅内压(intracranial pressure,ICP)升高时,CPP明显降低。ICP增加可见于动脉或静脉阻塞性疾病,或颅内出血。从上面的方程中可以看出当静脉压异常升高,同时MAP降低时,可以导致CPP明显降低,进而出现CBF降低。
血压正常的成人中,CPP在60~150mmHg范围内波动时,对CBF影响较小(图1-1)。CPP增加相应地导致血管阻力增加,因此CBF基本不变;同样,CPP降低会引起血管扩张导致血管阻力降低,同样CBF基本不变。当CPP超出150mmHg界限时,会引起CBF增加导致脑水肿的发生,这一现象称为“突破点”脑灌注,认为是高血压脑病的发病机制。相反,当CPP低于60mmHg时,CBF明显降低,导致脑组织供血、供氧不足引起缺血性脑病。
慢性高血压患者,CPP与CBF间的关系发生了变化,CPP的低限高于血压正常者(图1-1)。
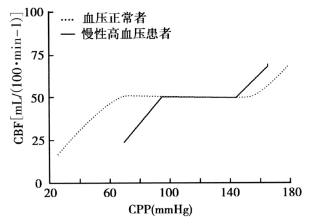
图1-1 脑血流量自身调节示意图
国外有学者报告未控制的高血压患者可自身调节的CPP低限由73mmHg(正常血压者)增至113mmHg。无论高血压患者或血压正常者,CPP自身调节的低限一般为静息状态MAP的75%,因此既往经验认为急性卒中患者使用降压药物将MAP降低25%是安全的。然而许多随机、对照临床试验得出的结论恰恰相反。一项大规模(n=624)比较降压治疗(如拉贝洛尔、硝普钠)联合组织纤维蛋白溶酶原激活剂重组体(rt-PA)在缺血性卒中患者中效果的临床对照研究表明,接受rt-PA和降压治疗组的死亡率和慢性神经系统损害率是只接受rt-PA而未接受降压治疗组的4倍,同时接受rt-PA和降压治疗组患者血压下降更明显,两组患者的基本情况(年龄、卒中程度、高血压程度等)相似;进一步研究发现,没有接受rt-PA治疗患者中,神经系统恢复与死亡率并未从降压治疗中获益。上述研究表明,缺血性卒中患者并不能从降压治疗中获益;同时使用rt-PA和降压治疗对临床结果(神经系统恢复与存活率)有害。其他安慰剂对照临床试验支持上述抗高血压治疗对缺血性卒中患者无益的观点。国外学者将缺血性卒中患者随机分入安慰剂组与尼莫地平组,1个月和3个月随访中发现尼莫地平组死亡率更高;尽管尼莫地平组第1周血压明显下降,并没有发现血压水平与死亡率相关。一项小规模(n=16)临床对照试验将患者随机分入安慰剂组与尼卡地平组,发现尼卡地平对梗死区域CBF无影响;相反,使用ACE抑制剂(卡托普利)或中枢性α2受体激动剂(可乐定)治疗患者,梗死区域CBF明显增加。上述研究表明,钙拮抗剂对CBF自身调节无影响甚至有害,而ACE抑制剂或中枢性α2受体激动剂对缺血性卒中有益。
2.蛛网膜下腔和颅内出血
颅内出血早期经常伴有高血压,血压升高程度一般比缺血性卒中更严重,而且最初几天很少能自发降低。严重高血压是蛛网膜下腔出血的常见特征。尼莫地平可以明显改善蛛网膜下腔出血患者的预后,但一过性低血压是其常见副作用,特别是静脉使用时;大约30%患者需要使用血管收缩药物(如多巴胺、肾上腺素、去甲肾上腺素)来逆转其血管扩张作用。这种相互抵消的治疗策略使得临床预后具有不稳定性和不可预测性。颅内出血或蛛网膜下腔出血早期使用二氢吡啶类钙拮抗剂,对CBF有害。短效硝苯地平使用30分钟内,MAP下降20%,平均颅内压增加40%,因此CPP降低40%,这表明硝苯地平可以引起脑水肿,降低CPP,因此损害CBF自身调节。一些临床试验得出结论,二氢吡啶类钙拮抗剂有限的治疗作用可由其对血流动力学的不利影响抵消。举例说明,一项大规模(n=906)随机临床对照试验在动脉瘤破裂所致蛛网膜下腔出血患者中,比较大剂量静脉尼卡地平与对照组扩容治疗,结果发现低血压发生率在尼卡地平组是对照组的2倍,3个月随访时两组的神经系统恢复情况和存活率相似。
以上研究表明,降压治疗对急性卒中患者疗效有限,缺血性卒中患者血压可在数天内逐渐恢复至卒中前水平。临床与实验室研究均表明降压治疗对脑循环自身调节有害,特别是二氢吡啶类钙拮抗剂。尽管尼莫地平对于急性蛛网膜下腔出血患者有效,但是治疗诱发的低血压可限制其有效性。
3.高血压脑病
高血压脑病临床特点包括头痛、昏睡、癫痫发作以及视神经盘水肿。发病机制主要是血压的快速升高引起脑灌注压明显升高超过自身调节上限,导致脑水肿和CBF降低。最近国外有学者使用磁共振(MRI)研究高血压脑病患者神经系统改变时发现,缺血部位主要在大脑后循环,当血压控制后缺血改变均可恢复,该研究表明大脑循环调控异常参与病理生理过程。局部神经系统查体一般无特殊发现。血压快速升高最常见原因为肾脏缺血引起肾素和血管紧张素Ⅱ分泌增多所致。这会增强压力-利钠作用,进一步刺激肾素-血管紧张素-醛固酮释放,因此加重肾素相关的代谢异常(包括低钾血症和代谢性碱中毒),同时增强血管紧张素Ⅱ诱发的脑、心和肾血管毒性作用。治疗前高血清PRA水平,抗肾素治疗后临床预后改善、血清PRA水平下降支持高肾素活性在发病中的关键作用。基于以上研究,高血压脑病治疗中主要针对肾素-血管紧张素系统。如卡托普利(口服ACE抑制剂)在高血压脑病急性期以及后续治疗中是安全、有效的。静脉使用依那普利在高血压脑病急性期可快速起效。因此,在不同水平阻断肾素-血管紧张素系统的ACE抑制剂和β受体阻滞剂可以改善脑循环自身调节,提高CBF。相反,经验性使用利尿剂或直接血管扩张剂(如肼屈嗪、硝普钠)可以刺激肾素系统的分泌,对高血压脑病患者无效,甚至有害。
4.主动脉夹层
主动脉夹层依据对治疗的反应不同分为A、B两型,累及升主动脉称为A型,否则称为B型。一般而言,A型主动脉夹层手术治疗后死亡率较低;而B型主动脉夹层对药物治疗反应好。尽管有区别,最初的药物治疗是相似的,主要针对夹层的进展、出血和破裂。主动脉夹层及其并发症的主要决定因素为主动脉波增加的速度,即dP/dt。影响dP/dt的因素包括心肌收缩力、血压和心率。因此针对降低dP/dt的治疗可以减轻主动脉夹层及其并发症的危害,因此β受体阻滞剂和神经节阻断剂为主动脉夹层的一线治疗。几乎所有主动脉夹层患者均存在高血压,降压目标为能耐受的最低血压水平。大多数患者单独使用β受体阻滞剂并不能满意控制血压,一般需要联合其他抗高血压药物。(https://www.daowen.com)
硝普钠由于起效快、作用时间短,以及容易滴定等优点,临床上广泛用于主动脉夹层的治疗。但是,没有同时使用β受体阻滞剂时,小剂量的硝普钠可引起压力反射刺激和相关肾素-血管紧张素-醛固酮系统的激活,进而导致dP/dt明显增加;同时外周血管阻力增加以及肾脏钠重吸收增加,因此硝普钠降压作用被抵消,这种现象称为硝普钠抵抗。二氢吡啶类钙拮抗剂增加心率、心肌收缩力和血浆儿茶酚胺水平,没有使用β受体阻滞剂前应慎用。
5.急性肺水肿和心力衰竭
心力衰竭是指心脏泵血功能不能满足机体代谢需要的病理生理状态,临床特点包括血管内和间质内容量负荷过多,或组织灌注不足表现(如乏力、运动耐力下降等)。90%以上心力衰竭患者有高血压史,高血压与急性肺水肿互为因果关系,反映了在肾素-血管紧张素-醛固酮轴,以及其他神经激素系统过度激活后左心室收缩和舒张功能障碍。
心肌梗死后肾素系统在左心室扩大和功能障碍进展中起重要作用。卡托普利(ACE抑制剂)可以改善心脏顺应性,降低20%总死亡率。失代偿性心衰治疗中,血管紧张素Ⅱ1型受体阻断剂与ACE抑制剂同样有效。醛固酮在心力衰竭病理生理中的作用已阐明,醛固酮拮抗剂可以明显改善存活率。ACE抑制剂在心力衰竭治疗中的益处不仅局限在血清肾素水平非常高者。国外研究表明大约50%中-低肾素水平[PRA<2ng/(mL·h)]患者可从卡托普利治疗中获得持续性左心室功能和临床症状的改善,这些治疗益处通常伴随血清平均PRA水平15倍增加,表明肾素对血管紧张素Ⅱ生成阻断后的反应性升高。相反,卡托普利治疗后血清肾素水平没有增加者,并不能从ACE抑制剂中获益。因此,血清肾素水平对ACE抑制剂的反应可预测心力衰竭患者能否从ACE抑制剂治疗中获益。
总之,失代偿性心力衰竭与高血压危象互为因果,反映了体内钠含量增加后肾素-血管紧张素-醛固酮系统的过度激活。治疗策略包括利尿(优先选用螺内酯)、最好联合降低或阻断肾素-血管紧张素Ⅱ形成与释放,或直接作用于血管紧张素Ⅱ1型受体的R类药物(如β受体阻滞剂、ACE抑制剂或血管紧张素Ⅱ1型受体阻断剂)。
6.急性心肌梗死(acute myocardial infarction,AMI)
像心力衰竭一样,高血压危象时可发生AMI,初期通常与肾素系统的过度激活有关。关于AMI研究强调神经内分泌激活(如肾素系统激活)在其病理生理过程中的重要性,并将神经内分泌系统的激活作为临床预后(包括心功能分级、室壁瘤形成、心室顺应性以及存活率)的一项预测因子。关于AMI使用R药物的数十万例患者的临床试验表明ACE抑制剂和β受体阻滞剂可明显改善存活率,已经成为AMI的标准治疗。相反,也有临床证据表明AMI患者使用血管扩张剂(如硝普钠、短效二氢吡啶类钙拮抗剂)有害。有研究表明硝普钠有冠脉窃血作用,可使心肌缺血区域的冠脉血供更少。AMI或心血管手术后,短效钙拮抗剂与并发症有关,因此高血压危象,特别是合并心血管疾病时禁用短效钙拮抗剂。相反,ACE抑制剂和β受体阻滞剂可改善AMI患者存活率,成为一线治疗。
可卡因中毒可引起难控制的高血压以及冠脉收缩所致心绞痛、心肌梗死和心源性猝死。治疗上,选择性α1肾上腺素受体阻滞剂联合α、β肾上腺素阻断剂(如拉贝洛尔),或非二氢吡啶类钙拮抗剂(如维拉帕米)为有效的方法。相反,没有联合α1肾上腺素受体阻滞剂,单独使用β受体阻滞剂可使病情恶化。
7.先兆子痫/子痫
妊娠特异综合征通常发生在妊娠20周后或滋养层疾病(如葡萄胎等)早期,妊娠期血压升高和蛋白尿为典型特点。妊娠期血压升高是指妊娠前血压正常者,妊娠期收缩压>140mmHg,或舒张压>90mmHg。蛋白尿是指24h尿蛋白≥300mg。先兆子痫病理生理机制尚不清楚,可能与以下因素有关:①对血管紧张素Ⅱ和其他血管收缩因子反应性增加;②血管内皮功能异常导致内皮生成的血管舒张因子产量下降或对其反应性降低。
先兆子痫的临床和实验室特点多种多样,包括头痛、视觉障碍、上腹痛、血肌酐>106.1μmol/L、血小板计数<100×109/L,以及同时发生的微血管病性溶血性贫血和乳酸脱氢酶升高与肝脏转氨酶升高。子痫是指先兆子痫患者在既往无癫痫发作史情况下,有癫痫发作。先兆子痫的临床与实验室表现是可逆的,在分娩后逐渐消退。
一旦发现先兆子痫或严重妊娠期高血压需要尽快住院治疗。先兆子痫严重性分级见表1-2。妊娠期23~32周患者可通过限制活动,使病情稳定或缓解。轻度先兆子痫患者一般不建议使用静脉硫酸镁,但妊娠相关高血压或严重先兆子痫患者静脉使用硫酸镁可减少子痫的发作。舒张压超过105mmHg或从正常水平快速升至100mmHg以上时,应该使用降压药物治疗。考虑到对胎儿的影响,降压药物选择受到限制,ACE抑制剂和血管紧张素Ⅱ受体拮抗剂增加胎儿和新生儿的致残率和死亡率,禁止使用。治疗上可选用药物有以下几种:①α甲基多巴,对胎儿影响较小,为主要治疗选择;②肼屈嗪,可静脉注射或肌内注射,起效迅速,常见副作用包括反射性心动过缓、低血压和水钠潴留;③拉贝洛尔,同样有效,可静脉使用,但哮喘和失代偿心力衰竭患者禁用。硝普钠和短效钙拮抗剂应慎用。
表1-2 先兆子痫严重性分级表
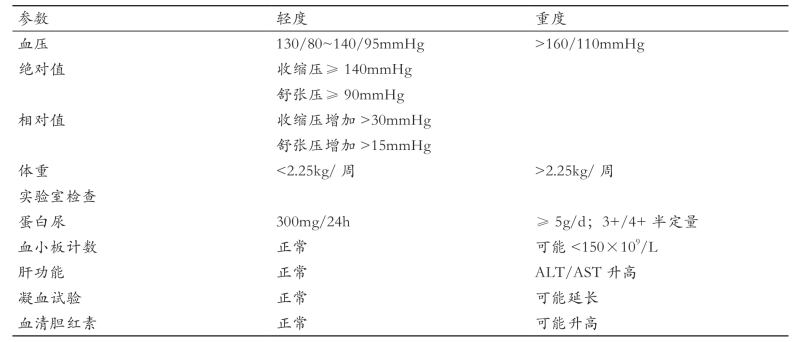
备注:ALT—谷丙转氨酶;AST—谷草转氨酶。
