4.2.3 药品说明书要求
1)药品说明书的修改要求
(1)主动修改
药品生产企业应当主动跟踪药品上市后的安全性、有效性情况,需要对药品说明书进行修改的,应当及时提出申请。
(2)责令修改
根据药品不良反应监测、药品再评价结果等信息,国家药品监督管理局也可以要求药品生产企业修改药品说明书。
(3)修改通知
药品说明书获准修改后,药品生产企业应当将修改的内容立即通知相关药品经营企业、使用单位及其他部门,并按要求及时使用修改后的说明书和标签。
(4)承担责任
药品生产企业未根据药品上市后的安全性、有效性情况及时修改说明书或者未将药品不良反应在说明书中充分说明的,由此引起的不良后果由该生产企业承担。
课堂讨论
参照处方药说明书规范细则和非处方药说明书规范细则,同学们认真对比自己课前准备好的化学药品处方药和非处方药的说明书,总结它们格式和所列项目的区别。
2)药品说明书的格式和书写要求
2006年5月10日,原国家食品药品监督管理局以国食药监注〔2006〕1202号文下发了《关于印发化学药品和生物制品说明书规范细则的通知》,对化学药品和生物制品说明书各项内容书写要求作了明确的规定。2000年6月22日,原国家食品药品监督管理局以国食药监注〔2006〕1283号文下发了《关于印发中药、天然药物处方药说明书格式内容书写要求及撰写指导原则的通知》,对中药、天然药物处方药说明书各项内容书写要求做了明确规定。下面以化学药品和生物制品说明书为例予以介绍。
(1)化学药品和治疗用生物制品处方药说明书格式(图4.1)
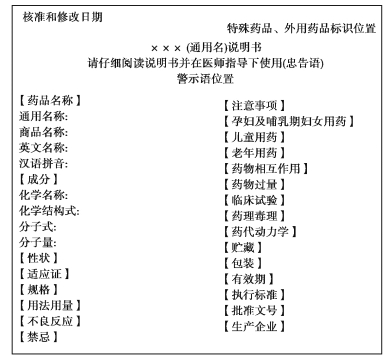
图4.1 化学药品和生物制品处方药说明书格式
(2)化学药品和治疗用生物制品处方药说明书的书写要求
【核准和修改日期】核准日期为国家药品监督管理部门批准该药品注册的时间(2006年6月1日起)。2006年6月1日前批准注册的药品,核准日期为按照《关于实施〈药品说明书和标签管理规定〉有关事宜的公告》提出补充申请后,药品监督管理部门予以备案的日期。修改日期为此后历次修改的时间。核准和修改日期应当印制在说明书首页左上角。修改日期位于核准日期下方,按时间顺序逐行书写。
【特殊药品、外用药品标识】麻醉药品、精神药品、医疗用毒性药品、放射性药品和外用药品等专用标识在说明书首页右上方标注。
【说明书标题】“×××说明书”中的“×××”是指该药品的通用名称。“请仔细阅读说明书并在医师指导下使用”,该忠告语必须以加粗字体印制在说明书标题下方。
【警示语】指对药品严重不良反应及其潜在的安全性问题的警告,还可以包括药品禁忌、注意事项及剂量过量等需提示用药人群特别注意的事项。有该方面内容的,应当在说明书标题下以醒目的黑体字注明。无该方面内容的,不列该项。
【药品名称】按下列顺序列出:
通用名称:《中国药典》收载的品种,其通用名称应当与《中国药典》一致;《中国药典》未收载的品种,其名称应当符合国家药品监督管理局公布的药品通用名称命名原则。
商品名称:必须符合国家药品监督管理局公布的药品商品名称命名原则。未批准使用商品名称的药品不列该项。
英文名称:无英文名称的药品不列该项。
汉语拼音:××。
【成分】
①列出活性成分的化学名称、化学结构式、分子式、分子量。
②复方制剂可不列出①的内容,可表达为“本品为复方制剂,其组分为:××”。组分按一个制剂单位(如每片、粒、支、瓶等)分别列出所含的全部活性成分及其量。
③多组分或者化学结构尚不明确的列出主要成分名称,简述活性成分来源。
④处方中含有可能引起严重不良反应的辅料的,该项下应当列出该辅料名称。
⑤注射剂应当列出全部辅料名称。
【性状】包括药品的外观、臭、味、溶解度以及物理常数等。
【适应证】应当根据该药品的用途,采用准确的表述方式,明确用于预防、治疗、诊断、缓解或者辅助治疗某种疾病(状态)或者症状。
【规格】指每支、每片或其他每一单位制剂中含有主药(或效价)的重量或含量或装量。(https://www.daowen.com)
生物制品应标明每支(瓶)有效成分的效价(或含量及效价)及装量(或冻干制剂的复溶后体积),表示方法一般按照《中国药典》要求规范书写,有两种以上规格的应当分别列出。
【用法用量】包括用法和用量两部分。需按疗程用药或者规定用药期限的,必须注明疗程、期限。应当详细列出该药品的用药方法,准确列出用药的剂量、计量方法、用药次数以及疗程期限,并应当特别注意与规格的关系。用法上有特殊要求的,应当按实际情况详细说明。
【不良反应】应当实事求是地详细列出该药品不良反应,并按不良反应的严重程度、发生的频率或症状的系统性列出。
【禁忌】应当列出禁止应用该药品的人群或者疾病情况。
【注意事项】
①注意事项列出使用时必须注意的问题:
a.需要慎用的情况(如肝、肾功能的问题);
b.影响药物疗效的因素(如食物、烟、酒);
c.用药过程中需观察的情况(如过敏反应,定期检查血象、肝功、肾功);
d.用药对于临床检验的影响等。
②滥用或者药物依赖性内容可以在该项目下列出。
【孕妇及哺乳期妇女用药】(仅处方药有此项)着重说明该药品对妊娠、分娩及哺乳期母婴的影响,并写明可否应用本品及用药注意事项。未进行该项实验且无可靠参考文献的,应当在该项下予以说明。
【儿童用药】(仅处方药有此项)主要包括儿童由于生长发育的关系而对于该药品在药理、毒理或药代动力学方面与成人的差异,并写明可否应用本品及用药注意事项。未进行该项实验且无可靠参考文献的,应当在该项下予以说明。
【老年用药】(仅处方药有此项)主要包括老年人由于机体各种功能衰退的关系而对于该药品在药理、毒理或药代动力学方面与成人的差异,并写明可否应用本品及用药注意事项。未进行该项实验且无可靠参考文献的,应当在该项下予以说明。
【药物相互作用】列出与该药产生相互作用的药品或者药品类别,并说明相互作用的结果及合并用药的注意事项。未进行该项实验且无可靠参考文献的,应当在该项下予以说明。
【药物过量】(仅化学药品和治疗用生物制品处方药有此项)详细列出过量应用该药品可能发生的毒性反应、剂量及处理方法。未进行该项实验且无可靠参考文献的,应当在该项下予以说明。
【临床试验】(仅处方药有此项)为本品临床试验概述,应当准确、客观地进行描述。包括临床试验的给药方法、研究对象、主要观察指标、临床试验的结果(包括不良反应)等。没有进行临床试验的可不列此项。
【药理毒理】(仅处方药有此项)包括药理作用和毒理研究两部分内容:
药理作用为临床药理中药物对人体作用的有关信息。也可列出与临床适应证有关或有助于阐述临床药理作用的体外试验和(或)动物实验的结果。复方制剂的药理作用可以为每一组成分的药理作用。
毒理研究所涉及的内容是指与临床应用相关,有助于判断药物临床安全性的非临床毒理研究结果。应当描述动物种属类型、给药方法(剂量、给药周期、给药途径)和主要毒性表现等重要信息。复方制剂的毒理研究内容应当尽量包括复方给药的毒理研究结果,若无该信息,应当写入单药的相关毒理内容。
未进行该项实验且无可靠参考文献的,应当在该项下予以说明。
【药代动力学】(仅处方药有此项)应当包括药物在体内吸收、分布、代谢和排泄的全过程及其主要的药代动力学参数,以及特殊人群的药代动力学参数或特征。说明药物是否通过乳汁分泌、是否通过胎盘屏障及血脑屏障等。应以人体临床试验结果为主,如缺乏人体临床试验结果,可列出非临床试验的结果,并加以说明。
未进行该项实验且无可靠参考文献的,应当在该项下予以说明。
【贮藏】具体条件的表示方法按《中国药典》要求书写,并注明具体温度,如阴凉处(不超过20℃)保存。有特殊要求的应注明相应温度。生物制品应当同时注明制品保存和运输的环境条件,特别应明确具体温度。
【包装】包括直接接触药品的包装材料和容器及包装规格,并按该顺序表述。包装规格一般是指上市销售的最小包装的规格。
【有效期】有效期应以月为单位描述,可以表述为:××个月(×用阿拉伯数字表示)。
【执行标准】应列出目前执行的国家药品标准的名称、版本及编号,或名称及版本,或名称及编号。如《中国药典》2020年版二部;或者药品标准编号,如WS-10001(HD0001)-2020。
【批准文号】指该药品的药品批准文号,进口药品注册证号或者医药产品注册证号。麻醉药品、精神药品、蛋白同化制剂和肽类激素还需注明药品准许证号。
【生产企业】国产药品该项内容应当与药品生产许可证载明的内容一致,进口药品应当与提供的政府证明文件一致,并按下列方式列出。
企业名称:
生产地址:
邮政编码:
电话和传真号码:须标明区号。
网址:如无网址可不写,此项不保留。
