5.5.4 主动召回与责令召回的相关规定
1)主动召回
药品安全隐患调查与评估药品安全隐患调查的内容应当根据实际情况确定,可以包括:
①已发生药品不良事件的种类、范围及原因。
②药品使用是否符合药品说明书、标签规定的适应证、用法用量的要求。
③药品质量是否符合国家标准,药品生产过程是否符合GMP等规定,药品生产与批准的工艺是否一致。
④药品储存、运输是否符合要求。
⑤药品主要使用人群的构成及比例。
⑥可能存在安全隐患的药品批次、数量及流通区域和范围。
⑦其他可能影响药品安全的因素。
药品安全隐患评价的主要内容包括:
①该药品引发危害的可能性,以及是否已经对人体健康造成了危害。
②对主要使用人群的危害影响。
③对特殊人群,尤其是高危人群的危害影响,如老年、儿童、孕妇、肝肾功能不全者、外科病人等。
④危害的严重与紧急程度。
⑤危害导致的后果。
药品主动召回程序见图5.1。(https://www.daowen.com)
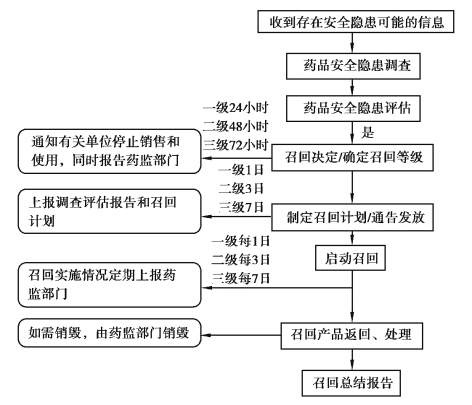
图5.1 药品主动召回程序
拓展知识
SFDA关于美国默克公司召回疫苗情况的通报
国家食品药品监督管理局2007年12月13日接到默沙东(中国)有限公司关于美国默克公司主动召回b型流感嗜血杆菌偶联疫苗(商品名:普泽欣)的情况报告,根据《药品召回管理办法》启动了相应监督工作,密切关注召回工作实施情况。
根据默沙东(中国)有限公司的报告,默克公司在对该疫苗生产工艺的常规测试过程中,发现灭菌工艺存在问题,可能导致若干批次产品存在潜在质量问题,故对这些批次的产品全部召回。默沙东(中国)有限公司及该疫苗进口单位负责对其实施二级召回。尚未收到能确认该批产品存在质量问题直接证据的报告。国家药品不良反应监测中心目前尚未收到涉及该批产品的不良反应病例报告。
国家食品药品监督管理局要求美国默克公司严格按照我国《药品召回管理办法》规定,提交对该疫苗安全隐患的调查评估报告和详细召回计划,切实落实相关规定要求。所有使用单位立即停止使用该批号疫苗,加强对注射后出现不良反应的监测,并协助进口单位做好疫苗收回工作。相关药品经营企业及时传达、反馈召回信息,按照召回计划积极协助控制和收回该批疫苗。(资料来源:国家食品药品监督管理总局官网)
2)责令召回
药品监督管理部门经过调查评估,认为存在安全隐患,药品生产企业应当召回药品而未主动召回的,应当责令药品生产企业召回药品。必要时,药品监督管理部门可以要求药品生产企业、经营企业和使用单位立即停止销售和使用该药品。
药品监督管理部门作出责令召回决定,应当将责令召回通知书送达药品生产企业。药品生产企业在收到责令召回通知书后,应当通知药品经营企业和使用单位,制定、提交召回计划,并组织实施。责令召回程序要求与主动召回程序要求一致。
案例讨论
2010年4月,美国食品药品监督管理局对某公司的非处方药生产基地进行例行检查,发现该生产基地存在制药原材料遭污染、设备不洁等诸多严重缺陷,责令该公司立即召回该基地生产的40多种非处方药,包括儿童用泰诺、儿童用止痛药布洛芬和儿童用抗过敏药物仙特明,共波及至少1500个产品使用地。
讨论:1.该公司召回药品的做法是否恰当?
2.该公司如何保证这些产品的召回?
3.该公司对召回的药品该如何处理?
