Ras癌基因家族与血管新生
Ras癌基因家族是一个在真核生物中高度保守的多基因家族,一般在细胞增殖中起着关键作用。Ras蛋白是一种膜相关的G结合蛋白,分子质量为21ku(P21Ras),含有189个氨基酸残基,参与信号转导,具有鸟嘌呤核苷酸结合活性和内源性GTP酶活性。通常这类蛋白的活性和非活性状态处于动态平衡。处于非活性状态时,P21Ras蛋白结合GDP,在信号转导通路上游另一个蛋白的刺激下,GDP转为GTP,P21Ras构象转为活性形式。已有研究表明,活性P21Ras蛋白通过几种途径调控血管新生。
1.Ras与血管内皮细胞生长因子(Vascular endothelial growth factor,VEGF) VEGF是一种内皮细胞专一性丝裂原和血管新生强烈的刺激因子。在生理或病理状态下血管新生的过程中,VEGF是一个主要调节因子。其主要生物学功能为:①选择性增强血管内皮细胞有丝分裂,刺激内皮细胞增殖并促进血管形成;②升高血管尤其是微小血管的渗透性,使血浆大分子外渗沉积在血管外的基质中,为肿瘤细胞的生长和新生毛细血管网的建立提供营养。目前所知的VEGF家族成员包括:VEGF-A、VEGF-B、VEGF-C、VEGF-D、VEGF-E和胎盘生长因子(PIGF)。
研究中表明Ras突变导致VEGF的表达增强。在一些细胞系的研究表明,激活K-ras或转染H-ras导致VEGF-A升高而非VEGF-B或VEGF-C升高;相反通过破坏基因、反义核苷酸或促进相应核酶的表达抑制突变的K-ras,可以抑制VEGF的表达。
在刺激VEGF表达的因子中,研究最清楚的是缺氧诱导因子(HIF-1),HIF-1是一个异源二聚体,它是由120ku的α亚基和91~94ku的β亚基组成。HIF-1α受缺氧诱导,只有在缺氧状态下,细胞中的HIF-1α才能稳定表达。通常HIF-1α与VHL(Von Hippel Lindau,VHL)肿瘤抑制蛋白结合,并且不断被水解。这是因为在常氧状态下,HIF-1α羟化酶使HIF-1α的ODD(氧依赖降解区)发生羟基化,羟基化作用使与VHL结合,导致蛋白酶降解HIF-1α;但在缺氧条件下羟化酶不能发挥作用,HIF-1α不能被VHL识别,导致其在细胞中堆积并激活转录。现有研究表明,Ras蛋白具有不同的两种信号级联通路Ras>Raf>MEK>ERK1/2和Ras>PI(3)K>PDK>PKB,参与调节VEGF的表达。ERK1/2可以直接磷酸化HIF-1α,导致反式激活和增强VEGF启动子,促进VEGF的表达。另外,Ras也与缺氧诱导的HIF-1α蛋白的稳定性有关。在成纤维细胞中激活Ras,可以检测到HIF-1α稳定性增强,这可能与PI(3)激酶调节的HIF-1α的降解有关。
除了HIF-1α外,Ras蛋白还可以通过影响其他的转录因子调节VEGF启动子的活性。在VEGF mRNA启动子上有一个关键的元件,位于-88/-50,是一个GC富集区,能与SP1、SP3和AP2结合。激活任何一个Ras蛋白,都可以通过SP1/AP2结合位点增强VEGF的启动子。这可能与Ras>Raf>MEK>ERK1/2信号通路有关,ERK1/2磷酸化SP1,增加其与DNA结合的能力。
VEGF的表达除了与转录有关外,还与其mRNA的半衰期有关,细胞质中的一些蛋白与其mRNA的3′UTR,调节其半衰期。一些应激蛋白[如Jun-kinase(JNK)]可以调节这些蛋白。原癌基因Ras可以通过Ras>Rac>MEKK1>JNKK>JNK调节一些激酶。当H-ras激活时,VEGF mRNA的稳定性增加3~5倍,但是否通过上述途径尚无直接研究。
在mRNA翻译的过程中需要eIF-4E(一种翻译起始因子),其作用被一种蛋白4E-BP1(4E-binding protein 1)抑制。磷酸化4E-BP1可增强eIF-4E的功能。在一些细胞研究中表明,VEGF高表达与eIF-4E高表达具有一致性。并且有研究表明两个信号通路PI(3)K>PDK>PKB>FRAP和Raf>MEK>ERK1/2增加4E-BP1的磷酸化,这两个信号通路都受Ras调节。但Ras通过这两个信号通路对VEGF mRNA翻译的影响尚无直接研究报道。
上述研究均为激活后的Ras蛋白刺激VEGF的表达,但还有研究表明,缺氧也可诱导未突变的Ras(wt ras)表达。这引出了两个问题:缺氧诱导Ras表达的机制是什么?另外Ras表达有助于缺氧诱导的VEGF表达吗?
缺氧诱导活性氧离子(ROS)和一氧化氮离子(NOS)合成。这些离子可以促进Ras合成,尤其是NOS。NOS由一氧化氮合酶(iNOS)合成。iNOS也是缺氧时HIF-1的反应基因。这样iNOS可能通过直接激活Ras促进缺氧诱导的VEGF表达,但iNOS也可以通过其cGMP抑制VEGF的合成。另外一个信号通路是通过酪氨酸激酶或者G蛋白信号通路。缺氧激活酪氨酸激酶c-Src,然后磷酸化Shc(c-Src的一个底物),最后激活Ras和ERK1/2。这个信号通路与激活G蛋白相似。
缺氧时诱导wt-ras有助于VEGF合成吗?研究表明Ras通过其信号通路激活转录因子SP1/3,这是VEGF合成必需的;另外抑制Ras能抑制缺氧诱导的VEGF表达。这样,Ras激活可能是VEGF合成必需的(图6-1)。
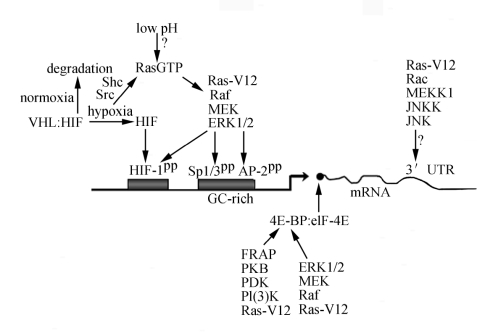
图6-1 Ras调节VEGF合成图
激活Ras通过转录与翻译水平调节VEGFb的表达。Ras信号通路通过磷酸化转录因子HIF-1、SP1/3和AP2,导致其与DNA结合增强或者增强反式激活。另外Ras还通过信号通路刺激蛋白与3′-非翻译区结合,增强其mRNA稳定性。另外两个Ras信号通路通过磷酸化4EDD1,增强-IE4E的功能,促进翻译
2.Ras与血栓素(thrombospondin,TSP) TSP最早是从培养细胞的上清液中分离出的一种新生血管抑制因子,从肿瘤实验动物模型的血清中也可分离出,包括TSP-1和TSP-2。实验表明TSP可以与细胞外基质中的一些成分,如蛋白酶和生长因子结合,能够阻断血管生长因子诱导的毛细血管内皮细胞增殖、迁移和管腔形成,同时能加强平滑肌细胞对PDGF所引起的增殖和迁移反应。激活Ras的任何一个成员(H-ras、K-ras以及N-ras)都可以抑制TSP的表达。Ras蛋白参与的信号通路(Ras>Rac>MEKK1>JNKK>JNK),通过激活JNK磷酸化转录因子c-Jun,抑制TSP-1的表达;另外还有研究表明单独激活的c-Jun就像激活Ras一样,抑制TSP-1的表达。
3.Ras与环氧化酶(COX) COX是前列腺素(PGs)合成过程中重要的限速酶,它催化花生四烯酸转化为内源性过氧化物PGH2。它有两种同工酶:COX-1和COX-2。COX-2对肿瘤的作用一方面是因为在催化合成前列腺素的反应中,消耗了有促进细胞凋亡作用的花生四烯酸;另一方面则是因为合成的前列腺素增加可引起VEGF表达的上调而刺激血管的生成,这个过程可能通过PG-E2和其受体EP2、EP3的信号通路完成,但一些研究提示这个过程参与Ras诱导的血管新生过程。
具体研究表明,有几个信号通路促进COX-2表达。①Wnt信号通路;②缺少p53的表达;③HER-2/neu信号通路;④缺氧;⑤Ras和Src信号通路。(https://www.daowen.com)
Ras通过几个不同的信号转导途径调节COX-2基因的表达。首先通过Ras>Rac>MEKK1>JNKK>JNK信号通路磷酸化c-Jun,通过cAMP反应元件刺激COX-2转录。另外激活H-ras后,其经典的信号通路Ras>Raf>MEK>ERK1/2也是上调COX-2表达必需的,这可能通过磷酸化CCAAT/增强子结合蛋白β(C/EBPβ)和(或)通过Ets转录因子PEA3促进COX-2表达。
另外在肠上皮细胞研究中发现,激活K-ras2,增强COX-2mRNA的3′UTR的稳定性,促进其表达。这个过程可能与Ras>Raf>MEK>ERK1/2和Ras>PI(3)K>PDK>PKB信号通路有关。后一个信号通路控制cap依赖的mRNA翻译。但Ras是否对于COX-2mRNA和VEGF mRNA翻译起始有同样的作用尚不可知。
一些研究表明:抑制APC能调节Wnt信号通路,进而增强转录因子TCF的功能,这个转录因子可与COX-2启动子的TCF结合元件结合,促进COX-2的转录。另外激活Wnt信号通路能上调PEA3,进而促进COX-2的转录。这些研究表明:Wnt和Ras信号通路共同调节COX-2的表达(图6-2)。
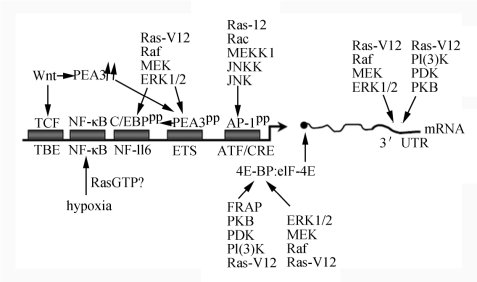
图6-2 Ras蛋白对COX-2表达的影响
激活Ras后通过其信号通路磷酸化转录因子C/EBP、PEA3和AP1导致转录激活增强。另外通过调节ERK1/2与PKB与其mRNA的3′-翻译区结合增强其稳定性。另外Ras还可能通过磷酸化4E-BP促进COX-2的起始翻译。最后激活wnt,Ras可能通过激活NF-κB有助于缺氧诱导的COX-2表达
4.Ras与蛋白酶 Ras激活后导致细胞外基质中蛋白酶表达增加(包括尿激酶纤溶酶原激活物(urokinase plasminogen activator,uPA),基质金属蛋白酶(matrix metalloproteases,MMP)。uPA与其受体结合后降解正常血管基膜成分,还可以起介导MMP的作用,并刺激上皮细胞增生和迁移。这对血管新生的开始是很重要的。激活Ras后有几个不同的信号通路刺激uPA表达。首先:Ets转录因子(Ras>Raf>MEK>ERK1/2的底物)和c-Jun(Ras>Rac>MEKK1>JNKK>JNK的底物)在-1967位点与PEA3(Ets转录因子)或AP1(转录因子结合蛋白1transcription factor activator protein 1,AP1)结合元件结合;另外激活Ras后活化MAPK和JNK,增强GTPase Ral的鸟苷酸交换因子,促进uPA的表达。
另外,H-ras通过PEA3和AP1结合位点调控MMP-9启动子的活性,促进其表达。促进uPA和MMP的表达对血管新生没有直接的作用,但可以通过降解ECM,促进生长因子VEGF或bFGF到达血管内皮细胞,增强这些因子的活性。
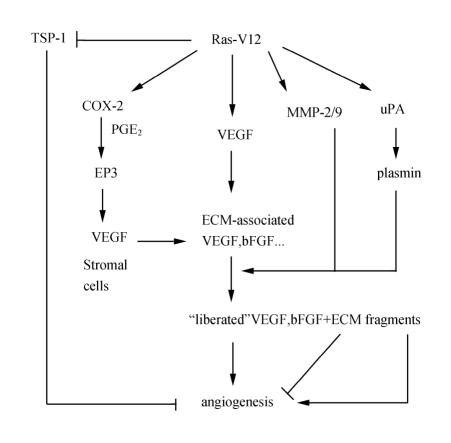
图6-3 Ras促进血管新生的机制
Ras蛋白通过下列途径促进血管新生:促进VEGF表达;刺激MMP-2/9和uPA表达降解细胞外基质,有利于细胞因子到达内皮细胞,激活内皮细胞;减少抑制血管新生因子TSP-1的表达促进血管新生
综上所述,Ras蛋白通过三个方面影响血管新生(图6-3):①刺激促进血管新生的生长因子;②减少抗血管新生的抑制因子;③保证生长因子到达局部细胞外基质。
