参考文献
第18章 眼新生血管性疾病的手术治疗
临床上许多眼新生血管性疾病需要手术治疗,本章主要介绍常见眼新生血管性疾病的手术治疗。
第一节 翼状胬肉的手术治疗
一、适应证和禁忌证
临床上人们习惯于将胬肉分为静止型和活动型,两者的主要区别在于胬肉的生长速度、胬肉头部的隆起态势及充血状况。但胬肉本身是一种慢性疾病,其生长速度受环境和眼部是否受炎症激惹相关。所谓静止型胬肉,只不过是其生长速度很慢,胬肉头部又较扁平而已。综合临床情况,以下几点可作为手术指征:
(1)短期内胬肉进行性生长明显,预期将侵犯瞳孔区角膜。
(2)虽未侵及瞳孔区,但产生明显的角膜散光,影响视功能。
(3)眼球运动受限引起复视或有睑球粘连者。
(4)妨碍美观。
(5)有碍计划中眼部其他手术的施行。
禁忌证:老年人静止型小胬肉,未侵及瞳孔区,胬肉呈萎缩状。
二、术前准备和麻醉方法
术前清洁外眼,术眼结膜囊滴抗生素眼液。麻醉方法视手术复杂程度而定,单纯胬肉切除术做表面麻醉加结膜下浸润麻醉。如有广泛粘连,术前则应给镇静药,术中则用2%利多卡因做眼球后神经阻滞麻醉或眼球周围麻醉,以确保角巩膜分离时无疼痛。
三、手术步骤
1.胬肉切除并暴露角膜缘巩膜术(pterygium excision combined with leaving bare sclera) 此术式仅限用于原发性翼状胬肉和球结膜较完整的复发性翼状胬肉的手术治疗,而不用于“假性”翼状胬肉及球结膜缺失的其他翼状胬肉。
(1)在手术显微镜下分离胬肉头颈部:用有齿镊夹持胬肉头颈部,一次性锋利尖头刀片沿胬肉边缘开外0.5mm处切开角膜浅层,控制切口深度至角膜前弹力层(图18-1)。
(2)自胬肉头部沿切口范围做浅层角膜切除,直至角膜缘。
(3)用弯剪潜行分离纤维血管组织与巩膜表层的黏附,直至胬肉体的末端或直肌止端(图18-2)。
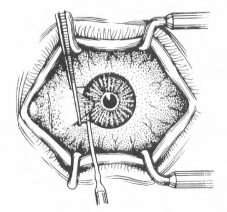
图18-1 分离胬肉头颈部
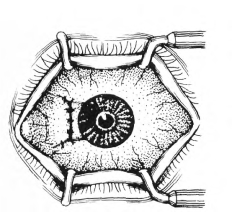
图18-2 分离胬肉及其结膜
(4)于胬肉体表面的球结膜下注入少量2%利多卡因液,以利于分离。沿胬肉颈体部外缘1mm处横向剪开结膜至胬肉体的终端,用剪刀钝性分离球结膜,以使胬肉体部表面的完整球结膜与结膜下纤维血管组织截然分开,务求球结膜片透明不带纤维血管组织。如果胬肉较小或胬肉表面的结膜张力小(即结膜较松弛),可仅做胬肉颈体部外缘上方或下方结膜剪开,有时不做上下方球结膜剪开亦能切除胬肉。
(5)彻底切除胬肉:距角膜缘2~3mm处,剪除胬肉头颈部表面的球结膜,并确保存留部分的球结膜不带胬肉残留组织(图18-3)。
(6)检查角巩膜创面有无胬肉组织及血管残留,务必剖切干净并力求表面光洁,以利于术后球结膜上皮移行修复和泪液膜的扩散附着。
(7)用5-0丝线或10-0尼龙线间断缝合固定原覆盖胬肉表面的球结膜于巩膜表层,但在角膜缘手术区,应裸露巩膜2~3mm(图18-4)。
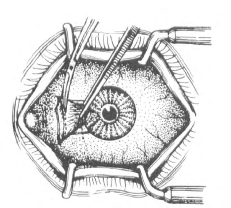
图18-3 切除胬肉及部分球结膜
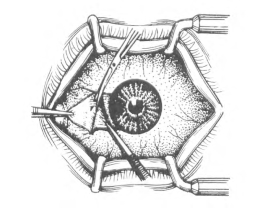
图18-4 角膜缘裸露2~3mm宽巩膜
(8)术眼涂四环素可的松眼膏,并敷纱布包扎。
2.胬肉切除并结膜移植术(pterygium excision combined with conjunctival grafting) 此术式适用于大范围胬肉、复发性胬肉并伴有广泛粘连的病例。游离胬肉表面及相邻的结膜已不可能,不得不用带蒂或游离的自体结膜取代胬肉切除后的结膜缺损面。自体结膜缺如时,亦可用极薄的口唇黏膜取代。
(1)切除胬肉头颈体部方法与单纯胬肉切除法相同。
(2)小心分离巩膜面粘连的胬肉组织,务求彻底清除增生性纤维血管组织病变区的球结膜及眼球筋膜,暴露巩膜并保持表面光洁。分离和切除过程中应防止巩膜过薄甚至穿孔,并仔细确认内直肌止端。必要时,用斜视钩探明内直肌或将内直肌钩出并做牵引后,方可切除粘连的病变组织。

图18-5 分离胬肉头部
(3)粘连于胬肉表面的球结膜不再分离,连同胬肉一并切除(图18-5)。
(4)在颞上象限分离出一面积与缺损面相当的球结膜。为确保结膜移植片只含结膜而不带眼球筋膜,分离前局部注射麻醉药,确保麻醉药注射于结膜与眼球筋膜之间,便于组织分离时层次分明。
(5)为避免球结膜移植片游离后收缩及正反面混淆,可在分离完毕而另一侧边沿尚未游离的带蒂状态下,先做两处断端预置缝线,以便于确认结膜片的正反面并予定位;继而剪断带蒂边缘,将球结膜移植片缘与植床结膜缘及其下方的巩膜表层用5-0丝线或10-0尼龙线缝合。但在距角膜缘手术区应裸露巩膜2~3mm(图18-6)。
(6)术眼涂四环素可的松眼膏,并敷纱布包扎。颞上方球结膜取片区的眼球筋膜裸露无须处理,其创面将会被邻近球结膜上皮移行覆盖。
3.胬肉切除并板层角巩膜移植术(pterygium excision combined with lamellar keratoscleal grafting) 此术式仅限于严重的复发性胬肉。由于胬肉与角巩膜广泛粘连,胬肉切除后角膜或巩膜残留厚度低于全厚度的50%。角巩膜移植片可用干燥保存材料。
(1)胬肉切除及球结膜移植片的切取法与胬肉切除并结膜移植术基本相同(图18-7)。
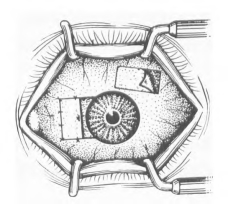
图18-6 缝合移植的球结膜
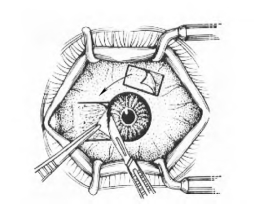
图18-7 切除复发性胬肉
(2)制作比创面大1mm左右的板层角巩膜移植片,其厚度应比缺损的角巩膜要薄。将其先后浸泡于0.5%两性霉素B和庆大霉素溶液中备用。
(3)用10-0尼龙线间断缝合固定板层角巩膜移植片。在缝合板层角巩膜移植片的过程中,边缝边修整,以期达到最佳吻合状态。
(4)裸露区巩膜处覆以自体球结膜移植片,对球结膜片做褥式缝合,固定于胬肉切除区“正常”巩膜的表层,以距角膜缘约1.5mm为宜(图18-8)。
(5)术眼涂四环素可的松眼膏,并敷纱布包扎。
4.胬肉切除并结膜瓣转移术(pterygium excision combined with conjunctival transplantation) 此为治疗翼状胬肉较为理想的一种术式。术后不仅复发率低,且美观,故常作为治疗原发性翼状胬肉的首选术式,亦可用于较小范围复发性或“假性”翼状胬肉的手术治疗。但对于>180°范围的复发性翼状胬肉,则应选用胬肉切除并结膜移植术(或板层角巩膜移植术)治疗为宜。而对于球结膜大部分瘢痕化者,禁忌施行此术式;伴有青光眼须做青光眼滤过性手术者,不宜施行此术式。
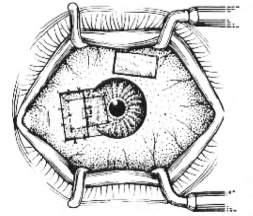
图18-8 缝合移植角膜和结膜
(1)在角膜缘与半月皱襞间的内1/3处垂直剪断胬肉体部,然后从切口的上下端向角膜缘做两条平行的球结膜切口(图18-9)。
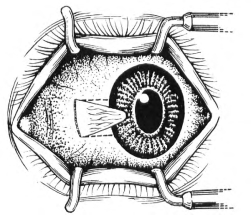
图18-9 垂直剪断胬肉体部
(2)用虹膜恢复器或圆刀将角膜侧的胬肉从巩膜和角膜上分离开,并予切除。分离时,除应将胬肉组织去除干净外,并特别注意勿损伤内直肌和切穿角膜或巩膜(图18-10)。
(3)用配带5号注射针头的注射器,于上方球结膜下注射2%利多卡因(或1%~2%普鲁卡因)0.5~1ml。进针时要浅,以针头刚穿入球结膜为宜,使球结膜与结膜下组织分离。这样做不仅易于分离,而且结膜瓣薄。根据鼻侧胬肉切除及巩膜裸露的范围,然后在角膜缘上方约6mm处做一条与角膜缘平行的球结膜弧形切口。用虹膜恢复器或剪刀潜行分离球结膜,直至角膜缘为止(图18-11)。
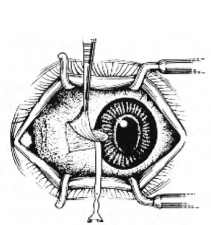
图18-10 分离并切除胬肉
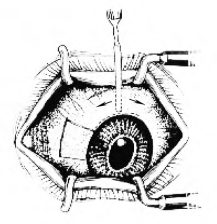
图18-11 制作球结膜瓣
(4)沿角膜缘和颞侧剪断球结膜,使其成为带蒂的结膜瓣。用无齿镊夹起带蒂的结膜瓣,将其向鼻侧转位90°覆盖在胬肉切除后的巩膜裸露区。此时应注意切勿将结膜瓣翻转,以免手术失败。用10-0尼龙线,将结膜瓣下端与下方球结膜切缘间断缝合2针。球结膜瓣鼻侧缘与内眦结膜缘做连续缝合,并予固定。如果球结膜瓣过宽,须加以修剪,使球结膜瓣缘与角膜缘之间留有2~3mm宽的空隙,以避免球结膜瓣与角膜缘创面粘连或结膜上皮过度增生侵及角膜(图18-12)。
(5)术眼涂四环素可的松眼膏,并敷纱布包扎。
5.胬肉切除并术中放置丝裂霉素(pterygium excision com-bined with mitomycin,MMC) 丝裂霉素(mitomycin,MMC)是由头状链霉素菌发酵物滤液中分离出来的一种抗肿瘤抗生素,在组织中激活成为一种烷化物,选择性抑制DNA、细胞RNA和蛋白质合成,从而阻止细胞分化和复制。通过组织培养证实,它是抑制成纤维细胞增殖的强烈抑制剂,其作用强度是氟尿嘧啶的100倍。其抗肿瘤作用归因于在DNA分子中与鸟苷酸残基形成共价键抑制DNA复制,阻止有丝分裂,导致细胞死亡,这种作用类似于X线照射,有人将其称为类放射物。自从Kunitomo(1963)首先报道翼状胬肉切除术后局部滴用MMC预防其复发以来,有许多文献报道术后滴用0.2~1mg/ml丝裂霉素,每日2~4次,持续5~15d,可使其复发率减少到0~13%。但也有报道可引起严重眼部并发症者,如角膜水肿、角膜穿孔、眼部感染、巩膜钙化、巩膜软化、巩膜溃疡形成及坏死、虹膜炎、突发白内障、继发性青光眼及睑球粘连等,其原因与药物浓度过大以及患者不加控制地较久应用、产生较高的药物蓄积浓度引起的毒性有关。近年来研究发现术中一次性局部应用丝裂霉素也可明显减少翼状胬肉复发率且副作用小,是一种预防翼状胬肉复发的安全、简单、有效的辅助措施。与术后局部滴用丝裂霉素相比,优点是仅对局部组织起作用,给药剂量可人为控制,减少了药物对角结膜上皮的剂量影响,消除了患者顺应性差的麻烦,避免了剂量依赖性并发症的可能。国内外学者做了大量研究,使翼状胬肉复发率控制在4%~42.9%,但是,药物的浓度及术中放置的时间各不相同,因此得出的结论也不同。Sanchez-Thorin J C等对5个RCTs(N=286眼)进行Meta分析,认为单纯做翼状胬肉切除,不联合其他方法的治疗方案是不可取的,手术切除联合自体结膜移植或应用丝裂霉素均能有效降低手术后的复发率。
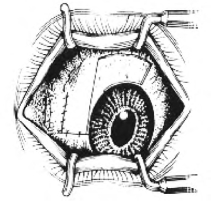
图18-12 缝合球结膜瓣
(1)在手术显微镜下分离胬肉头颈部。用有齿镊夹持胬肉头颈部,一次性锋利尖头刀片沿胬肉边缘开外0.5mm处切开角膜浅层,控制切口深度至前弹力膜。
(2)自胬肉头部沿切口范围做浅层角膜切除,直至角膜缘。
(3)用弯剪潜行分离纤维血管组织与巩膜表层之黏附,直至胬肉体的末端或直肌止端。
(4)于胬肉体表面的球结膜下注入少量2%利多卡因液,以利于分离。沿胬肉颈体部外缘1mm处横向剪开结膜至胬肉体之终端,用剪刀钝性分离球结膜,以使胬肉体部表面的完整球结膜与结膜下纤维血管组织截然分开,务求球结膜片透明不带纤维血管组织。如果胬肉较小或胬肉表面的结膜张力小(即结膜较松弛),可仅做胬肉颈体部外缘上方或下方结膜剪开,有时不做上下方球结膜剪开亦能切除胬肉。
(5)彻底切除胬肉。距角膜缘2~3mm处,剪除胬肉头颈部表面的球结膜,并确保存留部分的球结膜不带胬肉残留组织。
(6)检查角巩膜创面有无胬肉组织及血管残留,务必剖切干净并力求表面光洁,以利于术后球结膜上皮移行修复和泪液膜的扩散附着。
(7)将一含有0.02%丝裂霉素溶液的棉片(2×4mm)置于角巩缘5min,去除棉片,100ml生理盐水冲洗角巩缘。
(8)用5-0丝线或10-0尼龙线间断缝合固定原覆盖胬肉表面的球结膜于巩膜表层,但在角膜缘手术区,应裸露巩膜2~3mm。
(9)术眼涂四环素可的松眼膏,并敷纱布包扎。
四、术后处理
(1)原发性胬肉切除术后,术眼用纱布包扎,每日换药1次(涂四环素可的松眼膏)。术后第5日拆除球结膜缝线,术眼滴0.25%氯霉素、0.05%地塞米松或1∶2 000塞替哌眼液,每日4次,持续2~3周;亦可用0.04%丝裂霉素溶液滴眼,每日3~4次,持续1~2周。
(2)复发性胬肉术中及术后,用90锶β射线治疗,一次性照射8~9Gy(800~900rad)。亦有人认为此剂量偏低,应用总量为30Gy(3000rad),分3次照射完成。90锶可衰减为90钇,并释放出β射线而无γ射线。照射后引起的管腔闭塞性终末动脉炎,阻止成纤维细胞增殖和血管形成,以达到抗胬肉复发之目的。惟治疗过程中宜注意:充分表面麻醉,治疗器对准治疗区,切忌加压,以避免引发放射性白内障。
(3)对于复发性胬肉切除并板层角膜移植术后,术眼用药同原发性胬肉切除术。术后第14日拆除板层角膜移植片固定缝线。
(程 瑜)
第二节 角膜新生血管性疾病的手术治疗
大多数角膜盲可通过角膜移植复明,但导致角膜移植失败的主要原因仍是排斥反应,特别是新生血管化的角膜,术后排斥反应发生率高达60%以上,所以此类病人被称为“高危角膜移植病人”(high-risk keratoplasty patients)。正常情况下角膜无血管、无淋巴管,受体的循环免疫细胞不能或不易与外来抗原接触而建立免疫反射弧,使角膜植片长期处于对外来抗原的未识别状态,所以T淋巴细胞不易到达移植片部位,使移植片处于相对的“免疫赦免”状态。角膜新生血管化,多伴随角膜缘干细胞的缺乏或不健全,造成角膜上皮再生障碍,角膜上皮长期缺损使大量的多形核白细胞浸润;新生血管化的角膜缘含有大量的淋巴细胞及Langerhans细胞,建立起来的免疫传入弧容易携带和传送外来抗原,破坏了这种“免疫赦免”状态;致敏的免疫活性细胞循着扩张的淋巴管到达抗原所在区而发生免疫反应,以上这些因素均会使高危角膜移植术后的排斥反应发生率明显增加,成为手术失败的最主要原因。角膜实质层的新生血管比表层新生血管更易发生排斥反应。
20世纪80年代以来,随着对眼表面上皮细胞分化及创伤愈合过程的深入研究和了解,特别是角膜缘干细胞新概念的确立,一种旨在恢复眼表面的完整性,防止眼表面新生血管和假性胬肉侵入,促进患者视力恢复的眼表面重建术已取得很大进展。角膜缘干细胞是角膜上皮细胞增殖和分化的源泉,由角膜缘干细胞再生修复的角膜上皮,形态与角膜上皮一致,其细胞表现型介于结膜上皮和角膜上皮之间。如果角膜缘上皮保持正常,即使全角膜上皮受损,仍可通过角膜缘干细胞的增殖、移行可获得角膜型上皮修复,同时恢复其功能。如果全角膜缘受损,角膜表面将由结膜型上皮修复。
一、自体或异体结膜移植术
自体或异体结膜移植术[conjunctival transplantation,CT;Thoft方法(图18-13)],表面麻醉联合浸润麻醉。距角膜缘外5mm范围剪开结膜,钝性分离并去除结膜下的瘢痕组织,暴露出光滑平整的巩膜面。再剖切角膜表面的病变组织,至露出透明的角膜组织。如病变组织较浅,则可直接取自体或供体结膜植片。根据病变范围大小,取相应大小的结膜移植片,行结膜移植术。如为360°病变范围,则取4片3mm×4mm菲薄的结膜片(如供体材料丰富,可采用Herman方法取大片异体结膜片,图18-14),置于角膜缘的四个象限,基底在角膜缘部以10-0尼龙线缝合固定,使上皮与角膜缘紧贴。如要联合羊膜遮盖术,则需先行羊膜遮盖术(详见羊膜移植手术)。术后局部加压包扎,防止植片移位,3d后抗生素及激素眼液点眼。术后3~4周拆线。
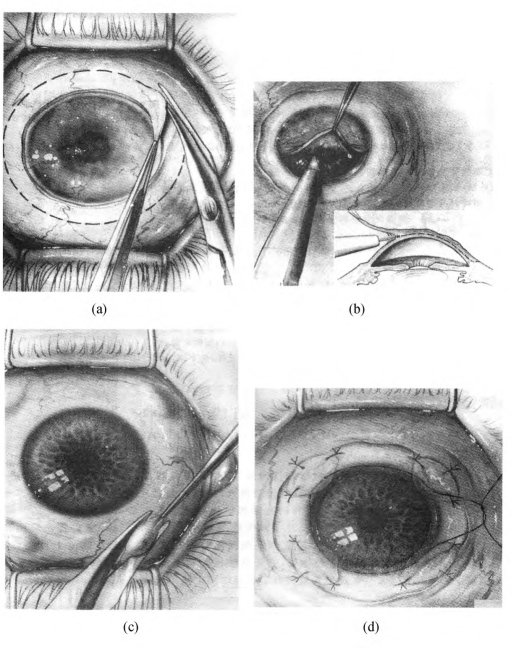
图18-13 结膜移植术(Thoft法)
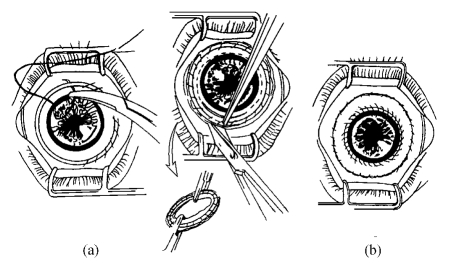
图18-14 结膜移植术(Herman法)
二、角膜缘上皮移植术
角膜缘上皮移植术[limbal transplantation,LT;Kenyon方法(图18-15)];由于结膜移植术所修复的角膜表面为结膜细胞表型,分化为角膜样上皮细胞后,在形态及功能上不能完全角膜化,而且新生的上皮细胞黏附不牢,容易脱落,眼表面重建效果不理想。1989年Kenyon首创了角膜缘上皮移植术,通过供体角膜缘干细胞的增殖、分化及细胞的向心性移行来修复、稳定受损的角膜表面,阻止新生血管侵入及假性胬肉形成、假性胬肉复发。
麻醉与植床剖切同结膜移植术,如角膜病变不超过1/3角膜厚度,则单纯行角膜缘上皮移植术;如超过1/3厚度,则联合行部分板层或全板层移植或穿透性角膜移植术。取供体眼球上包括0.5~1.0mm角膜缘上皮的角膜缘及其连带的5~10mm结膜组织,将植片置于受眼病变较重的部位,植片的角膜缘侧与受体的角膜缘侧相对合,用10-0尼龙线间断缝合固定。术后加压包扎,3d后开放点眼,必要时配合抗排斥眼液。术后3~4周拆线。
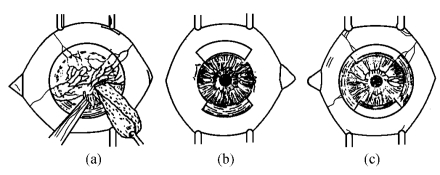
图18-15 角膜缘上皮移植术(Kenyon法)
三、羊膜移植联合角膜缘上皮移植术
羊膜移植(amniotic membrane transplantation,AMT)联合角膜缘上皮移植术(图18-16)。AMT有促进结膜上皮细胞转化为角膜型上皮细胞的作用,还可明显抑制新生血管和假性胬肉形成,羊膜移植后,羊膜下的纤维组织和炎症细胞明显减少。

图18-16 羊膜移植联合角膜缘上皮移植术
麻醉及病变组织剖切同结膜移植术。将供体羊膜上皮面向上,展开平铺于角巩膜上,用10-0尼龙线间断缝合固定于角膜缘外2mm的浅层巩膜上。剪去多余的羊膜组织(或将多余的羊膜组织平铺埋藏于周围的结膜下);再将周围的结膜组织覆盖于羊膜上,10-0尼龙线固定于浅层巩膜上。最后将宽3mm、长5mm包括角膜缘上皮的结膜组织,上皮面向上置于受损严重的角膜缘处,供体角膜缘侧与受眼角膜缘侧相对合,间断缝合固定于羊膜及浅层巩膜上。如角膜病变超过1/3厚度,则联合行板层移植或穿透性角膜移植术:完成角膜移植后,将羊膜覆盖于角膜上,略大于角膜直径,同样固定于角膜缘外的浅层巩膜上,再同法行角膜缘上皮移植术(联合带角膜缘上皮、结膜上皮、部分巩膜板层的全板层角膜移植术,除外)。术后3~4周拆线。
四、板层角膜移植术
板层角膜移植术(lamellar keratoplasty,LKP):也适于角膜血管翳性浑浊,但须联合角膜缘上皮移植术,为受眼提供健康的角膜上皮来源(如为包括角膜缘上皮及结膜上皮的全板层角膜移植,则无须再联合手术)。
同结膜移植术方法先剖切角膜结膜表面的新生血管,根据病变范围选适当直径的环钻,垂直术眼角膜中央,进行板层角膜切开,然后用刀片沿环钻标记剖切角膜板层组织,可分多次渐进式剥离角膜实质层,防止切穿角膜,直到暴露出光滑透明的角膜组织。植片制作:在供体眼球的角膜缘处切一小口达深板层,虹膜恢复器经此小口进行全角膜的深板层钝性分离,植片的直径一般比植床大0.2mm,环钻钻取供体角膜,将板层角膜植片覆盖于植床上,10-0尼龙线对位缝合。联合角膜缘上皮移植步骤同前。术后加压包扎3d,点眼同前,术后3个月拆线。
五、带巩膜板层的全板层角膜移植术
适于角膜缘干细胞衰竭者。此术先剖切角结膜表面的新生血管及其深层病变角巩膜组织,直至暴露出透明的角膜。植片制作:沿供体眼球的角膜缘外5mm范围360°剪开球结膜(如结膜受损范围较大,可适当多取些供体结膜),仔细分离并去除结膜下的筋膜组织,角膜缘外2mm范围再进行360°的巩膜板层剖开,板层分离至透明角膜缘,再利用虹膜恢复器进行全角膜的深板层钝性分离。将植片覆盖于植床上,植片巩膜与植床巩膜对位缝合,植片结膜与受体结膜间断或连续缝合。术后加压包扎,3d后抗生素眼液及人工泪液点眼。术后3~4周拆线。
(陈梅珠 朱益华)
第三节 视网膜新生血管性疾病的手术治疗
视网膜新生血管性疾病影响患者眼底的血循环,导致视网膜广泛缺血,除严重威胁到患者的视力外,其继发的新生血管性青光眼等疾病也给患者的身体造成极大的损害。由于发病机制极其复杂,至今尚未完全明了,导致药物治疗效果不明显,而激光治疗对于晚期患者几乎无效。在这种情况下,手术方法就越来越受到人们的重视,常规手术方法的改进和新兴技术的研究如火如荼,下面就常见视网膜新生血管性疾病的手术治疗作一介绍。
一、增生性糖尿病视网膜病变
1.玻璃体手术 当玻璃体积血经药物治疗持续不能吸收或玻璃体内机化条索增生严重,导致牵引性视网膜脱离时,须行玻璃体切割手术联合激光光凝。手术的目的在于切除积血和已分解物质;切断、吸除机化膜;去除纤维组织赖以生长的支架,松解对视网膜的牵拉;恢复视网膜的正常解剖结构,以便为随后的光凝创造条件。
适应证:严重的玻璃体积血,妨碍眼底检查,时间在1个月以上;增生性玻璃体视网膜病变,牵拉视网膜导致反复出血;已发生的牵引性视网膜脱离,尤其是累及黄斑者;纤维增殖膜引起视网膜裂孔或累及黄斑;致密的黄斑前出血达3个月者;黄斑水肿合并黄斑移位,光凝效果差;前节新生血管合并后节屈光间质浑浊;白内障合并严重的增殖性玻璃体视网膜病变。
禁忌证:视功能检查光定位不佳;视网膜电流图呈熄灭型;虹膜大片新生血管、后粘连,晶状体浑浊,眼压低;玻璃体内大片增生物,上有粗大的血管等。
并发症:眼内出血;医源性裂孔;晶状体浑浊加重;继发性青光眼;角膜上皮愈合延迟等。
应注意鉴别孔源性视网膜脱离和牵引性视网膜脱离,孔源性必须及早手术而有些牵引性视网膜脱离患者在不做手术的情况下,较长时间内仍能保持一定的视力。同时,有对照实验证明,早期DR或术前视力较好的患者术后视力恢复好。
而对于光凝后导致的持续性黄斑水肿,玻璃体手术联合内界膜剥除在视力和OCT等方面被证明是确实有效的,内界膜剥除被认为能减轻黄斑水肿的压力,有利于内层视网膜血液和细胞外液体顺利流出。另外,也有学者采取玻璃体手术联合曲安奈德眼内注射和术中全视网膜光凝的方法来治疗,同样取得了令人满意的结果,且没有术后并发症。为了分别评价玻璃体手术、光凝和曲安奈德眼内注射对治疗黄斑水肿的效果,Parolini等将169例患眼随机分为3组,分别施以上述治疗措施,并随访视力和中心凹厚度(OCT)达6~24个月,发现只有玻璃体手术组患眼能持久保持较好的视力,且此组的中心凹厚度增加也是3个组中最少的;玻璃体组和曲安奈德组的术后并发症较多也较重;光凝组和曲安奈德组的治疗效果易回退,尤其是曲安奈德组的效果一般只能持续1个月。他们的结论是对于施行何种治疗,合适的病例选择非常重要,OCT是良好的评价工具。Bandello等则试用轻度反应全视网膜光凝(LPRP)进行治疗,发现其效果与传统PRP相同而因采用了较少的能量,并发症和治疗次数都有减少。
2.垂体部分切除术 对减轻部分患者的视网膜血管病变有一定的帮助,可以减少出血水肿、导致新生血管萎缩和缓解血管病变。适用于全身病情稳定和视力预后较好,又不宜于做光凝的患者。
二、视网膜静脉阻塞
视网膜静脉阻塞的主要原因是视网膜血管硬化和静脉炎症所导致的管腔狭窄、血流受阻。通常采用药物和激光治疗,手术的目的在于解除血管阻塞和(或)由此引起的严重并发症(玻璃体积血、新生血管性青光眼等)。
1.动静脉外膜切开术 视网膜动静脉交叉处有共同的血管外膜,如动脉硬化,则可压迫静脉管壁,致其狭窄、血流受阻,从而发病。动静脉外膜切开术可以切开该处的血管外膜,减轻静脉的受压程度,恢复正常的血流供应,尤其适用于分支静脉阻塞。BRVO的动静脉交叉处,存在两种类型:静脉后交叉和静脉前交叉,前者是BRVO的重要危险因素之一。
(1)主要术式
①Charles术式:行常规三通道玻璃体切割术,用Sutherland剪横切开压迫静脉的神经胶质箍,用弯的MVR刀剥离阻塞处动静脉交叉间的神经胶质纤维,将动脉从静脉上完全分离。
②Opremcak术式:行常规三通道玻璃体切割术,用弯的MVR刀在邻近动静脉交叉10~500μm处切开内层视网膜,从动脉下方平行于动脉连续切开,直到动静脉共用的外膜,轻柔上提,在交叉点处切透外膜,将动脉从下行静脉上分离。
③Mester术式:行常规三通道玻璃体切割术,剥除动静脉交叉处的内界膜。用玻璃体剪刀,平行于动脉分离外膜。
④Han术式:行常规三通道玻璃体切割术,弯的MVR刀分别从动静脉交叉处的远端和近端分离动脉,平行于动脉做1~2mm的视网膜切开,将远端和近端切口相连,把动脉从视网膜表面游离。
(2)预后:研究发现术后6周,93%的患眼毛细血管灌注改善;多焦ERG也证实黄斑区反应振幅峰值增加,反映黄斑功能改善;SLO发现术后1个月中心固视稳定。
(3)并发症:血管破裂出血;术后高眼压;视网膜脱离;白内障形成或加剧。
2.放射状视神经切开术 对于中央静脉阻塞患者,他们的受阻部位在巩膜管内,筛板区是血栓最易形成导致血管阻塞的部位,无法直接采取动静脉外膜切开术,所以就产生了放射状视神经切开术。目的是通过放射状切开筛板区偏外侧,使该处的神经血管间隙直接与蛛网膜下隙相通,有可能增加液体回流,改善筛板平面的血液灌注、静脉回流和视神经纤维的轴浆运输;也有人认为放射状视神经切开术可以诱发血管吻合,与激光诱发的视网膜脉络膜血管吻合相比,其部位更靠近视神经,更易促使静脉回流,改善血供;通过玻璃体手术去除玻璃体后皮质,对于消除黄斑水肿有利。由于视神经纤维的分布在视盘鼻侧呈放射状,颞侧则呈弧形且有视盘黄斑束通过,故切开多选择在鼻侧进行。
(1)手术方法:行常规三通道玻璃体切割术,用弯的MVR刀(可避免斜行进入视神经纤维)从视盘外缘向外延伸,尽量垂直于视盘边缘刺入,深度以到达MVR刀最宽处为准,一般约为2.2 mm。是否进行激光治疗可根据眼底情况而定。
(2)并发症:视网膜脱离;视网膜出血;玻璃体积血;眼球破裂;视网膜中央动静脉损伤,严重的结果可导致失明。因器械损伤所致的出血,可通过提高眼内压的方法来解决,一般上升至0.7kPa(80mmHg),2min后即可止血。
(3)预后:与手术时机和病变类型密切相关,已有玻璃体积血或虹膜新生血管等晚期表现的预后不佳,即使通过手术也很难挽救视力;老年人因动脉硬化所致的静脉阻塞效果较好,而青年人因静脉炎症所致的病变则效果不理想。研究发现,术后1个月的OCT和眼底照相表明黄斑水肿明显消退,术后2~3个月,眼底的出血可大部吸收,75%患眼的眼底血循环恢复正常,其病程的改善明显好于自然病程;由于Zinn-Haller环必然被破坏,部分视盘缺血,视野检查可示缺损,提示存在视神经的损害。动物模型的病理检查也发现,被切断的神经轴索及其附属髓鞘发生Waller变性,在手术区同正常的神经纤维束之间存在清晰的分界线。
3.手术诱导视网膜脉络膜血管吻合
(1)手术方法:采用常规三通道玻璃体手术,切除玻璃体后皮质后,在靠近脉络膜的视网膜大静脉附近行切口,贯通血管壁,以形成视网膜脉络膜血管吻合,并行眼内激光以防止出血及视网膜脱离。另一种方法是完全切断受累静脉,在该静脉的两侧行全层视网膜切开,直至Bruchs膜。
(2)并发症:玻璃体出血;视网膜脱离;白内障生成等。
(3)预后:Mirshahi术后随访发现有90%患眼成功形成血管短路,视力恢复远较对照组为佳,且无新生血管生成,而对照组有39%产生新生血管。
4.玻璃体手术联合气体填充 玻璃体手术联合长效气体眼内填充可以增加视网膜的氧供、去除玻璃体积血、松解牵拉,但是切除玻璃体可能导致前房内促血管因子的增加,从而引起新生血管性青光眼,因此,视网膜光凝是必须的。
三、早产儿视网膜病变
1期和2期患儿只须观察,3期阈值病变合并附加病变时,须立即行视网膜光凝或冷凝,4期以上行手术治疗。
1.光凝和冷凝
(1)光凝方法:局麻或全身麻醉下,在视网膜无血管区内,到达但不包括嵴,行激光光凝,两点间间隔1~1.5个光斑直径,一般功率0.3~0.5W,曝光时间0.2~0.5s。
(2)冷凝方法:局麻或全身麻醉下,间接眼底镜下在视网膜无血管区有序连续冷凝40~50点,时间2~3s,不能在嵴上直接冷凝。
成功的冷凝虽然获得了视网膜解剖上的复位,但因无血管视网膜上冷凝往往过量,不可控制,可能导致黄斑萎缩、视力预后不佳。而光凝就完全没有这些问题,对于后极部的ROP,光凝的有效率(80%~88%)也显著优于冷凝的20%~40%。在近视发展的影响上,激光治疗后的近视发生少,度数低。就操作而言,激光操作简便,创伤小。
(3)预后:Al-Ghamdi等比较了两组分别施以光凝和冷凝手术的具有可比性的ROP阈值患儿,结果证实了光凝组的视力预后较好,其近视和逆规散光的度数均显著低于冷凝组。Azad则提出虽然光凝的效果优于冷凝,但由于经济原因,在广大发展中国家,冷凝作为一种有效的治疗措施还是值得考虑的;同时,他也认为在阈值前期治疗的预后更佳。
2.巩膜扣带手术 手术的目的是解除视网膜牵引,促进视网膜下液吸收及视网膜复位;可以阻止4A、4B期病变发展到5期。Prost在68名121只ROP 5期患眼上施行了巩膜手术,视网膜完全复位率达52%,部分复位率达24.5%,只有1/5的患眼视力超过0.02。因此他认为,虽然视力预后不佳,但相对于玻璃体手术的高昂费用和严重的并发症,巩膜手术的视网膜复位率还是令人满意的。Tufail也认为两者的视网膜手术一次复位率差别并不大(11/15对8/14,差别无统计学意义)。
3.玻璃体手术 有闭合式(常规)和开放式之分。开放式的宽阔的手术视野允许手术器械自由操作,可以彻底清除严重的晶状体后纤维膜和视网膜周边基底部增殖病变;而闭合式的手术创伤少,眼压稳定。
开放式方法:
(1)沿角膜缘全周剪开球结膜,并用Flieringa环固定,用环钻取下角膜片并放于培养液中。
(2)6、12点处,放射状剪开虹膜,行晶状体囊内摘除。
(3)弯剪切开、分离紧贴睫状突的晶状体后纤维膜。
(4)用玻璃酸钠打开视网膜漏斗暴露玻璃体增殖膜,并行膜剥离。
(5)10-0尼龙线缝合虹膜伤口,缝回角膜片。
(6)用玻璃酸钠形成前房,恢复眼压展平视网膜。
(7)术后局部应用激素、睫状肌麻痹剂和抗生素。
对于4期ROP患儿,有学者建议除常规采用的玻璃体手术外,晶状体粉碎也必不可少,因为它能为彻底切除周边部增殖的纤维膜提供良好的手术视野和操作便利,而患儿的视力恢复也较好。Hartnett等回顾性比较了玻璃体手术和巩膜扣带术的治疗效果,发现在两组患儿矫正胎龄、体重和ROP分级具有可比性的前提下,玻璃体手术的视网膜一次复位率(72%)远较巩膜扣带术(31%)为高,但再次手术后,最终视网膜复位率没有差别。
手术治疗视网膜新生血管疾病的方法已有多种,新的方案不断涌现,也已取得了不少成果,但因缺乏前瞻性、长期随访、随机对照实验的研究,部分方案的确切效果还有待进一步证实。目前基础研究的最新进展提示此类疾病的发病机制是多种因素作用的结果,生长因子在其中的作用极大,似应由此入手,结合已有的有效措施,进行综合治疗。
第四节 脉络膜新生血管性疾病的手术治疗
新生血管性(渗出性)年龄相关性黄斑变性(Exudative age related macular degeneration,ARMD)是发达国家造成老年人视力丧失的主要原因。主要是因脉络膜新生血管膜(choroidal neovascular membrane,CNVM)长入视网膜下或色素上皮下引起视网膜色素上皮细胞(retinal pigment epithelium,RPE)瘢痕形成和视网膜光感受器变性所致。药物治疗效果不佳;普通光凝又因CNVM多离中心凹很近而无法实施;PDT的效果虽然不错,但费用昂贵且极易复发,往往需要3~4次治疗;TTT费用少但疗效也差了许多;新兴的基因治疗则有待更多的研究。故而对手术方法的探讨引起了诸多学者的兴趣,也取得了一定的成果。
一、新生血管膜剥除术
1.手术方法 术前使用ICGA对手术时所拟用的视网膜切口进行精确定位,以保证CNVM能完全取出。采用常规玻璃体手术三通道切口,切除后极部的玻璃体。在靠近CNVM的视网膜上造口,用33G的灌注管向视网膜下腔注入最多0.5ml的平衡液以保护视网膜神经感觉层并使CNVM和其他组织分离,便于手术操作;如有粘连(提示存在外层视网膜退行性改变),则用30G的自制弯针的锐利面进行分离。切除CNVM时须将眼压提升至视网膜中央动脉产生搏动为止,但时间不能超过10min。如CNVM边界清楚,可用25G的镊子抓住CNV的边,轻柔地提升撕拉,使其与周围的RPE逐渐分离并取出;如边界不清,则根据术前所用ICGA的引导用30G的锐针进行分离。然后对玻璃体腔进行5min的冲洗以去除可能存在的RPE。使用气-液交换以展平视网膜,填充20%SF6并嘱术后保持俯卧位。对于视网膜切口,可视情况而选择光凝处理。
2.并发症
(1)因CNVM极其脆弱而导致黄斑下出血,影响手术时操作和术后视力恢复,故切除CNVM时必须提升眼压,术毕应将已有的出血吸除干净,围手术期可酌量使用促凝血药物。
(2)CNVM复发,这往往与手术未将CNVM彻底切除干净有关,故强调术前的ICGA定位。
(3)与玻璃体腔内残留的RPE有关的PVR,和由此而来的视网膜脱离。预防上应以手术动作轻柔和术毕彻底清洗玻璃体腔为主,一旦发生,则根据情况选择视网膜脱离手术。
(4)脉络膜毛细血管萎缩:手术切除脉络膜新生血管往往会造成相应部位的RPE被剥除及随之而来的脉络膜毛细血管萎缩。这被归因于RPE的去分化以及无法黏附于Bruch膜从而不能有效形成正常的色素上皮单层。
3.预后 视力恢复并不理想,多在20/100和20/400之间且往往伴有黄斑外注视,这可能与手术损伤本身和术后脉络膜毛细血管无灌注导致光感受器萎缩有关。潜在发展的病程、黄斑中心凹下脉络膜新生血管的扩大和切除物中包含脉络膜是视力预后差的危险因素;而病变侵犯Bruch膜的程度,新生血管与RPE及Bruch膜的位置关系,膜的成因直接与预后有关。术后脉络膜毛细血管灌注异常的原因包括术前脉络膜毛细血管萎缩和手术时对毛细血管网的损伤。但值得注意的是术后数日内的ICGA显示毛细血管网灌注尚正常,而6周左右方出现异常,而无灌注区面积扩大的时间可持续到术后1年,这一点尚未能得到解释。也有学者认为这与手术造成的RPE脱失有关[切口边缘的RPE不能完全长入脱失区和(或)无力供应其下的脉络膜毛细血管网],这就为促RPE植入切口床治疗(RPE植入术、辅助生长因子治疗、生物化学工程重建RPE植床等)提供了依据。
复发率也居高不下,据统计有13%~16%的患眼持续脉络膜新生血管化,27%~40%的患眼复发。
Childs等将336例中心凹下脉络膜新生血管患者随机分为手术组和对照组,对其进行长达4年的生存质量调查。发现在基准时间2年后,对照组的NEI-VFQ评分较基准线下降了1点,而手术组并无差别;但就总体而言,两组的生存质量无差异。
二、黄斑转位术
这种手术方法基于这样一个理论:ARMD中受累的RPE多聚集在黄斑区,如果手术使黄斑转位,则在新黄斑区的受累RPE将大大减少甚至消失,从而可形成正常的黄斑生理环境,显著增加视力。
1.手术方法 人工诱导视网膜脱离(从小视网膜切口往下腔注射BBS或从巩膜进行视网膜下腔注射,两者效果相仿,但眼内注射更精准一些),玻璃体切除,360°锯齿缘周边视网膜切开,脉络膜新生血管剥除,注射重水后进行30°~80°的视网膜绕视神经旋转(使中心凹与原RPE受累区离开0.5~1DD),360°眼内光凝和硅油注入,以后视复视情况而选择眼外肌手术。另有学者提出“有限转位”,利用预置转位缝线使黄斑向上方逆时针旋转90°,但其效果有待进一步证实。
2.并发症
(1)视网膜脱离:与手术行360°视网膜切开导致大量RPE进入玻璃体腔有关,也可能因光凝不够而使视网膜未能完全复位,硅油进入视网膜下而起。
(2)视网膜表面膜:因RPE在视网膜表面聚集增殖而诱发。
(3)复视:可能有以下三个因素与之有关,患者的年龄(老年患者往往因病变较重而使手术时黄斑转位的幅度较大);黄斑转位的幅度;扭转神经代偿(年纪较轻者代偿能力较强)。
(4)CNVM复发,具体原因尚不清楚,可能与黄斑微环境有关。
(5)因硅油所致的角膜失代偿。
(6)黄斑皱褶。
(7)黄斑水肿:囊样水肿很难从检眼镜或OCT下发现,只能通过荧光造影才能获知。
(8)术后低眼压:Ichibe报道了1例黄斑转位联合360°视网膜切开患者,硅油取出后严重低眼压,虽予气体填充,但随着气体的吸收,症状仍很严重,只能进行再次硅油填充,这样的眼压也只维持在0.7~0.9kPa(5~7mmHg)。
3.预后 以往研究发现约有2/3的患眼视力得到不同程度的恢复(近视力较远视力恢复更加明显,阅读速度也显著提高),如果术前最佳校正视力>20/80,则视力的恢复更为明显,在术后10~12个月最好校正视力可达最佳。通过微型视野机也证实黄斑中心凹的敏感度和固视稳定性也较术前有明显好转。
Hiroko对15眼进行术后ERG随访,发现虽然视力有不同程度的上升或保持稳定,但视锥和视杆细胞的振幅有12%~50%的下降,提示视网膜功能受到手术的影响。这可能与视网膜切开、光凝等因素有关。而Fang也发现虽然术后光镜下视网膜结构改变极其轻微,但术后1个月中心凹的明暗适应均明显下降,直至3个月方才得到少量恢复。
三、色素上皮移植术
1.手术方法 人工诱导玻璃体后脱离,完整的玻璃体切除,CNVM剥除,下方周边视网膜切开(以减少由此引起的盲点)后在视网膜下腔注入林格液以造成视网膜脱离(该区域应远离锯齿缘和三通道切口),用改制的21G吸引器从Bruch膜上轻柔地将RPE/林格混合液吸入预置有10%自体血浆(以防RPE黏附于管壁上)的离心管内,离心(3g,5min)后将上清液(含有RPE小球)注入新生血管膜剥除区(可加0.2ml,0.1mg/ml赖氨酸以增加细胞和受损的Bruch膜之间的黏附),注入1ml重水以防止细胞回流(减少术后PVR的发生),于视网膜切开区进行光凝,气体或硅油填充。术后24h嘱患者保持仰卧位。也有学者采取虹膜色素上皮移植来避免取RPE带来的手术并发症,同样取得成功。
2.并发症
(1)视网膜脱离:与进入玻璃体腔的RPE增殖或视网膜未完全复位有关。
(2)新生血管膜剥除区出血:要求剥除CNVM和注入RPE时动作轻柔。
3.预后 只有少数患者的CNVM剥除区可见色素沉着,随之而来的是轻度的视力上升。大部分患者眼底检查CNVM剥除区未见改变,视力恢复也不明显。这说明移植的RPE存活率很低,生物效能差。Bindewald对手术方法做了改进,除了将整个RPE-Bruch膜-脉络膜复合体(一般取自自身中周部)移植外,他还使用了准分子激光将多余的脉络膜组织融化,并辅以抗VEGF因子的药物治疗,效果令人满意。此外,也有学者通过研究发现在基底膜完整的情况下,覆盖的RPE要比不完整组高3倍。Gullapalli进行了体外色素上皮细胞培养,认为ARMD患者的Bruch膜无法支持移植的RPE存活和分化,致使RPE结构紊乱和细胞死亡,为了取得较好的手术效果,就必须对Bruch膜进行修饰或移植完好的Bruch膜。Tezeld用机械方法将Bruch膜分为3层,分别观察RPE移植在基底膜、弹性蛋白层和内胶原层的生长效果,发现在移植后14d,在基底膜上的RPE已聚集成团而另外两组直至21d仍未出现类似改变。
以上三种术式是目前治疗CNVM最常用的方法,各有利弊。单纯的CNVM剥除并发症较少但极易复发,视力恢复也远不理想,目前往往联合另两种术式;黄斑转位术操作复杂且并发症多,但效果却较另两种稍好;RPE移植存在严重的存活率问题,有待进一步的研究。
其他脉络膜新生血管疾病诸如多发性脉络膜血管病变(polypoidal choroidal vasculopathy,PCV)、病理性近视眼新生血管性黄斑病变(myopic neovascular maculopathy)、组织胞浆虫病、血管样条纹等的手术治疗方法多与ARMD一致,在此就不再赘述。
(王 方 宋正宇)
第五节 新生血管性青光眼的手术治疗
原发性青光眼施行常规的滤过性手术(如小梁切除术),成功率可达73%~95%。然而,对于某些类型的继发性青光眼,如新生血管性青光眼等施行这类手术,由于滤过泡区的纤维增生,难以建立有效的滤过通道,往往导致手术失败,其成功率只有11%~52%,这些青光眼统称为难治性青光眼、顽固性青光眼或复杂性青光眼。新生血管性青光眼由于虹膜纤维血管组织容易导致瘢痕过度形成和出血,因此新生血管性青光眼的小梁切除术的成功率很低(少于25%)。如果眼部情况允许首先执行视网膜光凝术,这将能防止眼前段新生血管发展和常使已存在的虹膜和房角新生血管消退。待虹膜新生血管减少或消退后,如需要行滤过手术,改良小梁切除术的成功率将会明显提高(成功率达50%~60%)。但在某些病例,改良小梁切除术后仍难以形成功能性滤过泡,手术最终依然失败。在这种情况下,可选择房水引流物植入术或睫状体破坏性手术。在有些病例,也可直接选择房水引流物植入术或睫状体破坏性手术,这要根据患者的视力等多方面的情况来考虑。
一、改良小梁切除术
改良小梁切除术又称复合式小梁切除术。像传统的青光眼滤过性手术一样,改良的小梁切除术仍然存在两个主要问题:术后早期低眼压、浅前房或无前房,术后后期滤过泡瘢痕化失败。虽然近代联合应用抗代谢药物显著改善了滤过泡瘢痕化问题,但术后超滤过、低眼压性的黄斑病变等并发症亦相应增加,改良小梁切除术的概念是在小梁切除术的基础上联合下面若干新技术组成:①巩膜瓣牢固缝合;②术中抗代谢药物应用;③可调节缝线的应用及术后激光断线等。
(一)小梁切除术手术方法
1.麻醉 全身麻醉适用于儿童,局麻含球后阻滞麻醉、球周麻醉、球筋膜下麻醉。球后麻醉有球后出血的可能,对青光眼晚期患者有视力丧失的危险。
2.缝线固定眼球 麻醉后压迫软化眼球后,术眼上开睑器,以有齿镊沿12点结膜面伸入到达角巩膜缘后1cm左右转为垂直巩膜面,夹起上直肌,以4-0丝线于肌腹下穿牵引线备用。或者做角膜缘牵引缝线:用7-0或8-0尼龙线在角膜缘内1mm处做一板层角膜牵引缝线,进针1/2角膜厚度横行2~3mm,这对显微手术固定眼球暴露手术野较好并可避免上直肌损伤。
3.制作结膜瓣 可以选择以角膜缘或以穹窿部为基底结膜瓣。
(1)以角膜缘为基底的结膜瓣:可适用于任何青光眼的滤过手术,但手术操作比较麻烦,手术野暴露较差,手术易造成结膜瓣损伤,形成滤过泡局限而高。但如须做巩膜全厚度滤过性手术或滤过术中须用抗代谢药时必须采用以角膜缘为基底之结膜瓣。
(2)以穹窿部为基底的结膜瓣:在角膜缘上方结膜附着处沿角膜缘弧度做8~0mm切口,以穹窿部为基底的结膜瓣对手术野的暴露好,术后滤过泡形成较平坦而向上弥散。但如术中须用抗代谢药物时术后易发生伤口漏[图18-17,(1)(2)]。
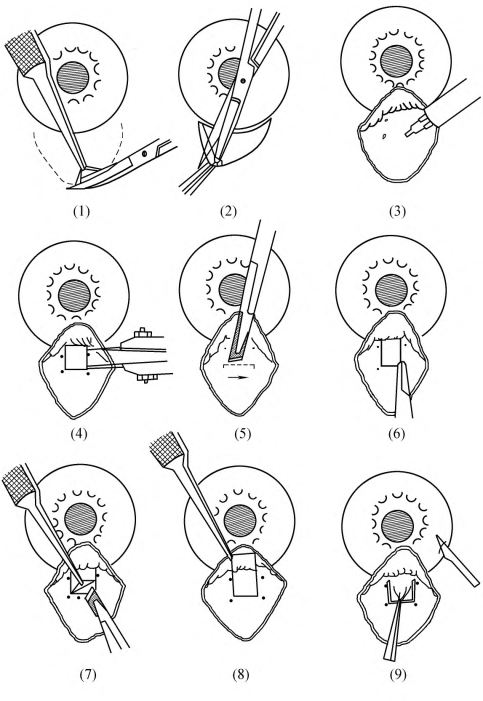
图18-17 小梁切除术(一)
4.制作巩膜瓣 可于患眼正上方或鼻上方做三角形或方形的巩膜瓣。先于拟做巩膜瓣范围内烧灼止血[图18-17,(3)(4)],后以剃须刀片沿巩膜瓣各边做深达1/2巩膜厚度的切口:以显微无齿镊夹起巩膜瓣后缘一角做板层巩膜剥离[图18-17,(5)(6)(7)(8)],要保持剥离面始终处于同一水平面,不可过深,亦不可巩膜瓣越剥越薄,甚至断裂,巩膜瓣剥离到白色巩膜带和蓝色小梁交界处前2mm,即相当于透明角膜内至少1.0mm处。用15°角的尖刀或25号针头做前房穿刺通道[图18-17,(9)]。
5.切除小梁组织 于巩膜瓣下、角巩膜交界处做小梁切口,1mm×3mm大小,前切口位于灰蓝色小梁和透明角膜交界处或透明角膜内,后切口位于小梁与巩膜交界处,小梁两侧纵切口距巩膜瓣边缘0.5~1mm。先行小梁切口前、后切口的切穿,让房水缓慢渗出,并保持足够的前房深度,再切穿一侧纵行切口,完整提起小梁组织瓣,切除小梁组织[图18-18,(10)(11)(12)]。如虹膜有脱出,可轻压虹膜恢复或虹膜做一小切口,放出少许房水后整复虹膜。
6.虹膜周边切除 先将虹膜恢复原位,同时观察瞳孔变化,注意瞳孔缘位置,一般瞳孔上移1/2左右,虹膜根部行虹膜周边切除,周边虹膜切除的范围不宜过小,宽度至少应有2mm[图18-18,(13)(14)]。
7.巩膜瓣缝合 巩膜瓣复位后,以10-0尼龙缝线缝合。如巩膜瓣为方形或梯形在其上方二角各缝1针,如为三角形瓣则在其尖端缝合1针,二腰各缝1针或不缝,这要根据巩膜瓣的厚度和内口的大小来决定。有做调整缝线再拆线者,也有紧密缝合巩膜瓣术后根据需要做激光断线者,这要根据病程和术者的经验和条件来决定[图18-18,(15)(16)]。
8.结膜瓣缝合 ①以穹窿为基底的结膜瓣:在结膜瓣两侧各缝合1针。在缝合时要带少许浅层巩膜组织以免结膜退缩;②以角膜缘为基底的结膜瓣:缝合时要展平结膜和筋膜,用10-0缝线连续、分层缝合球筋膜及结膜层、也可筋膜结膜1次缝合[图18-18,(17)(18)]。
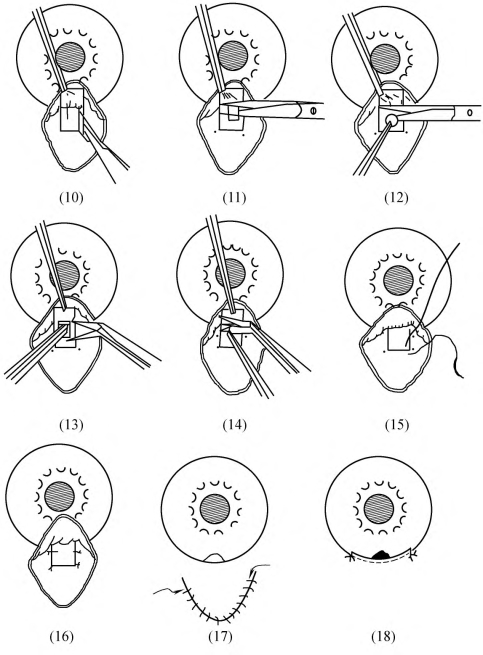
图18-18 小梁切除术(二)
9.结膜下注射庆大霉素2万U、氟美松2.5mg,用抗生素眼膏及后马托品眼膏涂在结膜囊,盖术眼。
(二)可调整缝线方法使用
1.激光缝线松解术 对眼球筋膜较厚眼应做部分筋膜剪除,以便术后易发现缝线。对于三角形或方形巩膜瓣均应注意后缘及后角要缝合牢固,到术后4d至2周内前房恢复到术前深度,滤过泡平坦,眼压≥2.3kPa(17.3mmHg)时,可行激光断线术,使用激光参数为:光斑大小50~100μm,时间0.1s,功率0.4~0.8W。激光断线方法:先在球结膜囊内上新福林眼药水1滴,使结膜血管收缩,以激光镜放在巩膜瓣缝线区域加压1~2min,找到缝线后调整聚焦于结膜后,稍向前推即可发射激光。线一旦断开即为有效,若断端不分开,可另找一缝线切断,原则上首次切断1根缝线为宜。如一次断线滤过仍不足,1~2d后可再行第2次激光断线。
2.巩膜瓣可调整缝线应用 小梁切除术中回复巩膜瓣后,采用10-0尼龙缝线相对牢固间断缝合。方形巩膜瓣两侧角或中央处做2~3针较少张力的固定缝合,三角形巩膜的顶端则做1针类似固定缝合。缝线隧道跨度要大(术后容易窥见并可做激光断线),线结埋藏于巩膜组织内。其后在巩膜瓣两侧切口边缘作1对张力较大的外露可拆除缝线。这种可拆除缝线的具体手术方法如下:
将带10-0尼龙线的缝针自角膜缘结膜附着处前方1.0mm处穿入透明角膜板层内,约于1/2角巩膜厚度水平潜行越过角膜缘和巩膜组织,并自巩膜瓣一侧的放射状切口旁的巩膜处出针,接着缝针由巩膜瓣向外水平穿过放射状切口外边缘0.5~1mm处,最后将缝针从角膜缘后方巩膜处进针,约于1/2角巩膜厚度水平潜行越过角膜缘,并在结膜附着处前方1.0mm透明角膜处出针,与原进针口距1~1.5mm。以相同的方法在巩膜瓣的另一侧安置可拆除缝线。最后在周边透明角膜表面上收紧缝线并打活结。
另外尚有Shin法、Hsu和Yarng法、JohnSconl法等调整缝线法,但主要是活结的位置和外露线端处理方法上的差异。
(三)抗代谢药的应用
任何外伤、手术均有伤口的愈合过程,而抗青光眼滤过手术希望术后留有一功能性滤过泡,则要求术后巩膜瓣不与巩膜床粘连愈合,结膜瓣不与巩膜表层粘连。为了达到此目的,对于难治性青光眼(包括新生血管性青光眼)术中或术后早期可应用抗代谢药物。目前临床上广泛应用的抗代谢药物有氟尿嘧啶(5-Fluorouracil,5-FU)和丝裂霉素(Mitomycin,MMC)。
1.氟尿嘧啶作为叶酸拮抗药,它的作用机制是通过非竞争性酶抑制作用,阻止叶酸还原为四氢叶酸,从而抑制了DNA和RNA的生物合成,最终导致细胞死亡。氟尿嘧啶提高并维持滤过泡的主要机制就是抑制成纤维细胞的增殖。已有大量文献报道,氟尿嘧啶在不同人种患者的应用中证实了能提高小梁切除术的成功率。
临床上的使用方法包括术后和术中应用氟尿嘧啶:在滤过术结束时及术后2周内连续多次在结膜下注射。一般浓度为50mg/ml,或稀释到10mg/ml,每次注射5mg,术后1周每日2次,术后第2周每日1次,总量105mg。每次注射完毕,用棉签压住注射针孔处,迅速抽出注射针头,以防药液外漏,并用生理盐水和抗生素眼液冲洗,清除可能残留在结膜囊内的氟尿嘧啶,以免毒性作用。术中氟尿嘧啶(单次剂量)的应用:取修剪成(4~6mm)×2mm× 1mm大小的消毒手术海绵块,或取一小束消毒棉花搓成宽2mm、厚1mm的小棉卷将其修剪成4~6mm长,然后把它浸浴在25~50mg/ml氟尿嘧啶中,把浸泡过氟尿嘧啶药物的海绵或棉卷置于:①结膜瓣下方;②板层巩膜瓣下;③结膜瓣下或巩膜瓣下。随后让结膜瓣复位并覆盖海绵或棉卷3~5min,注意结膜瓣边缘应避免与海绵或棉卷接触,再次掀起结膜瓣并移去海绵或棉卷,以50~200ml平衡盐溶液大量反复冲洗滤过区域、结膜下、角膜或结膜面的残留药液。
D Yorston等观察小梁切除术中应用氟尿嘧啶的68只开角型青光眼的随机对照试验发现,将浸有氟尿嘧啶的棉片(25mg/ml)置于结膜与巩膜间5min,对照组用生理盐水棉片,随访2年后,氟尿嘧啶组眼压控制率88.6%,对照组70.6%,故认为术中应用氟尿嘧啶可提高小梁切除术的手术成功率。新的用药方法如氟尿嘧啶酯质体应用尚处于动物实验研究中。
氟尿嘧啶在提高手术成功率的同时,其并发症也不容忽视:如结膜和角膜上皮缺损、角膜水肿、前房不形成、脉络膜出血、滤过泡渗漏、滤过泡相关性眼内感染等并发症,对视力有一定影响。有报道认为:应用氟尿嘧啶的最好时机是术后7d之后,7d之内应用会出现前房反应较重等并发症。
2.丝裂霉素是由头状链霉菌分离出的一种抗肿瘤抗生素,作用机制是与DNA分子的双螺旋形成交联,破坏DNA的结构和功能,抑制增殖细胞DNA的复制,对增殖各期的细胞均有抑制和杀伤作用。
丝裂霉素临床上采用术中一次用药,将浸有丝裂霉素的海绵片置于巩膜外、结膜/Tenon囊之间数分钟,被认为可以有效控制术后眼压。临床上使用的浓度是0.2~0.5mg/ml,暴露时间1~5min,具体情况取决于临床和手术类型。在大多数存在高危因素病例,一般用0.3mg/ml,暴露3min。通常情况下,对于术后潜在低眼压的病例,可以降低使用浓度和时间。Sander等实验研究结果显示:在小梁切除术中应用0.2、0.4mg/ml丝裂霉素手术失败率无差别,而发生脉络膜脱离、术后低眼压,以后者为高。Kim等在另一个实验中发现,术中用丝裂霉素0.5mg/ml,接触时间为0.5~1min和3~5min,12个月后结果显示:0.5~1min组手术成功率最高,3~5min组手术成功率最低。Mietz于小梁切除术后1、2、3d后用0.05mg/ml和0.2mg/ml的丝裂霉素置于滤过泡的表面,一年后随访结果显示:两种浓度控制眼压水平相当,而0.05 mg/ml组发生术后低眼压、视力丧失的概率较低。因此,丝裂霉素的最佳给药浓度和时间尚无定论。
目前应用于青光眼手术中所有抗代谢药中,丝裂霉素的临床效果最为肯定,但并发症也不少见。如低眼压、角膜上皮毒性、滤过泡苍白和渗漏、晚期眼内炎。Shin研究报道,黏弹剂可降低丝裂霉素对角膜内皮细胞的损伤而不加重并发症。由于丝裂霉素具有强大毒性反应,故术中应用丝裂霉素应注意:浓度配置要适宜,丝裂霉素棉片避免与结膜瓣切口和角膜上皮接触;放置棉片应在切小梁之前,以免丝裂霉素渗漏入前房,引起角膜内皮、晶状体及视网膜毒性;去除棉片后应用大量的生理盐水冲洗,以清除残遗的丝裂霉素对组织的毒性。
(四)术中、术后可能发生的并发症及处理
1.术中并发症及处理
(1)有关麻醉的并发症主要有球后出血、眼球突出、眼睑紧张、眼睑淤血、球结膜下出血等。预防及处理:球后注射在推注麻药前应先回抽,观察有无回血,可避免麻醉药直接注入血管,也可极早发现有无血管损伤,拔针时须轻压眼球,如出血量不大且不再继续出血,手术可继续进行。如出血量大、眼睑紧张应暂停手术,再次手术应避免球后注射麻药。
(2)上直肌损伤:在做以角巩缘为基底结膜瓣时可能损伤部分或全部上直肌。为了避免损伤上直肌,在做结膜瓣时,术者和助手应将结膜与筋膜一起夹住,剪开一小口直达巩膜表面,然后从切口把结膜和筋膜全层夹住并向上提起,术者用剪刀一叶伸入组织下,透过结膜可见刀刃上没有其他组织时再剪。(https://www.daowen.com)
(3)结膜瓣撕裂或纽扣样裂孔形成
①预防方法:尽量钝性分离,术中使用无齿镊,分离好的结膜瓣以湿棉片保护好。
②处理方法:小裂口,尚未制作巩膜瓣,可连续缝合或褥式缝合,裂口大,最好选择距裂口适当距离处做滤过口。如已制作好巩膜瓣,小裂口直接缝合,较大裂口,可去除相应部位角膜上皮,结膜缝合于角膜面,如裂口太大则更换手术部位。
(4)结膜瓣太低:主要见于以角膜缘为基底的结膜瓣。预防及处理:①直肌牵引缝线尽量在肌腹处;②穹窿部浅窄,结膜菲薄或做上直肌吊线患者不合作,宁做以穹窿部为基底的结膜瓣;③结膜下注射麻药不宜太多,以免影响切口位置选择。
(5)出血:对于长期应用抗青光眼药物的患者,术中浅层巩膜血管易出血,术中应轻柔冲洗及局部必要的电凝烧灼充分止血,对于来自虹膜、睫状体、脉络膜的出血,则不易止血。
①前房积血。处理:术前控制活动性炎症;术中动作尽量轻巧;正确选择角膜缘切口位置;前房切开前要止血充分。少许出血可用肾上腺素棉片或压迫止血,前房少许积血可自行吸收,出血量多,可于前房内注入消毒气泡或黏弹剂,亦可用组织型纤溶酶原激活剂(t-PA)行前房冲洗。
②暴发性脉络膜上腔出血。具有极大的破坏性,发生率约为0.73%,多由于眼压突然下降后造成的脉络膜较大血管破裂出血所致。处理:一旦发生预后不佳,重要的是术者能及时识别当机立断采取有效措施,即刻行后巩膜切开,放出脉络膜上腔血液,同时牢固缝合关闭切口,于眼前段注入Helon或加压注入平衡盐溶液,有助于视网膜复位,并促使脉络膜上腔积血排出。
(6)脉络膜渗漏:临床表现与暴发性脉络膜出血类似,不过后巩膜切开引流出来的是液体而非血块及出血,这种渗漏液含少许蛋白,是由于压力差致小分子蛋白从脉络膜毛细血管进入血管外间隙所致。处理同脉络膜上腔出血。
(7)恶性青光眼:临床表现为术中突然出现高眼压体征,但眼内不会出现团状隆起。预防处理:①术前充分降眼压;②术中放出房水要缓慢并尽量保存前房;③虹膜切除口要足够宽;④巩膜瓣要密闭缝合;⑤前房穿刺以气泡、生理盐水、黏弹剂等重建前房;⑥于睫状体扁平部做后巩膜切开放少许玻璃体后重建前房;⑦阿托品散瞳,双眼加压包扎,口服乙酰唑胺(醋氮酰胺)、静脉滴注甘露醇,全身使用皮质类固醇等。
(8)玻璃体脱出:原因主要有巩膜切口位置偏后、手术操作粗暴、不适当地对切口后唇加压、外伤性晶体脱位、先天性青光眼、高度近视、对侧眼行青光眼手术时有玻璃体脱出、无晶体眼等。处理:如手术中玻璃体脱出,须将玻璃体切除。切口处不能残留玻璃体、前房内注入黏弹剂或消毒空气。
(9)其他罕见的并发症:①晶状体损伤和不全脱位;②后弹力膜撕裂;③暂时性失明:球后注射后短暂失明,多见于小视野的青光眼(晚期)、球后出血或精神紧张患者。
原因:麻药中含肾上腺素致视网膜中央动脉痉挛;麻醉药阻断视觉神经纤维传导;球后注射过深、过快或球后出血。
处理:立即停止手术、吸氧、舌下含服硝酸甘油片,肌内注射B族维生素、三磷腺苷(ATP)等,多数在20~40min后恢复光感,术后第1天基本恢复视力。
2.术后早期并发症及处理 术后早期最常见的并发症是浅前房、无前房及滤过泡失败。
浅前房原因:①滤过过强;②脉络膜脱离;③房水生成减少(低分泌);④瞳孔阻滞;⑤虹膜-晶状体隔前移(包括恶性青光眼)。
浅前房分为Ⅰ~Ⅲ级。当Ⅱ级向Ⅲ级发展或出现Ⅲ级浅前房时应立即手术以恢复前房。浅前房分为低眼压性浅前房和高眼压性浅前房两种。
(1)低眼压性浅前房。常见原因有:
①结膜切口渗漏,多由于结膜损伤或组织愈合不良所致。处理方法:小的结膜裂孔或估计难以缝合的结膜缺损(如纸样菲薄的结膜)可局部应用地塞米松、噻吗洛尔(噻吗心安)等药物及阿托品眼液,注意阿托品仅用于扁平前房或虹膜周切口足够大的患者。对应于滤过区的眼睑上置一起压迫作用的棉条并以绷带做适度加压包扎,此法只用于白天,单眼包扎,健眼保持平视,防止因Bell现象压迫角膜促进房水排空,加重浅前房,故Ⅲ级浅前房不提倡此法,绷带包扎8h后应打开检查前房情况,小的裂口通常加压24~48h多可愈合,可打开点眼药水,持续3~7d。较大结膜裂口或上述方法无效,可用Simmon巩膜罩外加压,并保持该罩突出部填压于缺损区3d左右,亦可用氰丙烯酸盐组织黏合剂或胶原盾或异体角膜覆盖漏口。
②滤过功能太强:多由于过大的瘘口,巩膜瓣薄而小或边缘对合不良,巩膜瓣缝合太松弛,过早松解或拆除巩膜瓣缝线,抗代谢药物应用不适当,手术指征和手术滤过量的判断失误,滤过过强的临床表现为低眼压、浅前房和异常高隆而弥漫的大滤过泡。处理方法:首先外加压或绷带包扎、次选Simmon巩膜罩,手术是最后选择。
③脉络膜脱离:眼压越低,脉络膜脱离发生率越高。脉络膜脱离有两种类型:一是浆液性脉络膜脱离,有特征性周边部眼底光滑球形隆起和浅棕色外貌,引流出的液体蛋白含量高(淡黄色)。二是出血性脉络脱膜脱离,与前者不同的是突然疼痛,视力下降,眼压高,眼底有中心接触的巨大暗红棕色球形隆起。大多数浆液性脉络膜脱离于手术后数天或数周,随着眼压回升而自然恢复。严重者需要经下方2个象限的扁平部后巩膜切开引流液体和重建前房。
④渗出性视网膜脱离:常自行消退。
⑤房水生成减少(低分泌):原因可能是长期低眼压,睫状体水肿或脱离的睫状体炎症,术前长期应用房水生成抑制药、眼压持续下降、前房进行性变浅、滤过泡变扁平是房水生成减少的根据,也是考虑重建前房的指征。治疗:局部用睫状肌麻痹剂,局部或全身应用皮质类固醇。
(2)高眼压性浅前房。恶性青光眼、瞳孔阻滞闭角型青光眼、迟发性脉络膜上腔出血可引起高眼压性浅前房。可根据不同原因进行相应处理。
(3)高眼压性深前房。提示滤过通道引流不畅。常见的原因有:
①瘘口内部阻塞:内口可被虹膜、睫状体血凝块、遗留的底层角膜缘组织或后弹力膜、晶状体赤道部囊膜或玻璃体等阻塞。处理:如为虹膜或睫状突组织阻塞瘘口可用低能量氩激光可使其退缩。如为非色素膜样组织阻塞,可用脉冲式Nd∶YAG激光,从内部切开重建滤过通道。如为晶体囊膜或玻璃体阻塞,可用激素、高渗剂、房水抑制剂治疗。如上述方法无效,则应药物降压,3个月后重新行滤过性手术。
②早期滤过失败。常见的原因有:内口阻塞;巩膜瓣过早愈合;结膜瓣及其下浅层巩膜瘢痕愈合和包裹性囊泡形成。
(4)其他术后早期并发症。①葡萄膜炎和迟发生前房积血:前者以散瞳、激素治疗,后者治疗采用抬高头位和限制活动;②角膜Dellen干燥斑;③小的中央视岛丧失;④后弹力膜脱离;⑤术后角膜散光,多于2个月后恢复到术前水平。
3.术后晚期并发症及处理
(1)滤过区瘢痕与手术失败:发生率为10%~30%,术后发现滤过泡逐渐限局变平时,应加强按摩,眼局部用皮质类固醇,结膜下注射氟尿嘧啶。如发现有粘连时在最初数周内用针拨滤过泡加上药物治疗可能有效。将氟尿嘧啶5mg加2%普鲁卡因,用1ml针,在距滤过泡5~8mm处刺入结膜下,注入少量溶液使结膜隆起。结膜隆起后再向前进针直到粘连的滤过泡边缘,把针尖穿入囊壁并用针侧刃划开纤维组织的囊壁,在进针时要避开结膜血管。
(2)滤过泡漏:常发生在年龄大、结膜薄或术中用抗纤维药物尤其是丝裂霉素者。处理:修复滤过泡,对囊样薄壁明显漏的滤过泡须切除整个滤过泡,分离结膜,将上方结膜移下来,并把近角膜缘处上皮刮去,将结膜瓣用10-0尼龙线间断褥式缝合在角膜缘内。如果因滤过泡周围瘢痕多,缺少结膜时,可做结膜瓣转移或自体结膜移植。
(3)化脓性眼内炎:多为致病力较强细菌引起,如革兰阴性杆菌、链球菌和葡萄球菌。处理:①立即做细菌培养;②首先使用广谱高效抗生素,后根据培养结果来选定抗生素;③排除真菌感染后,全身或局部使用激素;④玻璃体受累者,应行治疗性玻璃体切除术。
(4)低压性黄斑病变:这是应用抗代谢药物的严重并发症之一。滤过手术后眼压低于0.8kPa(6mmHg)时,可发生视力减退、黄斑水肿,脉络膜视网膜皱褶。处理:加厚或修补滤过泡。
二、房水引流物植入术
(一)概述
房水引流物植入术的基本原理:在眼前房和结膜筋膜下放置一种人工引流装置以期获得永久性的房水外引流通道。房水引流装置通常由两部分组成:引流管和引流盘(盘面积不小于135mm2),引流管引流房水到盘周围形成的纤维储液间隙,再经该间隙的纤维壁渗透到周围组织内吸收,眼压控制水平取决于纤维储液间隙大小及该间隙纤维壁对房水排出阻力大小。
手术效果和所选用的房水引流装置有密切关系,现代房水引流装置的特点有:
1.材料 现代房水引流装置所选用的材料多为医用高分子化合物,如聚丙烯、硅胶、聚甲基丙烯酸甲酯等。这类材料对眼组织刺激性小,引流盘周围炎症反应轻。
2.引流盘的位置 引流盘一般置于眼球赤道部前后。优点:①赤道后球结膜、筋膜具有很好扩张潜力,易于引流盘植入、存留,并可在引流盘周围形成一个表面积和引流盘相同的纤维性囊腔;②在赤道部后方所形成的纤维囊腔储液间隙远离前房,减少了眼前段的炎症反应;③由于该处眼球筋膜组织较厚加强了对引流盘的保护,减少了后期引流盘外露机会。
3.制作工艺 压力敏感性活瓣性开关的应用,减少了浅前房发生率,并可根据要求设计引流装置,易于控制眼压。另外的制作工艺的变化是巩膜表面外置体的形状(圆形、椭圆形、长方形等)和表面积的大小。
房水引流装置根据其有否限制房水流动的压力敏感阀单元可分为非限制性房水引流物和限制性房水引流物。非限制性房水引流物主要有Molteno、Schocket、HAD等,限制性房水引流物主要有Krupin、Whites、Ahmed等。
(二)常用房水引流装置
所有房水引流装置都是在Molteno设计房水引流装置基础上改进而来的。
1.Molteno房水引流装置(图18-19) 已成为当今世界应用最广的人工房水引流装置。经典的Molteno房水引流装置为长引流管单盘型、引流管外径0.63mm、内径0.3mm、长21mm的硅胶引流管和直径为13mm、表面积135mm2丙烯酸甲酯引流盘联结组成,引流盘为圆形凹盘,两侧各有一带孔小耳,用于缝合固定引流盘,靠巩膜面有一隆起的堤状厚檐,使引流盘与巩膜之间形成一腔隙。
Molteno房水引流装置的改良型有:①长管双盘引流装置,增加引流盘1个;②长管单盘双室引流装置,双室一大一小,房水先引流进小室、后进大室、限制房水引流速度,减少了术后浅前房发生率(图18-20)。
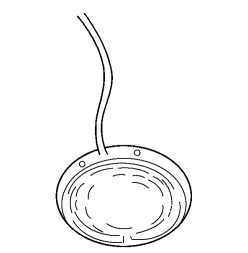
图18-19 单盘Molteno植入物
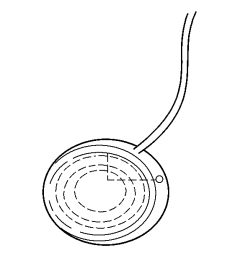
图18-20 单盘双室Molteno植入物
2.Schocket房水引流装置(图18-21) 其结构特点是将房水引流到和引流管相连接的巩膜环扎带的间隙内,以期在眼球中纬线环扎带周围形成一包裹区,房水经此向眼后部弥散而被吸收。
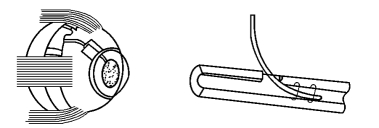
图18-21 Schocket装置
3.Whites房水分流泵(图18-22) 其特点是:①在引流管和引流盘之间增加了一个特殊的储液池,该储液池入口和出口处各有一单向的活瓣,它们在特定压力条件下[0.7~2.0kPa(5~15mmHg)]开放;②可通过瞬目、指压调整储液池前后阀门来控制眼压。
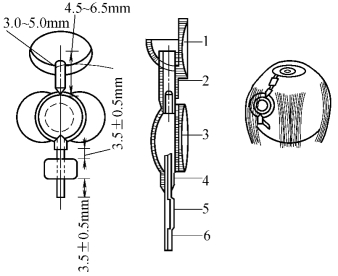
图18-22 Whites房水分流泵
4.Ahmed青光眼减压阀(图18-23) 其特点是:①该引流装置不同于Molteno房水引流装置的是引流盘前部附加了一个具有物理学缩嘴作用的房水控制室,该室出口处有一用弹性硅胶制成的压力敏感活瓣;②活瓣具有压力敏感性,眼压超过1.07~1.33kPa(8~10mmHg)时开放,房水以2~3μl速度外引流,术后浅前房发生率低。
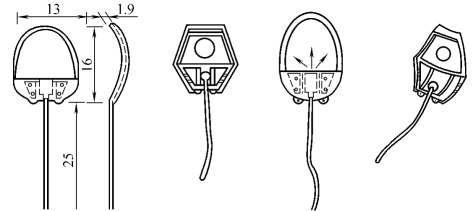
图18-23 Ahmed活瓣式引流物
5.OptiMed青光眼压力调节器(图18-24) 其特点为:①引流管前段由聚甲基丙烯酸甲酯制成,后段由硅胶制成,前者质硬易于植入前房,后者质软术中易于调整引流块位置;②与引流管相连的是引流块而非引流盘;③引流块由含180个左右微型孔道的聚甲基丙烯酸甲酯构成;④房水流经微孔时会使微孔孔径改变,从而改变房水引流阻力来控制房水引流。
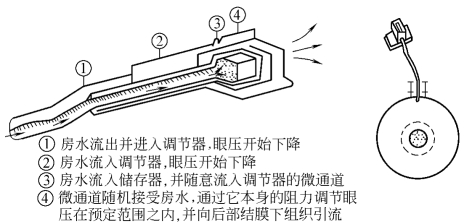
图18-24 OptiMed眼压调节器
6.Baerveldt前房引流物(图18-25) 按储液表面积的大小有多种规格。前房引流管由一条外径0.64mm、内径0.3mm的硅胶管组成。其特点是外植体呈弯曲长块状并由含钡的硅胶组成,含钡的引流盘具有独特的X线表现,可用来鉴定引流盘的位置。
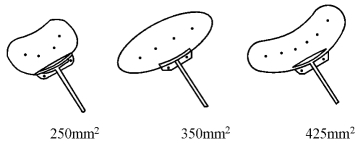
图18-25 Baerveldt房水引流物(三种规格)
7.HAD房水引流物 湖南医科大学附属第二医院眼科蒋幼芹、段宣初设计了一种房水引流装置,称HAD房水引流物(hunan aqueous drainage implant,HAD),由北京橡胶制品设计研究院协作生产(图18-26)。其特点有:①引流盘面积约180mm2,由硅胶制成,对组织刺激小,弹性好,易于安装与固定;②引流盘呈扇形,安置在2条眼外肌之间,易于操作,不影响肌肉运动,可减少复视发生;③引流盘前方的三角形“压力嵴”,将引流管末端开口围绕在约18mm2的区域内,对房水流出有一定的阻挡作用;④在引流盘两侧各有一个侧方连接孔,一旦手术失败便于再次手术连接另一个或多个引流盘,以避免再次手术时再度进入前房。
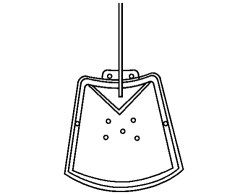
图18-26 HAD房水引流物
(三)术前准备
1.全身准备 新生血管性青光眼患者可能同时患有糖尿病、高血压等疾病,术前应注意控制好血糖、血压等。
2.眼部准备 注意原发病的治疗,如由眼底血管病变引起的新生血管性青光眼术前应尽可能行全视网膜激光光凝治疗,并对拟行引流管植入处的虹膜房角组织新生血管行氩激光光凝。
3.引流物的选择 要根据患者的病情及引流装置的特点选择合适的引流物。根据病情需要,要注意以下几点:①术后需要控制的眼压水平;②眼部条件应包括术前前房深度,可行引流物植入的位置及可利用的结膜范围;③是否同时须行视网膜复位手术或玻璃体切除手术。
4.手术部位的选择 术前根据结膜情况、前房深度以及房角是否有新生血管,考虑引流盘与引流管植入的位置。最好选择颞上象限,操作空间大,离视神经最远;其次是鼻上象限和颞下象限,尽量避开前次手术瘢痕处再手术。如前房甚浅或无前房、但后房深者,亦可将引流管置入后房。
(四)手术方法
不同的房水引流物有不同的手术方法,现以Baerveldt引流物为例介绍手术方法(图18-27)。
1.麻醉 成人用局部麻醉,小儿则应采取基础麻醉。
2.球结膜切口及结膜瓣制作 在可选择的条件下最好取颞上象限或颞下象限,植入区一定要位于两条相邻的直肌之间。结膜切口类型取决于手术医师的习惯和球结膜瘢痕的位置,可选择以穹窿部为基底或以角巩膜缘为基底的结膜瓣。
3.巩膜暴露 于结膜、筋膜下沿巩膜面分离到角膜缘后20mm处,分离暴露直肌,肌腹下4-0丝线牵引固定,暴露手术野。
4.前房引流物的外植体植入与固定 于分离好的筋膜下间隙,使引流盘前缘距角膜缘后9~10mm,用8-0丝线穿过引流盘两侧固定孔及浅层巩膜并打结固定于浅层巩膜面。
5.前房引流管的植入 ①于引流管对应的角膜缘后,做一4mm×4mm或4mm×6mm大小、1/2巩膜厚度且长轴与引流管平行的巩膜瓣;②23号注射针头沿虹膜平行平面前房穿刺;③修剪引流管,将引流管前端摆放在角膜表面,从角膜缘测量确定引流管植入前房内所需的长度,通常在角膜缘内2~3mm处用直的组织剪将引流管斜行(呈45°角)剪断,斜面朝上,入前房2~3mm,如术中出现浅前房或前房消失,则应用黏弹剂或生理盐水加深前房后植入,不可碰触角膜内皮,管口不能为虹膜、血凝块及玻璃体阻塞;④植入引流管后以9-0尼龙线间断缝合巩膜瓣4-6针,巩膜瓣后的引流管以6-0可吸收缝线间断缝合于浅层巩膜面;⑤结膜切口缝合,5-0~8-0可吸收缝线间断缝合结膜切口4针左右;⑥远离手术部位结膜下注射庆大霉素及地塞米松,包扎术眼。
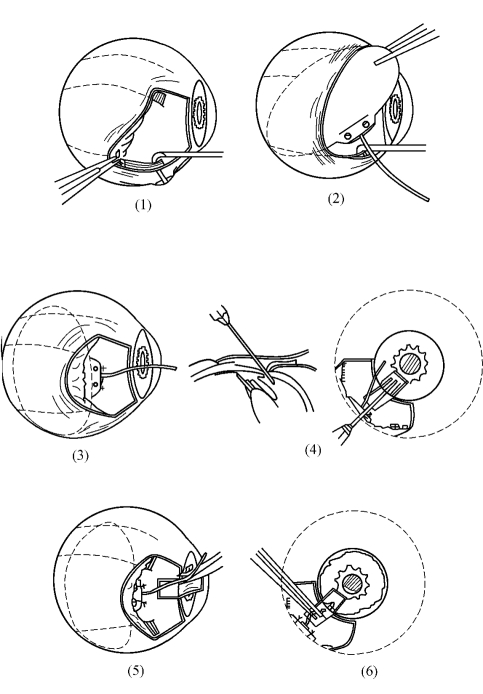
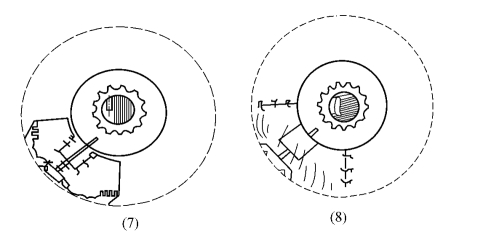
图18-27 现代房水引流物植入方法(Baerveldt)
①结膜瓣制作与巩膜暴露;②③房水引流物的外植体植入和固定;④角膜缘切口及巩膜瓣制作;⑤⑥房水引流管的准备和植入;⑦⑧巩膜瓣和结膜瓣的缝合
(五)房水引流物植入手术要点
(1)术中必须对引流装置进行灌注冲洗、排气,检验管道是否通畅,确保有活瓣的引流装置的活瓣开放。
(2)术中所做前房穿刺口大小要合适,最好和应用的引流管外径一致,如穿刺部位稍后或长度稍长时,穿刺针要稍大于引流管。
(3)引流管植入过程中一定要保证植入口周围密闭,如有渗漏则应修补至水密状态。
(4)引流管植入过程中要保持前房有一定深度。
(5)术中最好做一前房穿刺口,便于术毕形成前房,手术结束时要确保前房已形成。
(6)术中要尽量保护引流盘周围组织,减少不必要操作,防止引流盘周围过度瘢痕化,如估计术后有瘢痕化倾向的病例,术中应使用抗代谢药物。
(六)房水引流物植入术的并发症及处理
各类房水引流物植入术的术中及术后并发症基本相似,据报道术后并发症的发生率为50%~70%,多数是与滤过性手术所共有的,另一些是和植入管直接有关的特殊并发症。在行房水引流物植入术的患眼中,并发症之所以较多见和较严重,原因在于这些眼所患青光眼的难治性、复杂性和严重性而不是由于引流物本身所致。
1.术中并发症 ①固定植入物及剥离巩膜瓣时,特别是在已行过数次手术的眼球上再次手术,其巩膜变薄,表面不规则,有可能发生眼球壁穿孔及脉络膜组织暴露;②做角膜缘区穿刺或引流管植入偏后,可能出现前房出血、睫状体出血和玻璃体脱出。如针道与虹膜面不平行,植入的引流管可能弯曲,与角膜内皮、虹膜或晶状体接触。
2.术后并发症及预防与处理
(1)术后早期低眼压:术后立即大量房水从管腔和角膜缘周围流出或存在过大的赤道部区的潜在间隙。预防:①采用Molteno管二期植入方法或单盘双室型Molteno管;②采用具有活瓣机制的植入管和压力调节阀;③限制潜在间隙的面积大小;④暂时性关闭引流管腔,可用缝线结扎或缝线填塞,保留线头备后期拆除;⑤术毕用平衡盐液或黏弹性物质重建前房。
(2)术后眼压升高
①短暂性眼压升高:为可逆性,发生于术后4~6周,可能与房水激惹滤过泡的炎症反应有关,用缩瞳剂可加重症状。
②管腔内阻塞:虹膜炎症碎屑、血块、纤维素、玻璃体、硅油等均可阻塞。处理:Nd∶YAG激光清除上述组织;27号针头穿刺冲管;必要时做前段玻璃体切除。房水分流受阻也可发生在远离前房的管腔处,即位于管的环带或盘的交接处或其邻近处,通常于术后2周左右行管壁纵行小切口,用水清除管腔内破裂的可吸收缝线。
③管外受压:常见于外结扎缝线激光断线或拆除失败时,由于管外巩膜的压迫和环带下深部瘢痕组织压迫所致。
④后期滤过泡瘢痕化:发生于术后数周,术中应用抗代谢药物或使用具有肝素结合的聚合物材料制成的环带或盘可减轻滤过泡的瘢痕化。
(3)其他并发症:①硅胶管退缩或退出前房,或硅胶管进入前房过深;②分流管或硅胶管外露或脱出;③硅胶管触及晶体或角膜内皮,前者可引起白内障,后者多致角膜局部水肿或移植片功能失代偿;④眼外肌功能失调:多见于植入面积过大的引流装置或它的位置延伸范围超过1~2象限(在肌腹下或跨过肌腹),常见有:斜视,眼球运动受限,复视。下斜视常见于上象限位置植入引流装置。上斜视常见于在下象限或颞上象限植入引流装置。
三、睫状体破坏性手术
睫状体破坏性手术的手术方式主要包括:睫状体冷冻术、全视网膜冷凝术联合睫状体冷冻术、二极管睫状体光凝术。本手术疗效确切,操作方便、但这种组织的破坏有并发症,甚至严重的并发症,必须根据病程严格控制冷冻或激光的时间及范围。当一次不能有效控制眼压时,可反复多次实施冷冻或激光手术。
(一)睫状体冷冻术
原理:通过人工制冷产生的低温效果,间接破坏睫状体上皮及它的血管系统,以减少房水生成,从而降低眼内压。
低温主要通过电解质浓缩毒性作用或细胞内冰晶形成,造成睫状体上皮损伤。
1.术前准备
(1)用药:术前3d局部应用皮质类固醇及前列腺素抑制剂,术前4h、30min分别以阿司匹林0.5g口服,如眼压高,术前多用甘露醇静脉滴注。
(2)麻醉:多采用球后麻醉或球周麻醉。
(3)制冷器械:常用二氧化碳、液氮冷冻器,要求制冷温度必须低于-80℃.
(4)术前要先试机,术中有条件多用前房角镜观察冷冻效果。
2.手术方法
(1)开睑器开睑,暴露冷冻部位。
(2)冷冻头应准确定位于睫状体的睫状突处,故于上方象限内冷冻时,冷冻头前缘距角膜缘1.5mm,其余象限则距角膜缘1mm。
(3)冷冻时要吸干结膜表面液体,定位后把冷冻头紧压在球结膜上,做适当加压,放置冷冻头后20~30s后开始计时,要求冷冻温度-80℃。时间40~60s,或等冷冻头周围结膜、巩膜发白形成1个3~4mm冻结区时开始计时,时间到后自然复温分离。
(4)冷冻范围不超过2个象限,每个象限做2~4个冷冻点,一次手术效果不佳可再冷冻,但总冷冻范围不能超过300°。
此外,也可选择以下方法进行冷冻:在充分麻醉以后,将冷冻头放在12点角膜缘后3mm处,脚踩踏板开始冷冻,同时观察冰球的形成,大约45s后第1个冰球可以达到最大尺寸,当冰球达到最大尺寸或者冷冻范围已扩展至角膜缘时,即可停止冷冻,如果冷冻头靠角膜太近,冰球逐渐变大,此时应在冰球到达角膜缘前停止冷冻,需要将冷冻头放置在离角膜缘稍远的地方开始冷冻,整个冷冻时间通常在45~60s。冷冻在8个部位进行,第一个部位在12点,其他分别在3、6、9、1:30、4:30、7:30、10:30处按顺序进行,每一个冷冻点的时间应大致相同,用上述方法所形成的冰球一般足以冷冻角膜后全周,各个冷冻点之间约有2mm的区域不被累及。
(5)操作要点:①冷冻头要自然复温分离;②冷冻头加压应指向眼球中心方向;③冷冻真正有效位置是冰球下方中央处;④多点冷冻后可使眼压下降,眼球变软,此时应用棉签压迫另一侧,使冷冻区巩膜膨隆,有利于提高冷冻效果;⑤室内温度过高会影响冷冻效果;⑥术中尽量避免眼表面滴水,会影响效果。
(6)再次手术的问题:再次手术时间应在第1次手术后1个月后进行,总范围不能超过300°以免引起眼球萎缩。
3.手术并发症及处理
(1)一过性眼压升高:可能与低温导致巩膜急骤收缩及眼内容积突然减少有关,冷冻后引起眼内组织水肿、术后眼内渗出等也可引起术后一过性眼压增高。
预防:术前降低眼压、球后麻醉充分、各冷冻点间隔时间延长可减少并发症。
治疗:术后眼压高多发生于术后6h,术后应常规应用降眼压药物。
(2)葡萄膜炎:前房内纤维素渗出,甚至呈团块状,可使用激素和睫状肌麻痹剂。
(3)疼痛:常与眼压一过性增高及葡萄膜炎有关,一般24h后可好转。
(4)眼内出血:此类患者眼内条件均较差,多有一些不健康的新生血管,往往在冷冻时就发生前房出血,严重者玻璃体也可能出血。如发生眼内出血,按常规处理。
(5)低眼压及眼球萎缩:此为最严重的并发症。过度冷冻后所造成的睫状体损伤,可引起持续性的低眼压,其可导致进行性白内障、视网膜脱离、黄斑水肿等。最终导致眼球萎缩。所以在手术中要尽量避免对睫状体的过度冷冻。
睫状体冷冻治疗新生血管性青光眼的成功率较其他类型的青光眼要低,而并发症的发生率相对较高。但是术者和患者都应该清楚,此类青光眼的治疗成功率仅为50%,因此还是应该鼓励医师对此类青光眼进行积极的治疗。
(二)全视网膜冷凝联合睫状体冷冻手术
新生血管性青光眼的发生率,在增殖性糖尿病性视网膜病变者中占5%~8%,在视网膜中央静脉阻塞者中占20%,特别是在缺血性视网膜中央静脉阻塞者中甚至高达60%。此类青光眼的高眼压非常顽固,治疗效果很差。
近年来的研究表明:全视网膜冷凝可以使视网膜和虹膜的新生血管消退,而睫状体冷冻术可以破坏睫状体的上皮细胞,减少房水分泌,降低眼压。
手术方法:①常用球后麻醉,置开睑器;②结膜瓣:沿角巩膜缘剪开球结膜,尽量分离至赤道部;③视网膜冷凝:冷凝视网膜360°范围,角膜缘后分别7mm、10mm、13mm,经巩膜做3排各12、16、20个冷凝点,冷凝温度为-60~-80℃,每点冷凝3~5s,如果能用间接眼底镜直视下看到眼底时,冷冻程度以视网膜变白为准;④睫状体冷冻:同睫状体冷冻术。
四、激光睫状体光凝术
见第17章新生血管性眼病的激光治疗。
(朱益华 郑学栋 韩晓丽)
参考文献
1 Ashok S,Amit G,Jagat R,et al.Low-dose intraoperative mitomycin-c versus conjunctival autograft in primary pterygium surgery:long term follow-up.Ophthalmic surgery and laser,2000,31:301—307
2 张承芬.眼底病学.北京:人民卫生出版社,1998:191—217,223—257,269—277
3 黄叔仁,张晓峰.眼底病诊断与治疗.北京:人民卫生出版社,2003:84—94,99—102,249—257
4 李凤鸣.眼科全书.北京:人民卫生出版社,1996:2227—2237,2242— 2244,2321—2319
5 Opremcak EM.Radial optic neurotomy for central retinal vein occlusion.Retina,2001,21:408
6 许卓再.动静脉鞘膜切开术治疗视网膜分支静脉阻塞.国外医学·眼科学分册,2004,28(6):401—403
7Mester U,Dillinger P.Vitrectomy with arteriovenous decompression and internal limiting membrane dissection in branch retinal vein occlusion.Retina,2002,22:740—746
8 惠延年.放射状视神经切开术治疗中央静脉阻塞及争议.中华眼底病杂志,2005,1:1—2
9 Higuchi A,Yamada H,Kawai E,et al.Vitrectomy for proliferative diabetic retinopathy.Nippon Ganka Gakkai Zasshi,2005,109:134—141
10 Recchia FM,Ruby AJ,Carvalho Recchia CA.Pars plana vitrectomy with removal of the internal limiting membrane in the treatment of persistent diabetic macular edema.Am J Ophthalmol,2005,139:447—454
11 Zacks DN,Johnson MW.Combined intravitreal injection of triamcinolone acetonide and panretinal photocoagulation for concomitant diabetic macular edema and proliferative diabetic retinopathy.Retina,2005,25:135—140
12 Parolini B,Panozzo G,Gusson E,et al.Diode laser,vitrectomy and intravitreal triamcinolone.A comparative study for the treatment of diffuse non tractional diabetic macular edema.Semin Ophthalmol,2004,19:1—12
13 Jahn CE,Topfner von Schutz K,Richter J,et al.Improvement of visual acuity in eyes with diabetic macular edema after treatment with pars plana vitrectomy.Ophthalmologica,2004,218:378—384
14 Bandello F,Brancato R,Menchini U,et al.Light panretinal photocoagulation(LPRP)versus classic panretinal photocoagulation(CPRP)in proliferative diabetic retinopathy.Semin Ophthalmol,2001,16:12—18
15 Hubbard GB 3rd,Cherwick DH,Burian G.Lens-sparing vitrectomy for stage 4retinopathy of prematurity.Ophthalmology,2004,111: 2274—2277
16 Prenner JL,Capone A Jr,Trese MT.Visual outcomes after lens-sparing vitrectomy for stage 4Aretinopathy of prematurity.Ophthalmology,2004,111:2271—2273
17 Hartnett ME,Maguluri S,Thompson HW,et al.Comparison of retinal outcomes after scleral buckle or lens-sparing vitrectomy for stage 4 retinopathy of prematurity.Retina,2004,24:753—757
18 Al-Ghamdi A,Albiani DA,Hodge WG,et al.Myopia and astigmatism in retinopathy of prematurity after treatment with cryotherapy or laser photocoagulation.Can J Ophthalmol,2004,39:521—525
19 Azad RV,Pasumala L,Kumar H,et al.Prospective randomized evaluation of diode-laser and cryotherapy in prethreshold retinopathy of prematurity.Clin Experiment Ophthalmol,2004,32:251—254
20 Prost ME.Results of treatment of retinal detachment in active stage-5 retinopathy of prematurity.Klin Oczna,2003,105:387—391
21 Tufail A,Singh AJ,Haynes RJ,et al.Late onset vitreoretinal complications of regressed retinopathy of prematurity.Br J Ophthalmol,2004,88:243—246
22 Yamamoto S,Takatsuna Y,Sato E,et al.Central retinal artery occlusion after radial optic neurotomy in a patient with central retinal vein occlusion.Am J Ophthalmol,2005,139:206—207
23 Mirshahi A,Roohipoor R,Lashay A,et al.Surgical induction of chorioretinal venous anastomosis in ischaemic central retinal vein occlusion:a non-randomised controlled clinical trial.Br J Ophthalmol,2005,89:64—69
24 Patelli F,Radice P,Zumbo G,et al.Optical coherence tomography evaluation of macular edema after radial optic neurotomy in patients affected by central retinal vein occlusion.Semin Ophthalmol,2004,19:21—24
25 Nomoto H,Shiraga F,Yamaji H,et al.Evaluation of radial optic neurotomy for central retinal vein occlusion by indocyanine green videoan-giography and image analysis.Am J Ophthalmol,2004,138:612—619
26 Lerche RC,Richard G.Arteriovenous sheathotomy in venous thrombosis.Klin Monatsbl Augenheilkd,2004,221:479—484
27 Mandelcorn MS,Nrusimhadevara RK.Internal limiting membrane peeling for decompression of macular edema in retinal vein occlusion:a report of 14cases.Retina,2004,24:348—355
28 Rumelt S,Karatas M,Pikkel J,et al.Optic disc traction syndrome associated with central retinal vein occlusion.Arch Ophthalmol,2003,121:1093—1097
29 Koizumi K,Nishiura M,Yamamoto T,et al.Intentional complete interruption of a retinal vein after vitrectomy might improve the rate of successful chorioretinal venous anastomosis formation in central retinal vein occlusion.Graefes Arch Clin Exp Ophthalmol,2002,240:787—794 30 Williamson TH,Poon W,Whitefield L.A pilot study of pars plana vitrectomy,intraocular gas,and radial neurotomy in ischaemic central retinal vein occlusion.British Journal of Ophthalmology,2003,87:1126—1129
31 Childs AL,Bressler NM,Bass EB,et al.Surgery for hemorrhagic choroidal neovascular lesions of age-related macular degeneration:quality-of-life findings:SST report no.14.Ophthalmology,2004,111:2007—2014
32 Bindewald A,Roth F,Van Meurs J,et al.Transplantation of retinal pigment pithelium(RPE)following CNV removal in patients with AMD.Techniques,results,outlook.Ophthalmologe,2004,101:886—894
33 van Meurs JC,Van Den Biesen PR.Autologous retinal pigment epithelium and choroid translocation in patients with exudative age-related macular degeneration:short-term follow-up.Am J Ophthalmol,2003,136:688—695
34 Ichibe M,Yoshizawa T,Funaki S,et al.Severe hypotony after macular translocation surgery with 360-degree retinotomy.Am J Ophthalmol,2002,134:139—141
35 Tsukahara I,Ninomiya S,Castellarin A,et al.Early attachment of uncultured retinal pigment epithelium from aged donors onto Bruch’s membrane explants.Exp Eye Res,2002,74:255—266
36 Corey RP,Scott IU,Flynn HW Jr,et al.Surgical removal of submacular choroidal neovascularization:a clinicopathologic study and factors influencing visual outcomes.Ophthalmic Surg Lasers,2001,32:406—418
37 Meurs JC,Averst E,Hofland LJ,et al.Autologous peripheral retinal pigment epithelium translocation in patients with subfoveal neovascular membranes.Br J Ophthalmol,2004,88:110—113
38 Hiroko T,Yozo M,Toshimitsu S,et al.Change in full-field ERGs after macular translocation surgery with 360°retinotomy.Investigative Ophthalmology and Visual Science,2002,43:452—457
39 Abdel-Meguid A,Lappas A,Hartmann K,et al.One year follow up of macular translocation with 360degree retinotomy in patients with age related macular degeneration.Br J Ophthalmol,2003,87:615—621
40 史伟云,谢立信,高危角膜移植,眼科新进展,1999,12(1):1—4
41 孙秉基,贺 燚.现代角膜移植及角膜激光手术.天津:天津科学技术出版社,2000:101—107
42 Davis-Lemessy PA,Parrish RK II.Antimetabolites for trabeculectomy:5-FU and tomycin C.In:Principles and Practice of Ophthalmology.2nd ed.Albert DM,Jakobiec FA,eds.Philadelphia,PA:W.B.Saunders,2000:354—357
43 Uchida S,Suzuki Y,Araie M,et al.Long-term follow-up of initial 5-fluorouracil trabeculectomy in primary open-angle glaucoma in Japanese patients.J Glaucoma,2001,10:458—465
44 Mielke C,Dawda VK,Anand N.Intraoperative 5-fluorouracil application during primary trabeculectomy in Nigeria:a comparative study.Eye,2003,17(7):829—834
45 Merriman MB,Mora JS,Beaumont BW,et al.Effects of varying 5-fluorouracil exposure duration on tenon’s capsule fibroblasts.Clin Experi-ment Ophthalmol,2001,29(4):248—252
46 苏玉英,等.小梁切除术中应用丝裂霉素加可调整缝线.国际眼科杂志,2003,(3)9
47 You YA,Gu YS,Fang CT,et al.Long-term effects of simultaneous subconjunctival and subscleral mitomycin C application in repeat trabeculectomy.J Glaucoma,2002,11:110—118
48 El Sayyad F,Belmekki M,Helal M,et al.Simultaneous subconjunctival and subscleral mitomycin-C application in trabeculectomy.Ophthalmology,2000,107:298—301
49 Wilkins MR,Occleston NL,Kotecha A,et al.Sponge delivery variables and tissue levels of 5-fluorouracil.Br J Ophthalmol,2000,84:92—97
50 Mietz H,Jacobi PC,Krieglstein GK.Intraoperative episcleral versus postoperative topical application of mitomycin-C for trabeculectomies.Ophthalmology,2002,109:1343—1349
51 Shin DB,Lee SB,Kim CS.Effects of viscoelastic material on the corneal endothelial cells in trabeculectomy with adjunctive mitomycin-C.Korean J Ophthalmol,2003,17(2):83—90
52 陈建国.丝裂霉素辅助小梁切除术并发症分析.临床眼科杂志 ,2001,(5)9
53 李绍珍.眼科手术学.第2版.北京:人民卫生出版社,1997:460—551
54 周文炳.临床青光眼.第2版.北京:人民卫生出版社,2000:380—483
55 李美玉.青光眼学.北京:人民卫生出版社,2004:583—663
