p53与血管新生
p53是一种抑癌基因,位于人染色体17p13上,全长约20kb,含有11个外显子和10个内含子,转录产物为2.5kb mRNA,编码产物为分子量53 000蛋白,简称p53。p53由393个氨基酸组成,含有3个结构区,即酸性的氨基酸区/非极性区和碱性的羧基区。
p53基因改变有3种类型,即完全缺失、显性负突变(dominant negative mutation)和显性正突变(dominant positive mutation)。显性负突变是指突变型p53基因产物突变型p53无活性,且能干扰另一个未突变的野生型p53基因的产物p53的功能,使后者失去抑癌的功能;显性正突变是野生型p53基因均变为突变型p53基因而成为致癌基因;p53基因完全缺失是指细胞中染色体17p13上2个p53等位基因均已丢失。p53常见的基因突变部位位于外显子5和外显子8区域内在进化过程中具有保守型的密码子。分析各种肿瘤中的p53基因突变谱,发现基因突变部位主要在密码子175、248或273上,有G→A转换,或G→T转换。
在人体各种细胞中,都含有低量的p53,其半衰期较短,仅6~20min。p53正常功能为控制DNA复制及基因转录调节,诱导细胞分化。p53功能受其含量和磷酸化的影响,随着含量增加或磷酸化,其活性增强。p53是一种能与DNA结合的蛋白,结合后影响DNA复制和转录功能。p53可抑制不含有p53反应元件的基因启动子的转录活性而抑制细胞生长,也可激活含有p53反应元件的基因启动子的转录活性而诱导细胞凋亡。p53还是一种转录激活因子,能激活p53-DNA结合部位邻近基因的表达,活化细胞生长的其他负调控基因。
当细胞受到刺激或其中的DNA受到损伤后,p53蛋白出现累积积聚现象。在缺氧的状态下,p53在细胞核内聚集,构型改变,与不同基因的p53反应元件结合,调节其表达。一些是抑制基因表达(p53repressed genes,Prgs),一些是促进基因表达(p53inducible genes,Pigs)。在非应激状态下,p53蛋白通过mdm2作用降解。Mdm2具有p53特异性泛素蛋白连接酶的作用。与p53结合后,可以促进多个特异性的泛素分子结合到p53蛋白的C-末端,从而使p53泛素化并被细胞内的蛋白酶识别和降解。
由缺氧引起的p53激活机制尚不清楚,缺氧激活p53,导致神经元细胞凋亡,但也可能与血管新生有关。例如:当肿瘤细胞缺血时,细胞酸中毒,缺氧。这时p53可能通过破坏血管新生的促进与抑制的平衡状态、或者通过调节缺氧时HIF的活性影响血管新生。
已有报道:p53对于促进血管新生的因子如VEGF-A、FGF、MMP-1、COX-2和FAK(human focal adhesion kinase,人局部黏附激酶,表达于低分化的神经胶质瘤的内皮细胞中),具有抑制作用。其抑制作用可能发生在转录(FAK)或翻译水平(FGF)。p53也可以促进抑制血管新生的因子(如TSP-1、BAI1、MMP2和Eph2A)表达。另外在肿瘤细胞研究表明:突变型p53(mt p53)通过改变TSP-1/VEGF-A,抑制血管新生。另外缺少p53,有助于细胞在缺氧环境下存活。有研究表明:p53+/+的小鼠肿瘤对抑制血管新生的治疗反应性较p53-/-的小鼠肿瘤好。而这些提示p53可能调节HIF的活性。
1998年,An等在缺氧环境中培养McF7细胞,然后用免疫沉淀法,发现一种p53蛋白与HIF-1α相互结合的产物,并且在这些细胞中p53的激活需要HIF的参与(图6-5)。另外正常细胞在常氧环境下,促进HIF的表达,p53表达也增强。进一步研究表明,只有磷酸化的HIF与p53相互作用。HIF蛋白中有两个功能域与p53的DNA结合区作用。这两个功能域包含脯氨酸残基,与HIF的羟基化和pHVL结合有关。
但在正常的内皮细胞研究中的结果与上述不同:缺氧可以促进p53的活性,但不能通过HIF-1α和HIF-2α介导。这可能与细胞不同有关。另一个研究表明p53与HIF共同竞争结合协同催化剂P300,p53与P300的结合力高于HIF,这样,p53可以调节HIF的转录作用,调节其促进血管新生的作用。还有研究表明:高水平的p53活化导致mdm2介导的而非VHL依赖的HIF-1α降解。在这种情况下,p53可以看作是一种分子伴侣,有助于mdm2与HIF-1α连接,进而抑制HIF-1α的功能。这也可能解释p53+/+的移植物与p53-/-的移植物相比,有低水平的血管化。也许可以猜测,HIF与p53结合后,抑制mdm2介导的p53降解,增加p53的功能。但现在研究表明,在常氧状态下,mdm2也与HIF-1α结合。这些提示HIF和p53的调节是非常复杂的。
另外,p53还参与了Mds1/S1004A的促进血管新生的作用。Mds1可以促进血管内皮细胞移动和角膜新生血管。它可能有两个作用通路。一是激活内皮细胞广泛表达的MMP13胶原酶,促进细胞外基质降解。另外与p53的C-末端结合抑制其转录活性而增强它的抗凋亡功能,促进血管新生。(https://www.daowen.com)
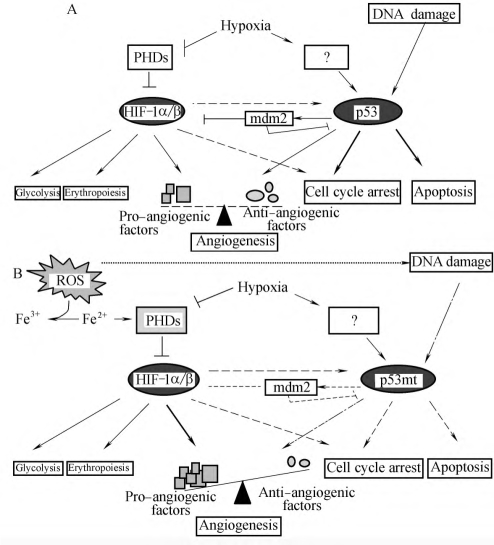
图6-5 p53与HIF的关系
(A)缺氧的正常细胞:缺氧或DNA损伤能激活HIF-1α和p53,缺氧能灭活脯氨酸羟化酶(proline hydroxylases,PHDs),进而刺激HIF-1α,活化部分基因表达;另外激活HIF-1α可以直接或间接的通过p53导致生长停滞。由于DNA损伤或缺氧,p53激活基因,导致细胞周期停滞或细胞凋亡。另外p53还通过激活抑制血管新生基因或抑制促血管新生基因表达。这样p53表达可以调节HIF介导的促血管新生作用。另外p53还可以通过促进mdm2的表达促进HIF的降解。这可以解释在缺氧情况下,正常细胞生长停滞,细胞凋亡
(B)在缺氧的肿瘤细胞,活性氧离子(reactive oxygen species,ROS)损伤DNA,但由于p53突变,限制了细胞对DNA损伤的反应。由于ROS和缺氧的刺激,HIF-1α的量和活性增强
除了上述基因参与血管新生外,还有一部分癌基因、原癌基因和抑癌基因参与血管新生的调控,如表6-1。
表6-1 参与血管新生调控的其他部分基因

综上所述,这些原癌基因、癌基因和抑癌基因对于血管新生的调控因素,总是增强促进血管新生的因素,如VEGF、angiogenin-3,bFGF,IL-8和IL-6等,并且以调节VEGF最多;减弱抑制血管新生的因素,如TSP-1;提示这些基因的激活总是促进血管新生。
(李贵洲 李文生 朱益华)
