二、侵 入 法
研究眼部新生血管形态、分布、结构的方法很多,根据其位置的深浅和与周围组织的关系,可以有不同的方法。有的可在活体上应用,如荧光血管造影等。有的则只能用于死后观察。有的方法只能观察血管的断面或表面,如组织切片、光学显微镜。有的方法则可观察血管的三维立体结构,如血管树脂铸型。随着透射电镜和扫描电镜的广泛使用,对血管的超微结构有了进一步的了解。如果联合使用各种方法研究,则可较全面系统地观察眼部新生血管的三维立体走行分布和其超微结构特点。
(一)组织切片和显微镜观察
组织切片和光学显微镜是观察组织和血管形态的最普通和常规的检查方法,可以了解血管断面的结构和形态以及与其周围组织的关系,还可与血管灌注联合起来观察,如眼球灌注墨汁或其他染料后再做切片,可观察到血管部分走行、分布情况。由于组织切片仅能观察血管的断面,为了观察新生血管的分布和走行,又开展了连续切片的方法,但连续切片需要逐片观察,然后连贯在一起,描绘出血管的走行和分布,故费工费时,工作量大,很难推广。
组织切片常用的包埋方法有火棉胶包埋法、石蜡包埋法、火棉胶石蜡双重包埋法、炭蜡包埋法以及用于冷冻切片的明胶包埋法等。火棉胶切片厚度至少在10μm以上,不能切薄,也不能作连续切片,但可用于眼球组织以避免组织收缩和变脆。石蜡切片法可切成极薄的片子,可达4μm以下,能连续切片。省时、操作容易,但组织易破碎、收缩。
组织切片常用的染色法为苏木精伊红法(Hematoxylin-Eosin method)即HE染色法和高碘酸雪夫染色法(Periodic acid-schiff method)即PAS法。视网膜血管消化铺片也常用这两种方法染色。
1.苏木精伊红染色法
(1)染色方法
①切片蒸馏水洗,干燥后置入苏木精染色3~15min,通常为5min左右。
②置入1%盐酸乙醇20~60s,如苏木精染色过深可置入乙醇时间稍长,然后自来水洗。
③置入氢氧化氨溶液内反蓝,30~60s,自来水洗后用蒸馏水洗,此时可用显微镜检查,细胞核应为蓝色,如色淡,还可重染。
④置入伊红液内3~5min,蒸馏水洗。
⑤系列乙醇脱水,置入80%乙醇10~30s,绝对乙醇中脱水2次,每次各10~30s。
⑥二甲苯透明2次,每次1min。
⑦干燥后,盖玻片,树脂固封。
(2)结果:血管细胞核呈蓝色,胞质呈粉红色。
2.高碘酸雪夫染色法
(1)原理:高碘酸为强氧化剂,它可氧化多糖分子内1,2-乙二醇基而产生两个醛基,此醛基再与Schiff试剂结合即产生红紫色。
(2)染色方法
①使切片脱蜡入水。
②置入0.5%(或1%)高碘酸溶液,室温2~5min。
③蒸馏水洗。
④置入Schiff试剂,室温10~15min。
⑤置入二氧化硫水中洗3次,每次2min,除去吸附的高碘酸和多余染料。
⑥自来水洗5~15min后,蒸馏水洗。
⑦置入Mayer苏木精中复染核1min。
⑧自来水洗5min,换蒸馏水洗。
⑨逐级乙醇脱水。二甲苯透明,封固。
(3)结果:多糖或糖原(PAS阳性物质)呈红色或紫红色,核呈蓝色。
(4)注意事项
①因高碘酸为强氧化剂,氧化时间限制在10min之内。
②氧化时的环境温度不能超过20℃。
③高碘酸溶液pH值应为3.0~5.0,一般情况下1%高碘酸溶液的pH值就处于适用范围。
④配制好的1%高碘酸溶液应保存在冰箱中,温度为4~20℃。
3.病理组织切片联合免疫组织化学方法 目前,大部分新生血管观察方法还是依靠病理组织切片观察,特别在联合免疫组织化学方法,可以更加清晰标记新生血管的形态、走行及病理生理特点。
(1)ADP酶染色视网膜铺片:C57BL/6J小鼠腹膜下注射麻醉(每15g注射0.5ml),心脏灌注后摘除小鼠眼球固定于4%多聚甲醛溶液中,4℃过夜。去除角膜,取出晶状体、玻璃体,以视盘为中心做4个放射状切开,去除巩膜、脉络膜,用毛笔扫除视网膜外层的色素上皮。Tris-马来酸缓冲液冲洗后在37℃反应液中孵育(反应液:浓度0.2mol/L、pH7.2的Tris-马来酸缓冲液中加入硝酸铅3mmol/L、氯化镁6mmo l/L、ADP 1mg/ml)。T ris-马来酸缓冲液反复漂洗后加入10%(1∶10)硫化铵显色。漂洗后甘油明胶封片。
(2)通过新生血管内皮细胞染色,组织切片可以更好的显示新生血管结构。Tablel显示可以用于新生血管内皮细胞的标记物。某些标记物如CD105,主要表达于增殖活跃的新生血管内皮细胞,这一特性为我们研究新生血管生物学特性提供了新的思路(表7-1)。
表7-1 Markers for tabeling endotholial celis for microscopic imaging

(续 表)
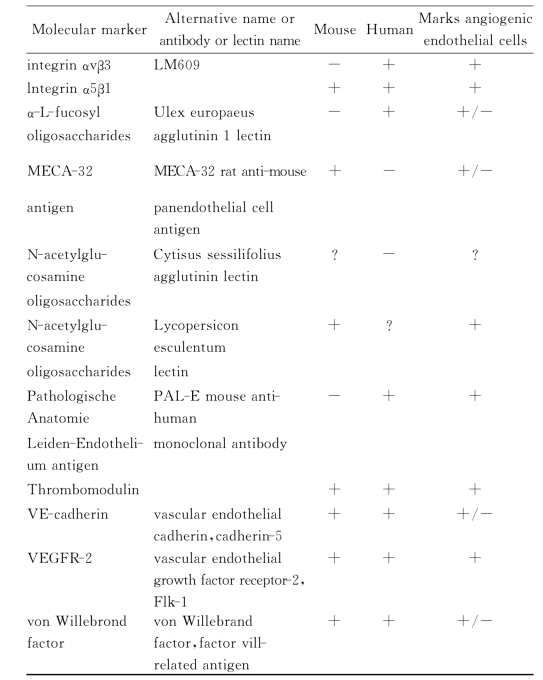
(免疫反应或染色:+,存在;±,与正常血管相同或稍同;?,不清楚或不知道)
4.测量工具的使用 原始的定量测量图像的基本工具是测格。它是画或印在透明材料上的,包含有点或(和)线面的几何图形。应用时,将之叠加或叠映于图像上,然后记录其与图像之间的关系。借助目镜测微器(测格)对有关图像进行二维测量以及对所获得的测量数据进行三维参数计算,最后获得对有关图像的定量分析。这是一种人工图像分析研究,不但测量和计算工作量大,而且效率低。现已改为使用计算机处理图像资料,即图像分析仪。图像分析仪的分析广度要大的多,并能明显提高工作效率,所得到的各种数据通过图像分析仪上的计算机进行统计学处理,从而自动获得有关图像的形态测量,灰度信息和三维结构信息。
在实际工作过程中,有时需要获得新生血管三维结构的信息。故在这里浅谈一下新生血管三维结构重建切片的制作、定位和图像输入。
新生血管三维结构重建的高低除了与图像分析仪程序软件设计有关外,主要取决于需要重建切片质量的好坏和上下定位。三维重建的图像在理论上要求要忠实地再现原结构的外貌和内部结构,但实际上是达不到的。如何使得重建的图像接近于原结构,减少误差,是我们需要达到的目的。
(1)切片制作:切片制作是三维结构重建的第一步,切片质量的好坏直接影响重建质量,为此,提出如下要求:
①保证外形轮廓的完整。完整的切片是建立三维结构外形轮廓的基础。在切片过程中(切片、裱片),外形残缺和变形的不能要。这就要求切片刀具要锋利,裱片时的水温要适当。
②切片数目。对于三维结构重建来讲,切片数目越多越好,这样建立的外形轮廓才光滑,但无形增加了工作量,根据所建结构的大小,选择适当的切片数目,一般不超过256张,一般三维结构重建的软件最多处理这么多张。对于某一结构的大量切片,可等距抽取切片,即间隔10张或20张,甚至更多抽取一张。切片之间的间距要计算准确,切片厚度乘以间隔切片数加1。例如,切片厚度为10μm,间隔9张取一张,那么,切片间距为10μm×(9+1)=100μm。
③切片厚度。切片厚度对三维结构重建影响不大,在不影响外形轮廓光滑的前提下,切片厚一些也是可以的。
④切片染色。染色的要求是所要重建的组织结构之间对比明显,反差大,便于计算机自动识别,可以采用鼠标人工加以划定。
⑤切片组织变化。切片组织变化是指组织经处理后发生的组织皱缩或膨胀以及切片的压缩和膨胀,组织皱缩和切片压缩是通常的变化。切片面积的压缩系数各有不同。切片大小变化的因素,在输入计算机时要考虑进去。
(2)三维结构重建的定位:在计算机辅助下进行三维重建,目前多采用连续切片或连续断层的方法。这些方法需要选择确定坐标,即定位,以保证重建效果的逼真。定位在组织块包埋时就要完成,目前常用的方法有:
①打孔法。在组织内用激光或人工打孔,在不同位置打3~4个洞,以利于在相邻两切片间定位。
②画线。在组织上,用不容易在以后的处理过程中掉色的色彩画上。
③埋入标志。在组织块包埋时,在组织块的四周埋入几根细的彩色塑料管。
④选择自然标志。在组织块上,根据自然特征使得在对位时能够利用上。
目前,单纯一种方法还不能精确地定位,几种方法结合起来,才能达到满意的效果。
(3)三维结构重建的图像输入:经摄像机摄入的图像,可以是显微镜的图像或人工在投影仪下绘制的图画,无论何种图像,输入计算机的监视器后,所显示的图像大小与真实的组织大小不一样,可能放大或缩小,其倍数要输入计算机内。例如,一组织切片在某一处的宽度为10mm(已经把切片压缩系数计算在内),上下两张切片的间距为100μm,在监视屏上的宽度为100mm,也就是说,放大了10倍。这时,上下两张切片之间的间距为1 000μm。这种数据在图像输入完成后,根据计算机程序的提示要输入到主机内,以确保三维结构重建比例正确。
5.实例简示
(1)大鼠角膜新生血管的观察
①角膜新生血管生长的动态观察:盐酸氯胺酮肌内注射麻醉下采用裂隙灯显微数字图像处理系统进行照相,拍摄从角膜缘血管网扩张至新生血管生长延伸的动态过程。
②角膜新生血管的组织病理学检查:大鼠处死后取眼球,新生血管眼在对侧角巩缘开一小口后放入4%多聚甲醛固定液(正常眼在任意象限角巩缘开口),于4℃条件下固定20min。将固定后的眼球用乙醇梯度脱水,二甲苯透明,石蜡液浸染,然后以角膜顶点在下、使角膜中央至视盘连线垂直水平面进行石蜡包埋;或12点角膜缘在下、使角膜中央至视盘连线平行水平面进行石蜡包埋。连续切片,厚度4μm,在37℃温水中展平,捞片于预处理过的载玻片70℃烘干,置58℃恒温箱烤片24h。切片脱蜡后苏木素酸化伊红液染色,封片,光学显微镜观察拍片。
(2)兔角膜新生血管墨汁灌注:将兔以100mg氯胺酮肌内注射,麻醉状态下行主动脉和右心房分别插管,以含有1 000U肝素的生理盐水500ml由主动脉插管冲洗,然后结扎胸主动脉和右心房插管,以中华墨汁/甲醛=3/2的混合液20ml在5min内匀速注入。1h后取出眼球,在裂隙灯进行拍照。组织病理学观察:将墨汁灌注拍照后的兔角膜标本取下,以4%甲醛溶液(10%福尔马林溶液)固定,石蜡包埋,切片常规HE染色,光镜观察。
(3)荧光显微镜活体观察角膜新生血管:3~3.6kg重新西兰白兔,角膜新生血管诱导成功后,麻醉好的兔呈俯卧位,头部固定。以若丹明(0.15mg/kg)或荧光素钠(15mg/kg)分别为白细胞和新生血管标记物,以荧光显微镜可以观察到血管直径、血流速度以及自由流动、滚动和黏附贴壁的白细胞。从而分析角膜新生血管的病理、生理学特性。
(二)消化铺片技术
消化铺片技术可用来观察视网膜和脉络膜的血管。研究视网膜血管的方法很多,各有其利弊。首先用胰蛋白酶或胃蛋白酶消化掉视网膜组织,只余下视网膜血管,然后进行染色。这是至今各国学者尚在使用的方法。其后许多作者在此基础上进行一些改进,如在血管内注入柏林蓝或印度蓝之后再进行消化铺片,可清晰地看到血管,又不干扰以后的消化和染色。现在有作者在静脉内注入示踪物质辣根过氧化酶之后,再做消化铺片,用来观察微血管灌注的情况和观察微血管壁通透的状态。
1.消化铺片方法
(1)消化液的配制:首先制备缓冲液。由三种成分组成:A液,含1mol/L苯果酸,其分子量为116.07,即用11.607克加蒸馏水至100ml;B液,含1mol/L三羟甲基甲烷(Tris),其分子量为121.14,即用12.114克加水至100ml;C液,含0.5mol/L氢氧化钠,其分子量为40,用2克加水至100ml。将A、B和C液按下列比例配成缓冲液:
A液 B液 C液 水
5ml 5ml 12ml 28ml
测pH值应为7.8,然后按3%加入胰蛋白酶(Difcol 1∶250)即成消化液。一般均为新鲜配制使用,剩余放冰箱备用。
(2)摘除后的眼球,置入4%甲醛溶液固定24~48h。
(3)自睫状体后部近锯齿缘剪开巩膜,去掉眼前节和玻璃状体。
(4)在水中轻轻漂取视网膜。清水漂洗2~3h,经常换水。
(5)将视网膜置入3%胰蛋白酶消化液中,在37℃恒温箱中培养1~3h,随时观察标本,当组织崩解,消化液浑浊,可用清水漂洗,置解剖显微镜下观察,如尚未消化完全,则更新换新鲜消化液消化,直至视网膜组织完全分解,仅余下血管网。
(6)在清水中仔细撕去内界膜。也可不撕去内界膜,将血管网用清水漂洗干净后,平铺在干净玻片上。
(7)自然干燥后,用苏木精伊红或PAS染色。
(8)注意事项
①如视网膜较大,血管层后极部厚,周边部薄,如做整张铺片,不容易平整,周边部容易卷边,血管皱缩在一起,故可根据所须观察部位,剪成数小块。
②尽量去除玻璃状体。
③消化时间不宜过长,否则容易污染。
④消化铺片所用器皿必须非常干净。
消化铺片的优点是:可清楚看见血管的细胞结构,如内皮细胞和周细胞;可清晰看见血管的走行分布及无毛细血管区带;制作标本方法比较简单,即使在甲醛溶液中存放数年的眼球也可应用。
消化铺片的缺点是:只能用于摘除眼球;仅能看到两维结构,看不见三维立体结构;仅限应用于视网膜和脉络膜的血管,观察脉络膜血管尚须经过脱色素处理。
2.实例简示 荧光素血管灌注辅助视网膜、脉络膜铺片。
(1)荧光素血管灌注辅助视网膜铺片:纯种有色大鼠(brown norway rat)麻醉后,取相对分子量较高的荧光素粉(异硫氰酸葡聚糖荧光素,FITC),相对分子量2×106(Sigma),50g溶在1ml磷酸盐缓冲液,直接心腔内注射,4%多聚甲醛固定10min,在解剖显微镜下取出角膜、晶体、玻璃体、脉络膜和巩膜,完整游离视网膜组织,4%多聚甲醛固定3h,放射切开5~6刀,平铺到载玻片上。滴少量中性树脂胶后,荧光显微镜下,数码相机拍照。荧光标本在低温避光下可保存3个月。
(2)荧光素血管灌注辅助脉络膜铺片:脉络膜血管平铺法激光共焦显微镜下脉络膜新生血管定量分析,颈动脉注射FITC-右旋糖酐(美国Sigma公司产品,相对分子量为2×106)PBS溶液1ml(30g/L),摘除眼球,于10%甲醛PBS液中固定1h,沿赤道部打开眼球,去除眼前节,揭除视网膜,做4~6条放射状切口,使眼杯平铺于含液体介质的载玻片,巩膜面朝下。利用激光共焦显微镜(美国Bio-Rad公司产品,MR A/2型,配置日本Nikon公司E600荧光显微镜)进行观察和测量,以488nm激光激发样品,收集530nm荧光信号,观察CNV形态并测定CNV区域面积,计算机采集的数字图像经confocal assistant转换后由Photoshop编辑排版,脉络膜新生血管面积采用Laserpix软件(美国Bio-Rad公司产品)进行自动测量。
相对分子量较高的荧光素血管灌注辅助视网膜、脉络膜铺片是一种简单有效的检测方法。相对分子量较高(2×106)的荧光素,不能通过新生血管壁渗漏到周围组织中,它能很好的显示视网膜、脉络膜新生血管形态和分布的改变。临床上常用的荧光素钠相对分子量为376.3,容易通过新生血管壁渗漏到周围组织中,导致视网膜、脉络膜组织弥漫荧光着色,不适宜此项研究。
(三)血管灌注
血管内灌注各种液体用以观察微血管的走行分布、形态以及微血管的相互关系。血管灌注可以单独作为一种观察血管的方法,也可与组织切片或消化铺片技术联合应用。可用以观察角膜、视网膜、脉络膜、虹膜各个部位的新生血管。眼科常用的灌注液有印度蓝、柏林蓝、硝酸银、硅橡胶、氯丁橡胶、中国墨汁和塑料混合物等。
灌注方法:眼球灌注方法可分为全身灌注和局部灌注两种。
1.全身灌注 即从左心室或升主动脉灌注,然后使灌注液进入眼球血管。适用于小动物如大鼠、荷兰猪等。首先要熟悉动物解剖,麻醉后,开胸,由心尖偏左进针,穿入左心室,或自升主动脉插管,安置线套固定上腔静脉切开放血。从插管处用生理盐水冲洗,直至清水流出,然后注入灌注液,直至眼球血管充盈。
2.局部灌注 可从颈内动脉、眼动脉或视网膜中央动脉注入灌注液。适用于人和比较大的动物如猴、猫、兔、狗等。(https://www.daowen.com)
(1)颈内动脉灌注法:动物麻醉后,剪去颈部毛,在相当于气管两侧切开颈部皮肤,分离皮下组织,找出颈外静脉,安置线套,结扎近心端。分离胸骨舌骨肌和胸骨甲状肌,在二肌缝深层气管之两侧找到有搏动的颈内动脉,同时可见伴行的颈内静脉,分别安置线套,结扎近心端,颈动脉插管,剪开颈外和颈内静脉,任其自由流血。用生理盐水自颈内动脉注入灌洗,血和水自静脉侧流出,灌注盐水量以流出清水为止。分别自两侧颈内动脉注入灌注液如柏林蓝或中国墨汁,结扎静脉,继续以均匀速度注入灌注液,直至结膜和视网膜毛细血管充盈为止。拔去插管,结扎动脉。取出眼球,放置于4%甲醛溶液中固定24~48h。如做组织切片,按常规火棉胶包埋、染色。如做视网膜铺片,则去掉眼前节及玻璃状体之后,在水中漂取视网膜,平铺于玻片上,封固。置光学显微镜下观察。
(2)眼动脉灌注法:按常规解剖学方法开颅,取出脑组织,在颅底部找出颈内动脉,在发出眼动脉之前的部位结扎颈内动脉,找出眼动脉,插管。自颈内静脉放血,从眼动脉注入灌注液。余同颈内动脉灌注法。
(3)视网膜中央动脉灌注法:此法仅限于观察视网膜血管,而且技术比较困难。可用于新鲜或死后摘除的眼球。新鲜未经固定的眼球插管不易进入视网膜中央血管,可先用4%甲醛溶液固定视神经游离端或整个眼球30min至2h。冲洗后,将眼球向下、视神经断端向上,固定好,用锐剪剪一新鲜平整创面,在解剖显微镜下找到视网膜中央动脉或静脉,用一极细玻璃毛细管(外径250μm,内口90μm)插入视网膜中央动脉或静脉,冲洗眼球,注入甲醛溶液固定血管,然后注入柏林蓝或墨汁灌注液,结扎视神经,将眼球置入甲醛溶液内固定24~48h。漂取视网膜,显微镜下观察。
3.注意事项
(1)局部灌注时,灌注压力以不超过脏器的输入动脉压为限,一般眼球中心动脉压为8~10.7kPa(60~80mmHg),以不超过此限为宜。
(2)灌注时力量要均匀,不可忽快忽慢,要一气呵成。
(3)灌注时不要进入空气。
血管灌注的优点是:①可以清晰地显示出血管的走行、分布和形态。②立体感较强,能观察微动脉、微静脉和毛细血管的分布及其相互关系。③操作比较简单,不需特殊设备。
(四)透射电镜和扫描电镜
1.透射电镜
(1)取材:所取组织尽量保持其生活时状态。故可在活体取材,或处死后1min之内将所取组织浸入固定液。由于电镜固定液穿透力较弱,取下的组织大小一般不超过1~2mm。组织的血液供给停止后,组织和细胞内的各种酶,尤其是溶酶体里的各种水解酶释放到组织内,使构成组织结构的主要成分如蛋白、核酸等迅速降解。为了降低酶的活性,要求在低温条件0~4℃操作,所用的容器和器械应放在冰箱内预冷。所用器械必须锐利、避免任何人为的牵拉和挤压所造成的损伤。
(2)固定:动物心脏停止跳动或组织离体后,缺氧情况立即在所有细胞内产生,死后的细胞就开始释放出自溶酶,一系列死后变化随即出现。为了降低酶的活性,减缓自溶过程,固定时的温度一般要保持在0~4℃。固定液尽量能完整地保存细胞各种结构和成分。常用的固定方法有以下几种:
①用2.5%~3%戊二醛(0.1mol/L磷酸缓冲液配制)或2%多聚甲醛加2.5%戊二醛预固定1~2h。然后用含0.2mol/L蔗糖的0.1mol/L磷酸缓冲液漂洗约1h,中间更换液体3次。温度均为4℃。再用1%四氧化锇固定1~2h。冲洗的时间可灵活掌握,如有必要,样品可在冲洗液中存放,在4℃条件常换冲洗液,可存放几个月。
②单纯用1%四氧化锇固定1~2h,温度为4℃。
③用1%戊二醛及1%四氧化锇(0.08mol/L磷酸缓冲液配制)混合液固定1h,温度4℃。
④用0.1mol/L二甲砷酸钠缓冲液配制的冰戊二醛固定液固定。
⑤用4%多聚甲醛(0.1mol/L磷酸缓冲液配制)灌流固定,取下组织块后,继续固定,然后冲洗,再用1%四氧化锇固定。
为了使组织在固定过程中不致破坏,一般要求固定液的pH值为7.2~7.4。浸泡固定一般在4℃冰箱中进行,为了避免组织块贴瓶的一面固定不好,在固定过程中,轻轻摇动数次。
(3)脱水:用等级系列脱水液脱水,脱水时用滴管吸取,不必更换容器,但脱水液的量不应太小,一般与组织块的比例应当>1∶10,在室温下进行即可。常用乙醇或丙酮脱水。具体步骤如下:
50%乙醇或丙酮 10~15min
70%乙醇或丙酮 10~15min
90%乙醇或丙酮 10~15min
100%乙醇或丙酮 共3次每次10~15min
脱水时间,根据组织块的情况,可以灵活掌握,总时间在1~1.5h。时间太短,脱水不充分。影响包埋效果,时间太长,有提取作用。
(4)包埋、切片和染色:组织块经环氧树脂包埋后作超薄切片。要求切片很薄,50~100nm(500~1 000)。最后用醋酸铀和枸橼酸铅双染色。透射电镜观察。
透射电镜的优点是:分辨力高,放大倍数大,故可以观察毛细血管、微动脉和微静脉的细微结构,血管壁细胞及其连接方式,细胞及其细胞器的超微结构,与血管周围组织的关系及通过微血管壁的物质交换方式的认识等。其缺点是只能观察小块组织极薄的血管断面,且定位困难,标本制作也较复杂,故有比较大的局限性。
2.扫描电镜 透射电镜的标本已有了固定、脱水、包埋、超薄切片、染色等一整套的方法。但扫描电镜标本制作还没有十分确定的方法。由于扫描电镜观察的部位是样品的表面,根据不同组织或器官分不同的制作方法,大体可分为以下几个步骤:①切好样品,生理盐水冲洗;②2.5%戊二醛和1%四氧化锇固定24h以上,48h以内;③生理盐水冲洗;④用上述乙醇系列脱水;⑤临界点干燥,喷镀金。
举例如下:视网膜毛细血管标本制作。
(1)目的:利用胶原酶除去结缔组织纤维和基底膜,以观察血管外面的结构。
(2)方法
①固定:用缓冲的10%甲醛以及2.5%戊二醛灌流或浸泡,固定3h以上,pH值7.4;
②水洗:用磷酸缓冲液水洗数次,除去固定液;
③盐酸处理;用8N的盐酸在60℃下浸泡50~70min;
④水洗:用缓冲液洗2次,换液冲洗,去除盐酸;
⑤胶原酶处理:用pH6.8的磷酸缓冲液,按1mg/ml的比例加胶原酶,在这种液体中27℃下浸泡3~8h;
⑥用缓冲液冲洗;
⑦后固定,用磷酸缓冲液配制的2%四氧化锇液,pH值7.4做后固定;
⑧脱水、干燥:丙酮或乙醇系列脱水,醋酸异戊酯置换,液态二氧化碳临界点干燥;
⑨镀膜:白金溅射喷镀。
(3)扫描电镜的优点
①焦点深度很大,即使是凹凸不平的样品,也可清晰成像,故立体感强。
②放大倍数范围宽,可以放大几倍到二十几万倍,既便于观察整体又便于观察局部。
③分辨率可达<10nm,高级的扫描电镜可达3nm,虽不及透射电镜,但比光镜分辨力高得多,清晰看见细胞内的各种细胞器。
④有的样品制作比较简单。
⑤标本腔大,可以放比较大的样品,样品移动范围也比较宽,故可观察比较大的样品。
(五)血管树脂铸型
无论是组织切片、消化铺片技术或荧光血管造影,只能是两维空间观察血管。利用树脂灌注联合扫描电镜成功地观察眼部的毛细血管,这是研究血管结构技术上的大突破,利用这种方法可以清晰地看到血管走行、分布的三维立体结构,并可看见血管表面的微细结构。1973年Matsuo用树脂灌注研究家猫和荷兰猪睫状体的血管。1974年Shimizu和Ujiie用树脂铸型系统地观察了猴眼视网膜、脉络膜以及其他眼组织的血管结构。现在已在全世界推广应用,以研究人类和各种动物脏器血管系统复杂的立体分布和病理研究,成为现代研究血管结构的最新方法。
1.注入剂的配制 可使用已经商品化的注入剂或自行配制。
(1)注入剂:最初所用的树脂黏度很高且容易破碎,后经Matsuska的研究和改进,制造出一种甲基丙烯酸甲酯的衍化物,商品名为Mercox。这种灌注液性能很好,是黏度已经调整适当的注入剂,具有比较低的黏度,可以注入很细小的毛细血管内,在聚合和硬化的过程中体积很少变化,故可使血管保持原来的大小,同时聚合很快,动脉内注射后10min内聚合过程即完毕。市场上出售的有呈红色的和呈蓝色的Mercox CL-2R两种,可任选一种。Mercox CL-2R有A液和B液。A液是塑料树脂单体,B液为聚合剂。A液和B液的比例为20∶1。注射时将A液和B液混合后,立即注射,使用起来很方便。但如放置时间过久,则Mercox的黏度增高,可在使用时加入20%~30%的甲基丙烯酸甲酯单体使黏度下降。这种商品需要进口,也可采用国产甲基丙烯酸甲酯预聚体灌注,可以得到同样的效果。
(2)甲基丙烯酸甲酯预聚体:一般塑料制品厂可以买到,北京出品的预聚体除含有甲基丙烯酸甲酯外,尚含有0.04%偶氮二异丁腈和7%苯二甲酸二丁酯,1%硬脂酸。灌注前将预聚体放入烧杯或烧瓶内,加入引发剂过氧化苯甲酰,按6%的比例配制,即100ml预聚体加入6g过氧化苯甲酰,在60~70℃的水浴中不断搅拌,一般5~6min过氧化苯甲酰即溶解,停止加热,立即将烧杯放置在冷水中或加有冰块的冷水中,急剧冷却。加入染料苏丹Ⅲ或橡胶红,浓度为1/10 000~1/1 000。也可不加染料,因其本身即呈淡棕黄色。配制好后在冰箱内可保存1周左右。半聚合的预聚体在加入加速剂二甲基苯胺之后立即开始聚合,随着发热而黏度上升,因此要在灌流眼球准备工作完了之后再添加二甲基苯胺,一般按1%浓度加入,即100ml预聚体加二甲基苯胺1ml,迅速搅拌混合均匀,立即注入血管内。因为加入加速剂之后,10min之内就开始聚合硬化,故在5~6min之内注射完毕是可以注入毛细血管的最佳时间。
(3)自行配制注入剂:如果没有预聚体,也可在化学试剂工厂购买自行配制,配方如下:
甲基丙烯酸甲酯 9份
丙烯酸甲酯(增韧剂) 1份
过氧化丙乙酰(引发剂) 6%
二甲基苯胺(加速剂) 1%
染料(苏丹Ⅲ或橡胶红) 1/10 000~1/1 000
首先将甲基丙烯酸甲酯单体预先部分聚合,使之变为具有一定黏度的液体。预聚的优点是使部分单体活化,诱导其他分子活化聚合,以加快在血管内的聚合速度。由于预聚时已有部分收缩,故可减少注入血管后成型收缩率。
预聚方法是将甲基丙烯酸甲酯单体,丙烯酸甲酯和过氧化苯甲酰按上叙方法置烧瓶内,在70~80℃水浴中不断搅拌,待过氧化丙乙酰完全溶解,液体变稠,停至加热,放置冰水中急剧冷却,然后置冰箱内备用。灌注时加入染料和1%二甲基苯胺。操作时最好戴口罩,并有良好通风设备,以避免吸入冷却时大量发生的甲基丙烯酸甲酯气体以及微量的氰。
2.灌注方法
(1)猴眼灌注法:灌注前,在肘前静脉注入30%乌拉坦(Urethane)按每千克体重1g给药,或用戊巴比妥钠麻醉,同时自静脉内注入肝素12 500U,以防止凝血块堵塞毛细血管。在颈部气管两侧切开皮肤,钝剥离分开皮下组织,在胸骨甲状肌和胸骨舌骨肌之间深处找到颈内动脉和静脉,同时可见伴行的迷走神经。结扎颈内动脉和静脉近心端,在颈内动脉上面剪一小口、插管。插管尽可能粗一些,可用9号钝针头或直接安装导管,用线固定好后,剪开静脉任其自由流血。从颈内动脉注入生理盐水,则可见血自静脉侧流出,灌注生理盐水的量以流出清水为止。然后每侧注入配制好的树脂注入剂40~50ml,结扎动脉,拔去插管。当注入甲基丙烯酸甲酯时动物即死亡。
(2)猫和兔眼灌注法:猫自后腿股静脉、兔自耳静脉注入麻醉剂或从腹腔注射麻醉。同时自静脉注入肝素。由于猫、兔颈内静脉细小,故切开皮肤后,在皮下找出粗大的颈外静脉,结扎近心端。然后在胸骨甲状肌和胸骨舌骨肌之间找到两侧颈内动脉,插管、结扎近心端。剪开颈外静脉任其自由流血,颈内静脉细小,可结扎不用。
(3)大白鼠和荷兰猪灌注法:腹腔内注入麻醉剂,给药量同其他动物。在胸部相当两前肢之间切开皮肤和肋骨,暴露心脏。结扎降主动脉,在主动脉分出无名动脉和左颈总动脉处插管,注入肝素6 000U。剪开位于右心耳前的前腔静脉,任其自由流血。注入生理盐水洗净血管内血液,注入甲酯单体20ml,然后注入树脂注入剂20ml,拔去插管,结扎。
要得到很好的眼球铸型标本必须注意以下几点:
①动物一般均在活体上灌注,应保持灌注脏器正常生理状态,注意保持机体脏器的适应温度和湿度,过冷过热、干燥等刺激都会使血管扩张或收缩,影响灌注效果。
②灌注压力和速度:可在注射器前装一压力计。如果在活体或新鲜眼球,将注入压力调节到13.38kPa(100mmHg)左右,一般血管不会破裂。对于死后经过一段时间的眼球,因血管张力不好,注入压力要低一些为好,以维持在5.33~6.67kPa(40~50mmHg)为宜。也可不用压力计,用手推注时力量和速度均匀一致,不能停顿,也可达到毛细血管充分灌注的目的。如果压力不够,流速过慢,毛细血管不易充盈;如果压力过大,超过正常血管所承受的压力,可造成血管破裂,影响观察效果。
③树脂注入的量:注入量的多少直接影响灌注效果,太少毛细血管不易充盈,太多则血管破裂。应根据动物的大小,注入适当的树脂。如灌注体重3 000g左右的家猫,每侧颈动脉注入50ml配制好的预聚体即足够了;400~650g体重的荷兰猪或大白鼠从主动脉弓注入20~25ml即可。
④注入树脂时要排去注射器内的空气,如果注入空气则得不到好的铸型。
⑤自制的树脂灌注液,特别是用氢氧化钠洗过的甲基丙烯酸甲酯,注意不要混有水滴,如果注入水滴,则不能得到完整的毛细血管床的全部铸型。
3.铸型的腐蚀和清洗 灌注好的眼球放置4~24h打开颅顶(或不打开)将眶内容和眼球轻轻取出,避免加压,放在盛有20%的氢氧化钾(或钠)水溶液中腐蚀3周,或40%氢氧化钾(或钠)水溶液中1~2周,每天换溶液1次,如果加温至40℃,则腐蚀速度加快。腐蚀掉的组织用流水轻轻洗掉,然后用蒸馏水缓缓冲洗干净,有时可用弱醋酸冲洗一下更干净。铸型标本经过碱性液体处理后会脱色,但可以在酸性溶液中重新显色。标本腐蚀干净后,在解剖显微镜下检查,如组织尚未腐蚀干净,可继续腐蚀直至组织全部腐蚀干净只余下血管为止。但也不宜过长,超过3周以上铸型容易变脆。
4.铸型的干燥和喷镀 在解剖显微镜下根据观察组织所需部位剪切成小块,剪切时刀剪必须锐利。将要观察的标本放在干净玻璃器皿中,在空气中自然干燥,或放入真空冷冻干燥器内干燥以去除水分。由于甲基丙烯酸铸型会受醋酸异戊酯的作用而膨化,所以如果用临界点干燥时,不能用醋酸异戊酯处理,可直接将铸型从乙醇中移入液体CO2中作临界点干燥。同时要注意干燥器样品笼内有无残留醋酸异戊酯,否则也可使铸型膨化。脱完水的样品一般是没有导电性的,必须进行处理,使其能导电。处理的方法基本上有两种:一是镀膜,即在标本表面覆盖一层导电的薄膜,如炭膜及金属膜。这样电子束由标本表面传到标本台就不致放电。另一是导电染色,即将标本浸泡在四氧化锇中,使锇与标本结合以增加导电性。但锇与标本结合是有限度的,因此浸泡四氧化锇之后,用2%单宁酸处理,就可使标本表面结合更多的锇,然后再用四氧化锇浸泡1次,增加导电性。常用金属膜喷镀使其导电。因为导电染色法往往出现放电,而且成相较暗。镀膜法是将样品用导电胶或银糊粘在样品台上,放入日立IB-3型离子镀膜机喷镀细粉金,由于塑料物质导电差,一般铸型标本喷金比其他生物组织时间长,可喷3~5min,如仍不理想,可再次喷银,最长可喷镀10min,最好争取1次喷镀成功,喷镀后的干燥铸型可以永久保存。
5.扫描电镜观察 将标本置日立S-450扫描电镜下观察,这种扫描电镜样品腔大,可观察比较大的标本,如半个眼球不成问题,而且光源与标本的距离可变,变倍数大。旋转装置可转360°,样品可从-15°至+90°倾斜,以便从不同方向观察,加速电压有5~30kV各个挡次,根据所需要求和放大倍数调整,一般来讲,加速电压越低,扫描电镜图像越显得自然,但分辨力下降。加速电压越高,分辨力越强,但扫描电镜图像会显得不自然。因此,最好改变各种加速电压来进行观察,以便得到鲜明清晰的立体图像。为了充分观察眼部各个组织的血管联系,每次标本可从不同方向剪切,反复进行显微解剖,以便观察血管走行分布及其联系。拍照时首先将倍数放大,调节粗细旋钮至图像清晰,然后再调至所需要的倍数。其次调节观察亮度和对比度,亮度太弱或太亮均可使图像不清晰,对比度太强容易失真,太弱则图像层次不清。因电镜放大倍数较大,眼球铸型标本也大,要得到全景照片不容易,可利用解剖显微镜摄像补充,或拍摄扫描电镜组合片,即在相同加速电压和相同倍数下连续拍摄数张照片,然后剪贴在一起成为全景照片。如果标本同在一平面,如虹膜,则用同焦点即可拍摄组合成一理想的虹膜全景照片。如果拍摄数支涡状静脉,则因它们位于眼球表面不同位置,需要旋转标本和随时调节焦点,剪贴照片时可产生部分对合交错现象。总之,要得到一张高质量的扫描电镜图片,从标本制作直至扫描电镜的应用,每一个环节都很重要,需要反复在实践中体会。
6.树脂铸型的优缺点
(1)树脂铸型的突出优点
①树脂注入剂黏度低、流动性好,无颗粒。可以均匀地注入细小的毛细血管。
②在室温下能聚合变硬成型,故可构成立体的眼球血管模型,可清楚地看到微血管的三维立体走行、分布、联系等关系。并可看到血管表面形态,根据内皮细胞核压迹的形态以区别动脉或静脉。
③树脂对强酸和强碱具很强的耐腐蚀作用,故可用强碱腐蚀样品其他组织,只余血管结构。
④对血管组织无损伤,聚合后收缩率低,体积改变最小,不超过2%,故可准确测得血管管径。
⑤方法比较简单,不需特殊设备。
(2)树脂铸型的缺点
①由于我国尚无商品化的树脂灌注液,使用塑料制品厂或有机玻璃厂的预聚体或单体自己配制,则性能尚不稳定,预聚体的质量也常不保证,故灌注标本在腐蚀和冲洗过程中易碎,不易成形。
②如果灌注过程中,冲洗血管不充分致血液存留,或注入空气、或注入树脂量不够,均可产生相应区域血管缺陷或血管断裂,或不易成型。
③如果灌注压力太大,注入量太多,则可使血管纡曲扩张,甚至破裂,则可在血管周围形成圆形树脂球,影响观察。
④腐蚀标本时,应注意冲洗干净,如残留组织,则一方面影响在高倍镜下观察血管表面微小结构,另一方面会产生不规则条带,不容易与真正血管区别。
尽管树脂铸型扫描电镜观察方法存在上述缺点,但可以尽量避免。它的优点是其他方法所不能代替的。如果与消化铺片技术、荧光血管造影等方法联合应用,就可以利用各种方法之所长,避免其所短,完整地研究血管结构及其病理改变。
(王 康)
