新药的申报与审批
(一)新药申报与审批程序
新药注册申报与审批,分为临床研究申报审批和生产上市申报审批(简称两报两批)。省级药品监督管理部门负责初审,其内容是对申报资料进行形式审查,组织对研制情况及条件进行现场考察,抽取检验用样品,向指定的药检所发出注册检验通知。然后将审查意见、考察报告、申报材料上报CFDA。指定的药检所负责样品检验和申报的药品标准复核。CFDA负责对新药进行技术审批和所有资料的全面审评,对符合要求的予以批准,发给新药证书、药品批准文号,并发布该药品的注册标准和说明书。
1.新药临床研究的申报和审批程序
(1)申请人完成临床前研究后,应当填写《药品注册申请表》,向所在地省、自治区、直辖市药品监督管理部门如实报送有关资料。
(2)省、自治区、直辖市药品监督管理部门应当对申报资料进行形式审查,符合要求的,出具药品注册申请受理通知书;不符合要求的,出具药品注册申请不予受理通知书,并说明理由。
(3)省、自治区、直辖市药品监督管理部门应当自受理申请之日起5日内组织对药物研制情况及原始资料进行现场核查,对申报资料进行初步审查,提出审查意见。申请注册的药品属于生物制品的,还需抽取3个生产批号的检验用样品,并向药品检验所发出注册检验通知。
(4)省、自治区、直辖市药品监督管理部门应当在30日内将审查意见、核查报告以及申报资料送交国家食品药品监督管理总局药品审评中心,并通知申请人。
(5)接到注册检验通知的药品检验所应当在30日(特殊药品和疫苗类制品60日)内按申请人申报的药品标准对样品进行检验,对申报的药品标准进行复核,并在60日(特殊药品和疫苗类制品90日)内将药品注册检验报告送交国家食品药品监督管理总局药品审评中心,并抄送申请人。
(6)国家食品药品监督管理总局药品审评中心收到申报资料后,应在90日(获准进入特殊审批程序的品种80日)内组织药学、医学及其他技术人员对申报资料进行技术审评,必要时可以要求申请人补充资料,并说明理由。完成技术审评后,提出技术审评意见,连同有关资料报送国家食品药品监督管理总局。国家食品药品监督管理总局依据技术审评意见做出审批决定。符合规定的,发给《药物临床试验批件》;不符合规定的,发给《审批意见通知件》,并说明理由。
新药临床研究申报与审批流程见图6-1。

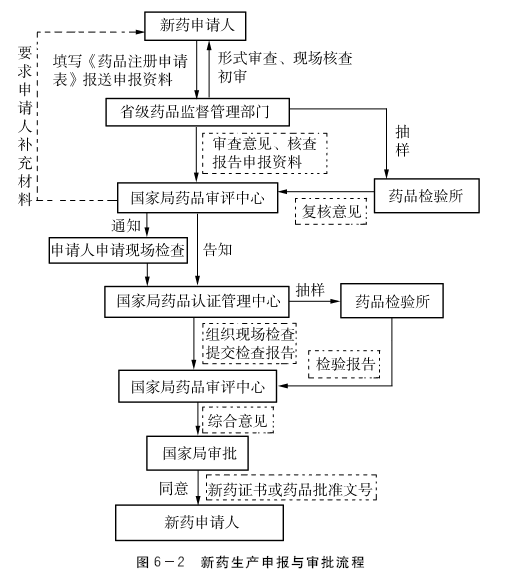
2.新药生产的申报和审批程序
(1)申请人完成药物临床试验后,应当填写《药品注册申请表》,向所在地省、自治区、直辖市药品监督管理部门报送申请生产的申报资料,并同时向中国药品生物制品检定所报送制备标准品的原材料及有关标准物质的研究资料。
(2)省、自治区、直辖市药品监督管理部门应当对申报资料进行形式审查,符合要求的,出具药品注册申请受理通知书;不符合要求的,出具药品注册申请不予受理通知书,并说明理由。
(3)省、自治区、直辖市药品监督管理部门应当自受理申请之日起5日内组织对临床试验情况及有关原始资料进行现场核查,对申报资料进行初步审查,提出审查意见。除生物制品外的其他药品,还需抽取3批样品,向药品检验所发出标准复核的通知。
(4)省、自治区、直辖市药品监督管理部门应当在规定的时限内将审查意见、核查报告及申报资料送交国家食品药品监督管理总局药品审评中心,并通知申请人。
(5)药品检验所应对申报的药品标准进行复核,并在90日内将复核意见送交国家食品药品监督管理总局药品审评中心,同时抄送通知其复核的省、自治区、直辖市药品监督管理部门和申请人。
(6)国家食品药品监督管理总局药品审评中心收到申报资料后,应当在150日(获准进入特殊审批程序的品种120日)内组织药学、医学及其他技术人员对申报资料进行审评,必要时可以要求申请人补充资料,并说明理由。
(7)经审评符合规定的,国家食品药品监督管理总局药品审评中心通知申请人申请生产现场检查,并告知国家食品药品监督管理总局药品认证管理中心;经审评不符合规定的,国家食品药品监督管理总局药品审评中心将审评意见和有关资料报送国家食品药品监督管理总局,国家食品药品监督管理总局依据技术审评意见,做出不予批准的决定,发给《审批意见通知件》,并说明理由。
(8)申请人应当自收到生产现场检查通知之日起6个月内向国家食品药品监督管理总局药品认证管理中心提出现场检查的申请。
(9)国家食品药品监督管理总局药品认证管理中心在收到生产现场检查的申请后,应当在30日内组织对样品批量生产过程等进行现场检查,确认核定的生产工艺的可行性,同时抽取1批样品(生物制品抽取3批样品),送进行该药品标准复核的药品检验所检验,并在完成现场检查后10日内将生产现场检查报告送交国家食品药品监督管理总局药品审评中心。
(10)样品应当在取得《药品生产质量管理规范》认证证书的车间生产;新开办药品生产企业、药品生产企业新建药品生产车间或者新增生产剂型的,其样品生产过程应当符合《药品生产质量管理规范》的要求。
(11)药品检验所应当依据核定的药品标准对抽取的样品进行检验,并在规定的时间内将药品注册检验报告送交国家食品药品监督管理总局药品审评中心,同时抄送相关省、自治区、直辖市药品监督管理部门和申请人。(https://www.daowen.com)
(12)国家食品药品监督管理总局药品审评中心依据技术审评意见、样品生产现场检查报告和样品检验结果,形成综合意见,连同有关资料报送国家食品药品监督管理总局。国家食品药品监督管理总局依据综合意见,做出审批决定。符合规定的,发给新药证书,申请人已持有《药品生产许可证》并具备生产条件的,同时发给药品批准文号;不符合规定的,发给《审批意见通知件》,并说明理由。改变剂型但不改变给药途径,以及增加新适应证的注册申请获得批准后不发给新药证书;靶向制剂、缓释、控释制剂等特殊剂型除外。
新药生产申报与审批流程见图6-2 。
(二)新药审批有关规定
1.对下列新药申请可实行快速审批
(1)新的中药材及其制剂,中药或者天然药物中提取的有效成分及其制剂。
(2)未在国内外获准上市的化学原料药及其制剂、生物制品。
(3)抗艾滋病病毒及用于诊断、预防艾滋病的新药,治疗恶性肿瘤、罕见病等的新药。
(4)治疗尚无有效治疗手段的疾病的新药。
2.对报送材料的要求 申请新药注册所报送的资料应当完整、规范,数据必须真实、可靠;引用文献资料应当注明著作名称、刊物名称及卷、期、页等;未公开发表的文献资料应当提供资料所有者许可使用的证明文件。外文资料应当按照要求提供中文译本。
3.联合研制的新药申报 多个单位联合研制的新药,可以由其中的一个单位申请注册,其他的单位不得重复申请。需要联合申请注册的,应当共同署名作为该新药的申请人。除加快审批创新药物外,新药申请批准后每个品种只能由一个单位生产,同一品种的不同规格不得分由不同单位生产。
4.新药的药品说明书 药品说明书由CFDA根据申请人申报的资料核准。药品生产企业应当对药品说明书的正确性与准确性负责,并应当跟踪药品上市后的安全性、有效性情况,必要时应当及时提出修改药品说明书的申请。药品说明书必须按照CFDA的规定印制。
(三)新药再注册
新药批准文号有效期5年,有效期届满,需要继续生产的,申请人应当在有效期届满前6个月申请再注册。再注册申报审批由CFDA委托省级食品药品监督管理局负责。
知识链接
关于药品注册专员的职业要求
北京市食品药品监督管理局2006年出台了《北京市药品注册专员登记办法》,其对药品注册专员的职业要求如下:
教育培训:药品注册是一项专业化程度较高的工作,需药品注册专员在药化、药理、药剂、生化制药多个领域有所涉猎。
工作经验:对法律法规有充分了解。除了熟悉《药品管理法》《药品注册管理办法》外,还需要对其他相关,甚至非医药行业的法律条文有充分的认识,如《药品进口管理办法》《知识产权保护法》等。具备良好的沟通协调能力。熟悉CFDA、药检所、海关等的工作流程,并能快速、有效地与之沟通。此外,越来越多企业,特别是跨国业务较多的部门,要求从业人员具有较强的英文听、说、读、写能力,以适应进口药品和国际
临床申报业务的需求;而计算机办公软件的熟练运用也成为信息时代不可或缺的基础条件。
(资料来源:百度文库 2007年)
