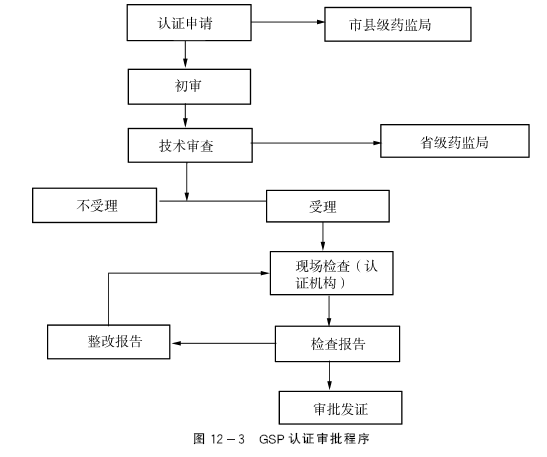
GSP认证的程序
(一)认证的申请与受理
符合规定条件的企业申请GSP认证,应填报《药品经营质量管理规范认证申请书》及相关材料。
药品经营企业将认证申请书及资料报所在地设区的市级药品监督管理机构或者省、自治区、直辖市药品监督管理部门直接设置的县级药品监督管理机构(以下简称初审部门)进行初审。初审部门应在收到认证申请书及资料起10个工作日内完成初审,初审合格的将其认证申请书和资料移送省、自治区、直辖市药品监督管理部门审查。省、自治区、直辖市药品监督管理部门在收到认证申请书及资料之日起25个工作日内完成审查,并将是否受理的意见填入认证申请书,在3个工作日内以书面形式通知初审部门和申请认证企业。不同意受理的,应说明原因。对同意受理的认证申请,省、自治区、直辖市药品监督管理部门应在通知初审部门和企业的同时,将认证申请书及资料转送本地区设置的认证机构。
(二)现场检查
认证机构收到省、自治区、直辖市药品监督管理部门转送的企业认证申请书和资料之日起15个工作日内,应组织对企业的现场检查。检查前,应将现场检查通知书提前3日发至被检查企业。应按照预先规定的方法,从认证检查员库随机抽取3名GSP认证检查员组成现场检查组。检查组依照《GSP认证现场检查工作程序》《GSP认证现场检查评定标准》和《GSP认证现场检查项目》实施现场检查,检查结果将作为评定和审核的主要依据。
现场检查结束后,检查组应依据检查结果做出检查结论并提交检查报告。通过现场检查的企业,应针对检查结论中提出的缺陷项目提交整改报告,并于现场检查结束后7个工作日内报送认证机构。(https://www.daowen.com)
(三)审批与发证
认证机构在收到审核意见之日起10个工作日内进行审查,送交省、自治区、直辖市药品监督管理部门审批。省、自治区、直辖市药品监督管理部门在收到审核意见之日起15个工作日内进行审查,做出认证是否合格或者限期整改的结论。省、自治区、直辖市药品监督管理部门在进行审查前应通过媒体向社会公示。在审查规定期限内,对该企业没有投诉、举报等问题,可根据审查结果做出认证结论。对认证合格的企业,省、自治区、直辖市药品监督管理部门应向企业颁发《药品经营质量管理规范认证证书》。证书有效期5年,有效期满前3个月内,由企业提出重新认证的申请。省、自治区、直辖市药品监督管理部门依照本办法的认证程序,对申请企业进行检查和复审,合格的换发证书。审查不合格以及认证证书期满但未重新申请认证的,应收回或撤销原认证证书。
GSP认证审批程序见图12-3。