五 教学过程
(一)创设情境,引入课题
1.播放视频。《中国第一颗原子弹成功爆炸》,主要内容为:1964年10月16日15时,中国第一颗原子弹成功爆炸,向世界展现出中国人民强大的创造力,全国人民欢呼!
2.教师引入。原子弹的威力,其实是由咱们肉眼都看不到的原子为基石的。这小小的原子究竟是怎样的结构,竟然能蕴含如此强大的力量?这节课我们进入新课——课题2《原子的结构》的学习。
课堂观察
视频观看过程,学生注意力非常集中,脸上洋溢着兴奋和自豪,学习热情高涨,对原子的内部结构充满好奇。
(二)课前复习,链接新知
1.复习回顾。学生完成导学案上原子知识的回顾。
2.教师提问。原子非常小,而且它在化学变化中不可再分,那它是不是在任何情况下都不可再分呢?
大部分学生对原子的特点掌握较好,回顾很顺利。
课堂观察
(三)新知学习,深入探索
——认识原子模型
1.教师引入。人类对原子模型的认识经历过漫长的艰辛探索阶段,请大家阅读以下化学史表格材料,画出对应的原子模型。
2.自主探究。学生阅读表格,并画出每个阶段的原子模型。
原子模型结构的探索历程

2.教师点评。学生整体完成得较好,教师集中点评与表扬。
课堂观察
学生认真阅读材料,并在材料的引导下画出不同的原子模型的结构,有少部分同学将道尔顿实心球模型画成了空心模型。
——合作学习:展示原子结构框图
1.教师引导。沿着伟大化学家们的步伐,我们初步认识了原子的结构,现在请小组合作,完成以下原子结构的填写。
2.小组合作。学生小组合作完成原子结构框图,学生代表在黑板上完成框图的填写。

3.教师视导。教师手持自制原子结构模型教具,巡视学生的讨论、书写情况,给予针对性的指导与点拨。
4.教师点评。点评黑板上的答案和其他小组的答案,及时表扬。
课堂观察
学生对原子内带电粒子不太清楚,教师展示自制原子结构模型中微粒的带电性都有标示,及时而高效地解决学生的困惑。
——合作探究:探究原子内的微粒数量关系
1.教师引导。对原子结构的模型有初步感知之后,我们继续来探究原子内的微粒数量关系,请大家思考并讨论以下三个问题:
原子核所带的正电荷从何而来?
原子核所带的正电荷数与质子数有什么关系?
原子核所带正电荷与电子数有什么关系?
2.互动小结。由于原子核所带的正电荷(即核电荷)和核外电子所带的负电荷电性相反,电荷数相同,因此整个原子不显电性。在原子中,质子数=核电荷数=电子数。
3.合作探究。观察以下表格,找一找原子内部的微粒之间又有什么关系和规律?小组讨论以下三个问题。
几种原子内部的微粒数量关系
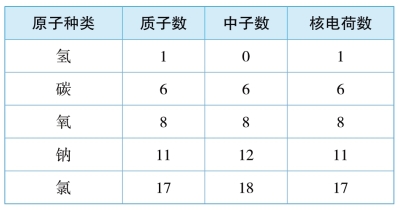
不同种原子之间有什么区别?
所有原子都是由质子、中子、电子构成的吗?
质子数与中子数一定相等吗?
4.教师释疑。对学生讨论中出现的问题,集中点评与讲解。
课堂观察
原子内的微粒数量关系比较抽象,从学生的课堂反应来看,该知识点对学生来说比较难,因此教师应及时补充讲解与指导。
——习题检测
1.习题巩固。学生完成4道练习题。
2.教师视导。教师在学生完成习题过程中及时视导,了解学生们对原子结构的掌握程度,投影展示学生的答案。
课堂观察
课堂练习侧重基础知识,大部分学生完成得较好。
——讲解新知:原子内电子的排布规律
1.教师讲解。教师借助自制原子理想模型,讲解电子分层排布的特点,并补充电子绕核高速运动的动画视频,提高学生对真正的电子层和电子排布的认识。
2.学生聆听。聆听教师讲解,观看视频,思考。
课堂观察
通过模型和视频,大部分学生能初步理解原子内电子排布的特点,并能跟得上教师的讲解,少部分学生注意力开始分散。
——讲解新知:原子结构示意图
1.教师过渡。原子的结构已经清晰地浮现在我们的脑海里,那有没有什么方法能让原子的结构形象地跃然于我们的纸上呢?
2.学生思考。思考,尝试作答。
3.教师引导。借助自制的立体的钠原子模型,以钠原子为例,讲解原子结构示意图的表示方法。
课堂观察
大部分学生认真听讲,并能较快回答教师的互动性问题,一部分学生安静地倾听,另有少部分同学产生了疲累。
——小组活动:绘示意图,做原子模型
1.画示意图。每个学生桌面有两张纸,纸上有原子名称,每个小组写出对应的原子的符号,并用彩笔画出相应的原子结构示意图。
2.教师点评。教师巡视小组内的完成情况,给予指导;收集优秀作品,粘贴在黑板上当堂展示,并及时表扬。
3.制作模型。学生根据桌面上现有材料:细铁丝和三种颜色的黏土,根据刚才所画的原子结构示意图,做出对应的原子结构模型。
4.成果分享。两名学生上台分享,学生1:“这中间的部分就是原子核,它是由质子和中子组成,大家看,这绿色的黏土代表质子,黄色的黏土代表的就是中子;我们用红色的黏土表示电子,第1层电子层有2个电子,第2层电子层就有8个电子,最外层电子层是3个电子,这是铝原子的结构模型。”
学生2:“看,我们组做的是镁原子的结构模型,它的原子核是由12个质子和12个中子构成的,而电子数等于质子数,也是12个。它拥有3个电子层,第1层只能容纳2个电子,第2层最多为8个电子,所以它最外层电子层还有2个电子。”
5.教师点评。这两组做出来的模型和讲解都非常棒!但是第1组代表刚才说“原子核是由质子和中子组成”,需要纠正,微观粒子是“构成”,宏观才用“组成”,动词的描述请大家注意。
课堂观察
小组合作画出原子结构示意图,学生心情愉悦,全体精神状态有所提高;做原子模型是整节课堂学生最积极活跃的环节,学生讨论激烈,热情高涨,参与度非常高,完成情况非常好。
——课堂小结
互动小结,回顾原子的结构、电子排布规律和原子结构示意图。
课堂观察
经过动手实操后,课堂小结部分非常顺利,学生都能很快回顾出相关知识,顺利达成了本节课的教学目标。
