2.1.1 限制性核酸内切酶的发现与种类
核酸酶是通过切割相邻两个核苷酸残基之间的磷酸二酯键,从而导致多核苷酸链发生断裂的一类水解酶。根据其作用底物不同,可分为特异水解断裂DNA分子的脱氧核糖核酸酶(deoxyribonuclease,DNase)和专门水解断裂RNA分子的核糖核酸酶(ribonuclease,RNase)。按水解断裂分子的方式不同,又可分为以下两类:一类是从核酸分子末端开始逐个消化降解多核苷酸链,称为核酸外切酶(exonuclease);另一类是从核酸分子内部切割磷酸二酯键使之断裂成小片段,称为核酸内切酶(endonuclease)。
1.限制性核酸内切酶的发现
限制性核酸内切酶,又称限制性内切酶或限制酶,是一类能够识别双链DNA分子中的某种特定核苷酸序列,并由此切割DNA双链结构的核酸内切酶。那么其中的“限制性”究竟意味着什么呢?
早在20世纪50年代初期,许多学者就发现这样的一个现象:X型菌株能够辨别在该菌株生长的和在别的Y型菌株生长的噬菌体,而且还能阻止在后者生长的噬菌体对其的感染。为了便于叙述,将在X型菌株上生长的噬菌体用Px表示。其中以λ噬菌体表现的现象最具有代表性和普遍性。那些在大肠杆菌B菌株(Escherichia coli B,E.coli B)中生长得很好的λ噬菌体(λ(B))在K菌株(E.coli K)中生长时,其感染频率(efficiency of plate,EOP)由1下降到10-4,也就是说,λ(B)噬菌体受到K菌株的限制(restriction)。一旦λ(B)噬菌体在K菌株中感染成功,由K菌株繁殖出来的噬菌体后代在第二轮接种中便能像λ(K)噬菌体一样高效感染K菌株,而没有再次受到限制,这种现象称为修饰(modification)。但它不再高频感染它原来的宿主B菌株。无论是限制还是修饰,两者都是由宿主控制的,将其统称为宿主控制的限制和修饰现象(host controlled restriction and modification,R-M)(图2-1)。
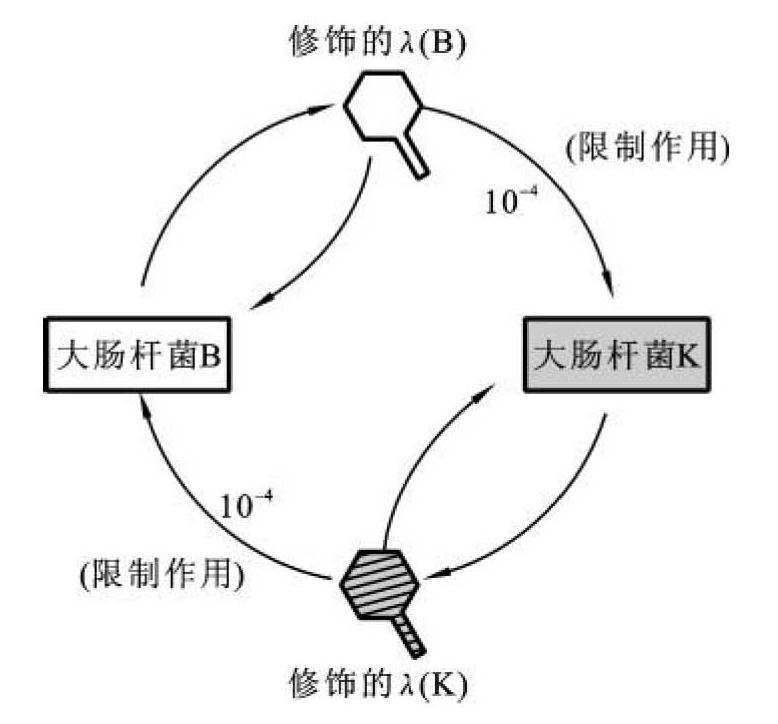
图2-1 大肠杆菌宿主控制的限制与修饰体系
10年后,终于弄清了细菌限制和修饰作用的分子机制。在细菌细胞内同时存在两种酶,即限制性核酸内切酶和修饰性甲基化酶,两者共同构成细菌的限制-修饰系统。限制性核酸内切酶是一种位点特异性核酸酶,它能识别DNA分子上的特定位点并将DNA双链切断;修饰性甲基化酶能催化甲基从其给体分子S-腺苷甲硫氨酸(S-adenosylmethionine,SAM)转移给限制酶识别序列的特定碱基,使之发生甲基化,由于限制性核酸内切酶无法识别甲基化的序列,因而不能再进行切割。λ(K)和λ(B)长期寄生在大肠杆菌的K菌株和B菌株,宿主细胞内的甲基化酶已将其染色体DNA和噬菌体DNA特异性保护,封闭了自身所产生的限制性核酸内切酶的识别位点,因而避免了限制性核酸内切酶对宿主本身DNA和噬菌体DNA的破坏。当外来DNA入侵时,便遭到宿主限制性核酸内切酶的特异性降解。在降解过程中,总有极少数入侵的DNA分子幸免于难而得以在宿主甲基化酶存在的条件下复制,并在复制过程中被宿主的甲基化酶修饰。此后,入侵噬菌体的子代便能高频感染同一宿主菌株,但丧失其在原来宿主细胞中的存活力,因它们在接受新宿主菌甲基化修饰的同时,也丧失了原宿主菌甲基化修饰的标记。
宿主控制的限制和修饰现象是广泛存在的,它的存在有两方面的作用:一是对外源DNA进行限制性降解;二是对自身DNA进行限制性修饰而不被降解。也就是说,限制-修饰系统既对外源DNA进行限制,构筑了细菌种属和菌株之间进行交叉繁殖的屏障,又允许外源DNA中有一些通过,这又有利于生物的进化。正是这些限制性核酸内切酶的发现使得基因工程成为可能,这是跨时代的突破。在基因工程中,我们需要采用缺少限制作用的菌株作为受体,以保证基因操作的顺利进行。
2.限制性核酸内切酶的种类
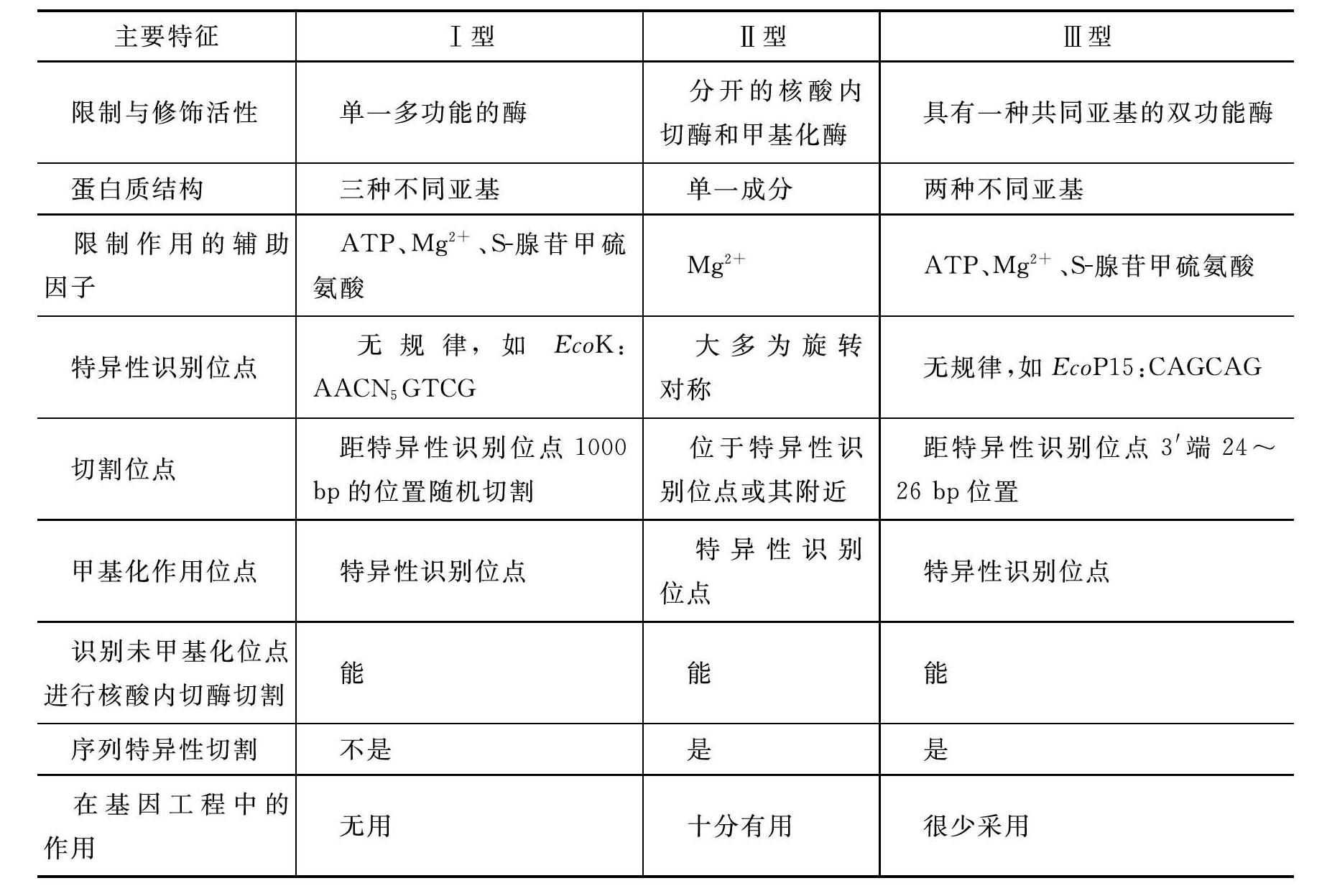
目前所发现的限制性核酸内切酶,根据其性质不同可分为三大类:Ⅰ型酶、Ⅱ型酶和Ⅲ型酶。三类限制性核酸内切酶的主要特征见表2-1。
表2-1 限制性核酸内切酶的类型及主要特征
1)Ⅰ型限制性核酸内切酶
1968年,M.Meselson和R.Yuan从E.coli K菌株中分离得到的第一种限制性核酸内切酶EcoK,就是一种Ⅰ型限制性核酸内切酶。Ⅰ型酶只占1%。(https://www.daowen.com)
Ⅰ型酶是一种复合功能酶,既具有核酸内切酶的活性,又具有甲基化酶的活性,即同时具有限制和修饰功能,需要Mg2+、ATP、SAM作为催化反应的辅助因子。Ⅰ型酶是大型的多亚基的蛋白质复合物。例如,EcoK和EcoBⅠ型酶,都是异源多聚体,它们均由三种不同的亚基组成,其中特异性亚基(S亚基)具有特异性识别DNA序列的活性,修饰亚基(M亚基)具有甲基化酶的活性,限制亚基(R亚基)具有核酸内切酶的活性。它们分别由hsdS、hsdR、hsdM基因编码,属于同一操纵子。EcoK的结构为R2 M2 S,EcoB的结构为R2 M4 S2。
Ⅰ型酶能识别专一的核苷酸序列,长度为十几个核苷酸,在距识别位点5'一侧数千碱基处随机切割DNA分子。Ⅰ型酶甲基化作用可以在DNA两条链上同时进行,甲基的供体是S-腺苷甲硫氨酸。例如EcoB酶的识别位点是TGA*N8TGCT(N表示任意碱基),甲基化位点是第3个A碱基,在距识别序列1000 bp处进行切割。
Ⅰ型酶只特定地识别DNA序列,而切割位点不特异,因而在基因工程中用处不大。
2)Ⅲ型限制性核酸内切酶
现在知道的Ⅲ型限制性核酸内切酶的种类更少,所占比例不到1%。Ⅲ型酶是由2个亚基组成的蛋白质复合物,具有核酸内切酶和甲基化酶活性,其中M亚基负责位点的识别和修饰,R亚基则具有核酸酶活性。Ⅲ型酶在与识别位点结合后,其修饰作用与限制作用取决于两个亚基之间的竞争。酶的切割活性需要Mg2+、ATP、SAM等辅助因子,切割位点位于识别位点一侧的若干碱基对处,但无序列特异性,只与识别位点的距离有关,不同的Ⅲ型酶具有各自不同的距离,7~26 bp不等。如Mbo Ⅱ识别序列是5'AAGA3',其切割位点则是:
5'-GAAGANNNNNNNN ↓ N-3'
3'-CTTCTNNNNNNN ↓ NN-5'
产生仅一个碱基的突出末端,具有不确定性。
Ⅲ型酶虽然有专一的识别序列,但切割无特异性,切割后产生的DNA片段具有各种单链末端,因而在基因克隆中很少使用。
3)Ⅱ型限制性核酸内切酶
1970年,H.O.Smith等首先从流感嗜血菌Rd菌株分离出Ⅱ型限制性核酸内切酶。Ⅱ型酶所占比例最大,可达93%。Ⅱ型酶需Mg2+的存在才能发挥活性,相应的修饰酶只需SAM。Ⅱ型酶不但能特异性识别DNA序列,而且在特定位点切割,识别和切割位点的特异性使其成为重组DNA技术中最常用的工具酶,并被誉为“分子手术刀”。如果没有专门说明,通常所说的限制性核酸内切酶指的就是Ⅱ型酶。
