7.1.2 原核生物的翻译
蛋白质生物合成又称翻译,是指以新生的mRNA为模板,把四种核苷酸编码的遗传信息解读为蛋白质一级结构中20种氨基酸排列顺序的过程。
1.遗传密码及其基本特性
遗传密码又称密码子、遗传密码子、三联体密码,是指mRNA分子上从5'端到3'端方向,由翻译起始位点开始,每相邻3个核苷酸组成的三联体。由A、G、C、U这四种核苷酸可组合成64个密码子,其中AUG既可以编码多肽链内部的甲硫氨酸,又可作为多肽合成的起始信号,称为起始密码子。而另有3个密码子(UAA、UAG和UGA)不编码任何氨基酸,只作为肽链合成终止的信号,称为终止密码子。有61个密码子编码20种氨基酸,称为有义密码子。从mRNA 5'端起始密码子AUG到3'端终止密码子之间的核苷酸序列,各个密码子连续排列编码一个蛋白质多肽链,称为开放阅读框(open reading frame,ORF)。
遗传密码具有以下几个重要特点。
1)连续性
编码蛋白质氨基酸序列的各个密码子连续阅读,密码间既无间断也无交叉。基于遗传密码的连续性,如基因损伤引起mRNA阅读框内的碱基发生插入或缺失,可能导致框移突变,造成下游翻译产物氨基酸序列的改变。多种生物基因转录后存在一种对mRNA的加工过程,可通过特定碱基的插入、缺失或置换,导致mRNA的转码、错义突变或提前终止,造成mRNA与其DNA模板序列之间不匹配,使同一mRNA前体翻译出序列、功能不同的蛋白质。这种基因表达的调节方式称为mRNA编辑(mRNA editing)。
2)简并性
遗传密码表显示,每组密码仅编码一种氨基酸,但除甲硫氨酸和色氨酸只对应1个密码子外,其他氨基酸都有2、3、4或6个密码子为之编码,这称为遗传密码的简并性。比较编码同一氨基酸的几组三联体简并密码可发现:第一、二位碱基多相同,前两位碱基决定编码氨基酸的特异性,而仅第三位碱基存在差异。如丙氨酸的密码子是GCU、GCC、GCA、GCG,而密码子ACU、ACC、ACA、ACG都编码苏氨酸。对应于这些密码子第三位的碱基变异或突变并不影响所翻译氨基酸的种类。但不同生物在翻译中,对同一氨基酸的几个密码子,可表现某些密码子优先使用的特性,即对密码子的“偏好性”。
3)通用性
蛋白质生物合成的整套密码子,从原核生物到人类都通用。仅发现少数例外,如动物细胞的线粒体中存在独立的基因表达系统,翻译使用的密码子和通用密码子间有一定差别。如用AUA兼作甲硫氨酸密码子和起始密码子,终止密码子可为AGA、AGG,而UGA编码色氨酸等。密码子的通用性进一步证明各种生物进化自同一祖先。
4)摆动性
转运氨基酸的tRNA的反密码子需要通过碱基互补与mRNA上的遗传密码反向配对结合,但反密码子与密码子间不严格遵守常见的碱基配对规律,这称为摆动配对。按5'→3'阅读密码规则,摆动配对在反密码子的第一位碱基与密码子的第三位碱基间更常见。如tRNA的反密码子第一位有稀有碱基次黄嘌呤出现,可分别与密码子第三位U、C、A配对。摆动配对的碱基间形成的是特异、低键能的氢键,有利于翻译时tRNA迅速与密码子分离。这使一种tRNA能识别mRNA的1~3种简并性密码子,据计算最少32种tRNA即可满足对61种有意义密码子的识别。
2.蛋白质生物合成的分子基础
1)mRNA是蛋白质生物合成的模板
(1)原核生物mRNA的半衰期短。细菌基因的转录与翻译是紧密联系的,一旦基因转录开始,核糖体就结合到新生mRNA链的5'端,启动蛋白质的合成。因为基因转录和多肽链延伸的速率基本相同,所以细胞内某一基因的产物(蛋白质)的多少取决于转录和翻译的起始效率。
(2)原核生物mRNA大多数以多顺反子的形式存在。原核生物一条mRNA可以同时编码几个不同的蛋白质。对于第一个顺反子来说,一旦mRNA的5'端被合成,翻译的起始位点即可与核糖体相结合,而后面的几个顺反子的翻译的起始就会受其上游顺反子结构的控制。此外,原核生物多顺反子基因中后续编码区的翻译起始受顺反子之间距离的影响。当两个顺反子之间的距离较远时,前一顺反子翻译的终止与后一顺反子翻译的起始是相互独立的;当两个顺反子之间的距离较近时,前一顺反子翻译的终止与后一顺反子翻译的起始是相衔接的。
(3)原核生物mRNA的5'端无帽子结构,3'端没有或只有较短的poly(A)结构。原核细胞mRNA起始密码子AUG的上游7~12个核苷酸处含有一段富有嘌呤碱基的序列,称为SD序列(Shine-Dalgarno sequence),它可与16S rRNA 3'端富嘧啶区序列互补。SD序列是核糖体的结合位点(ribosome-binding site,RBS),是原核细胞翻译起始所必需的。SD序列与起始密码子AUG之间的距离是影响mRNA翻译成蛋白质的重要因素之一。某些蛋白质与SD序列结合也会影响mRNA与核糖体的结合,从而影响蛋白质的翻译。
2)核蛋白体是多肽链合成的装置
核糖体是细胞内进行蛋白质合成的场所,在蛋白质合成中起着中心作用。不论何种来源的核糖体,均由rRNA和一定数量的蛋白质组成,其中rRNA对核糖体结构的形成和功能的发挥都起着重要作用。
所有生物的核糖体都由大、小两个亚基构成,但原核生物和真核生物不同来源的核糖体还是有差别的。原核生物的核糖体沉降系数为70S,由30S小亚基和50S大亚基两部分组成。30S小亚基由1个16S rRNA和21种蛋白质组成,50S大亚基则由2个rRNA(5S和23S)和36种蛋白质组成。70S核糖体的立体结构类似椭圆体。游离状态的核糖体结构和蛋白质合成过程中的核糖体结构有区别,说明核糖体的结构在蛋白质合成过程中有一定的柔韧性。在核糖体上有3个tRNA结合位点,分别称为A位点(aminoacyl site)、P位点(peptidyl site)和E位点(exit site)。其中,A位点是接受氨酰-tRNA位点,P位点是接受肽酰-tRNA位点,E位点是空载tRNA离去的位点。在核糖体中,tRNA的移动顺序是从A位点到P位点再到E位点,通过密码子与反密码子之间的相互作用保证反应正向进行而不会倒转。
3)tRNA
tRNA在蛋白质的合成中处于关键的地位,它不但为每个密码子翻译成氨基酸提供结合体,还为准确无误地将所需氨基酸运送到核糖体上提供运送载体,所以它又被称为第二遗传密码。所有的tRNA都具有共同的特征:存在经过特殊修饰的碱基,3'端都以CCA-OH结束。
tRNA的二级结构呈三叶草形,在三叶草形tRNA分子上有4条根据它们的结构或已知功能命名的手臂:①受体臂:位于3'端-CCA序列,是tRNA上的氨基酸接受位点。②TΨC臂:负责核糖体上的rRNA识别。③反密码子臂:负责对密码子的识别与配对。④D臂:负责和氨基酰tRNA聚合酶结合。还有些tRNA在TΨC臂和反密码子臂之间存在多余臂。多余臂的生物学功能尚不清楚。
tRNA的三级结构呈倒L形,这种结构是靠氢键来维持的。tRNA的三级结构与AA-tRNA合成酶对tRNA的识别有关。tRNA的主要功能是转运活化的氨基酸。通过自身的反密码子和携带的相应氨基酸,将核酸中携带的遗传信息解码成具有活性的蛋白质分子。
4)氨基酰-tRNA合成酶
氨基酸活化过程,即氨基酸与特异tRNA结合形成氨基酰-tRNA的过程。这一化合反应由氨基酰-tRNA合成酶催化完成。
氨基酰-tRNA合成酶催化氨基酰-tRNA合成过程分为两步。
第一步:氨基酸活化生成酶-氨基酰腺苷酸复合物。
氨基酸+ATP+E→氨基酰-AMP-E+PPi
第二步:生成氨基酰-tRNA。
氨基酰-AMP-E+tRNA→氨基酰-tRNA+AMP+E
反应中氨基酸的α-羧基与tRNA的3'端氨基酸臂-CCA的腺苷酸3'-OH以酯键连接,形成氨基酰-tRNA。细胞中的焦磷酸酶不断分解该反应生成的PPi,促进反应持续向右进行。
氨基酸与tRNA分子的正确结合,是维持遗传信息准确翻译为蛋白质过程保真性的关键步骤之一,氨基酰-tRNA合成酶在其中起着主要作用。氨基酰-tRNA合成酶对底物氨基酸和tRNA都有高度特异性。此外,氨基酰-tRNA合成酶具有校正活性,即该酶可将反应任一步骤中出现的错配加以改正。(https://www.daowen.com)
3.原核生物的蛋白质生物合成
氨基酸在核糖体上缩合成多肽链是通过核糖体循环而实现的。此循环可分为肽链合成的起始、肽链的延伸和肽链合成的终止三个主要过程。下面以E.coli细胞为例,来说明原核细胞的蛋白质合成过程。
1)肽链合成的起始
(1)三元复合物的形成:原核生物mRNA在30S亚基上定位涉及两种机制。其一,在各种原核mRNA起始密码子AUG上游8~13个核苷酸部位,存在AGGAGG的SD序列。而30S亚基16S rRNA3'端含有UCCUCC序列,该序列与SD序列碱基配对,使mRNA与小亚基结合。该结合反应是由起始因子3(IF3)介导的,形成(IF3)-30S亚基-mRNA三元复合物。其二,mRNA上紧接SD序列的小核苷酸序列,可被核蛋白体小亚基蛋白rpS-1识别结合。上述RNA-RNA、RNA-蛋白质相互作用使mRNA的起始密码子AUG在核蛋白体小亚基上精确定位,形成复合物。
(2)30S前起始复合物的形成:在起始因子2(IF2)的作用下,甲酰蛋氨酸-起始型tRNA(fMet-tRNAifMet)与mRNA分子中的起始密码子(AUG或GUG)结合,即密码子与反密码子相互反应。同时IF3从三元复合物脱落,形成30S前起始复合物,即(IF2)-30S亚基-mRNA-(fMet-tRNAifMet)复合物。
(3)70S起始复合物形成:50S亚基与上述的30S前起始复合物结合,同时IF2脱落,形成70S起始复合物,即30S亚基-mRNA-50S亚基-(fMet-tRNAifMet)复合物。此时fMettRNAifMet占据着50S亚基的肽酰位(P位点),而50S的氨基酰位(A位点)暂为空位。起始因子1(IF1)在70S起始复合物形成后促进IF2的释放,从而完成蛋白质合成的起始(图7-2)。
2)肽链合成的延长
这一过程包括进位、肽键形成、脱落和移位共四个步骤。肽链合成的延长需两种延长因子(elongation factor,EF),分别称为EF-T和EF-G。
(1)进位:新的氨基酰-tRNA进入50S大亚基A位点,并与mRNA分子上相应的密码子结合。在70S起始复合物的基础上,原来结合在mRNA上的fMet-tRNAifMet占据着50S亚基的P位点(当延长步骤循环进行两次以上时,在P位点则为肽酰-tRNA),新进入的氨基酰-tRNA则结合到大亚基的A位点,并与mRNA上起始密码子随后的第二个密码子结合。此步骤需GTP、EF-T及Mg2+的参与。
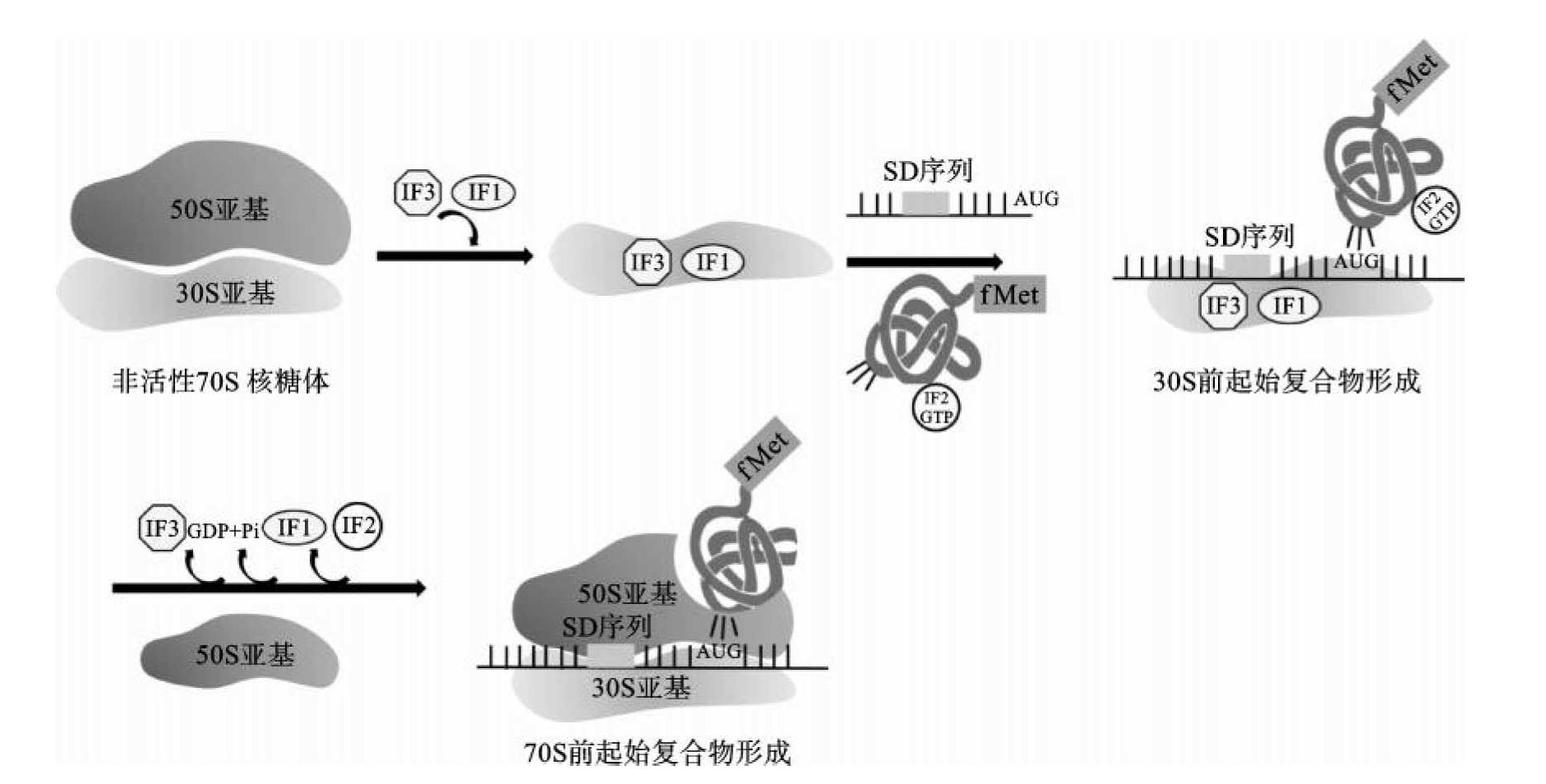
图7-2 肽链合成的起始过程示意图
(2)肽键形成:在大亚基上肽酰转移酶的催化下,将P位点上的tRNA所携带的甲酰蛋氨酰(或肽酰基)转移给A位点上新进入的氨基酰-tRNA的氨基酸,即由P位点上的氨基酸(或肽)的3'端氨基酸提供α-COOH,与A位点上的氨基酸的α-NH2形成肽链。此后,在P位点上的tRNA成为无负载的tRNA,而A位点上的tRNA负载的是二肽酰基或多肽酰基。此步骤需Mg2+及K+的存在。
(3)脱落:50S亚基P位点上无负载的tRNA(如tRNAifMet)脱落。
(4)移位:在EF-G和GTP的作用下,核糖体沿mRNA链(5'→3')作相对移动。每次移动相当于一个密码子的距离,使得下一个密码子能准确地定位于A位点处。与此同时,原来处于A位点上的二肽酰tRNA转移到P位点上,空出A位点。随后再依次按上述的进位、肽键形成和脱落步骤进行下一循环,即第三个氨基酰-tRNA进入A位点,然后在肽酰转移酶催化下,P位点上的二肽酰tRNA又将此二肽基转移给第三个氨基酰-tRNA,形成三肽酰tRNA。同时,卸下二肽酰的tRNA又迅速从核糖体脱落。延长过程每重复一次,肽链就延伸一个氨基酸残基。多次重复,就使肽链不断地延长,直至增长到终止密码子。实验已经证明,mRNA上的信息阅读是从多核苷酸链的5'端开始的,而肽链的延伸是从N端开始的。
3)肽链合成的终止
肽链合成的终止需终止因子或释放因子(releasing factor,RF)参与。在E.coli中已分离出三种RF:RF1、RF2和RF3。其中,RF1和RF2为Ⅰ类释放因子,具有识别mRNA链上终止密码子的能力,催化新合成的多肽链从P位点的tRNA中水解释放出来;RF3为Ⅱ类释放因子,具有在多肽链释放后刺激Ⅰ类释放因子从核糖体上解离出来的能力。释放因子具有GTP酶活性,可以催化GTP水解,使肽链释放,核糖体解聚。
多肽链合成完毕,这时,虽然多肽链仍然附着在核蛋白体及tRNA上,但mRNA上肽链合成终止密码子已在核蛋白体的A位点上出现。释放因子可以识别这些密码子,并在A位点上与终止密码子相结合,从而阻止肽链的继续延伸。RF1和RF2对终止密码子的识别具有一定特异性,RF1可识别UAA和UAG,RF2可识别UAA和UGA。RF与EF在核糖体上的结合部位是同一处,它们重叠的结合部位防止了EF与RF同时结合于核糖体上,而扰乱正常功能。
最后,核蛋白体与mRNA分离,同时,在核蛋白体P位点上的tRNA和A位点上的RF也脱落。与mRNA分离的核蛋白体又分离为大、小两个亚基,可重新投入另一条肽链的合成过程。
4.蛋白质合成后加工和输送
在原核生物中从核蛋白体释放出的新生多肽链大多数本身就具备蛋白质生物活性,但也有部分蛋白质必须经过翻译后加工过程才转变为具有天然构象的功能蛋白。这主要包括对肽链一级结构的修饰、多肽链天然三维构象的折叠和空间结构的修饰等。
1)去除N-甲酰基或N-蛋氨酸
在蛋白质合成过程中,N端氨基酸总是fMet(甲酰蛋氨酸),其α-氨基是甲酰化的。但天然蛋白质大多数不以蛋氨酸为N端第一位氨基酸。细胞内的脱甲酰基酶或氨基肽酶可以除去N-甲酰基、N端蛋氨酸或N端的一段多肽。
2)蛋白质二硫键的正确形成
多肽链内或肽链之间二硫键的正确形成对稳定蛋白质的天然构象十分重要。多肽链的几个半胱氨酸间可能出现错配二硫键,影响蛋白质正确折叠。二硫键异构酶可在肽链中催化错配二硫键断裂,并形成正确二硫键连接,最终使蛋白质形成热力学最稳定的天然构象。在E.coli中,非还原环境的细胞周质与二硫键形成有关。在细胞周质中,含有DsbA、DsbB、DsbC和DsbD等蛋白,其中,DsbA是E.coli细胞周质中的二硫键异构酶。
3)肽酰-脯氨酰顺反异构酶
脯氨酸为亚氨基酸,多肽链中肽酰-脯氨酸间形成的肽键有顺、反两种异构体,空间构象有明显差别。肽酰-脯氨酰顺反异构酶可促进上述顺、反两种异构体之间的转换。天然蛋白肽链中肽酰-脯氨酸间肽键绝大部分是反式构型,仅6%为顺式构型。肽酰-脯氨酰顺反异构酶是蛋白质三维构象形成的限速酶,在肽链合成需形成顺式构型时,可使多肽在各脯氨酸弯折处形成准确折叠。
4)分子伴侣
分子伴侣是细胞中一类保守蛋白质,可识别肽链的非天然构象,促进各功能域和整体蛋白质的正确折叠。细胞中至少有两种分子伴侣家族。①热休克蛋白(heat shock protein,HSP):属于应激反应性蛋白,高温应激可诱导该蛋白质合成增加。热休克蛋白在进化上相对保守,大体有Hsp70、Hsp40和GrpE三个家族。热休克蛋白的主要功能是促进和协助某些能自发性折叠的蛋白质折叠为有天然空间构象的蛋白质。此外,还能避免或消除蛋白质变性后因疏水基团暴露而发生的不可逆聚集,以利于清除变性或错误折叠的多肽中间物。热休克蛋白促进蛋白质折叠的具体机制如下:Hsp40结合待折叠多肽片段,并将多肽导向Hsp70-ATP复合物,Hsp40激活Hsp70的ATP酶活性,水解ATP成ADP,产生稳定的Hsp40-Hsp70-ADP-多肽复合物。而GrpE是核苷酸交换因子,与Hsp40作用,促进ATP交换ADP,使复合物变得不稳定而迅速解离,释出该多肽链片段,进行正确折叠。多肽各区段依次进行上述结合-解离循环,完成折叠过程。②伴侣素(chaperonins):伴侣素是分子伴侣的另一家族,如E.coli的GroEL和GroES(真核细胞中同源物为Hsp60和Hspl0)等家族。其主要作用是为非自发性折叠蛋白质提供能折叠形成天然空间构象的微环境。估计在E.coli中10%~20%的蛋白质折叠需要这一家族辅助。GroEL由2组相对分子质量为6.0×104的同亚基七聚体形成桶状空腔,组成未封闭的复合物。待折叠肽链进入该空腔后,GroES为相对分子质量为1.0×104的同亚基七聚体,可作为“盖子”瞬间封闭GroEL复合物。封闭复合物空腔提供了能完成该肽链折叠的微环境。伴随ATP水解释能,GroEL复合物构象周期性改变,引起GroES“盖子”解离和折叠后肽链释放。重复以上过程,直到蛋白质形成天然空间构象。实际上,分子伴侣并未加快折叠反应速度,而是通过消除不正确折叠,增加功能性蛋白折叠产率来促进天然蛋白质折叠。
5)亚基聚合
具有四级结构的蛋白质由两条以上的肽链通过非共价聚合,形成寡聚体,才能够发挥作用。
6)辅基连接
蛋白质分为单纯蛋白和结合蛋白两类。各种主要的结合蛋白,如糖蛋白、脂蛋白、色蛋白及各种带辅基的酶,合成后都需要结合相应辅基,成为天然功能蛋白质。辅基(辅酶)与肽链的结合过程十分复杂,很多细节尚在研究中。例如在用原核生物表达系统生产某些生理活性糖蛋白时,用基因工程方法表达出其肽链后,还不具备活性。如何使该蛋白质实现糖基化是目前期待解决的关键问题之一。
7)分泌蛋白的靶向输送
新合成的蛋白质只有被运送到各自特定的亚细胞部位或分泌到胞外才具有功能活性,这个过程就称为蛋白质的靶向输送或蛋白质定位。在原核生物中,分泌蛋白是按照翻译转运同步机制(共翻译转运机制)转运的。其机制如下:分泌蛋白的N端有一段特殊的肽段,称为信号肽,它的主要功能是引导多肽链穿过细胞膜进入细胞外的周质空间。在蛋白质合成开始不久后,当N端的新生肽链刚生成时,信号肽就与信号肽识别颗粒(signal recognition particle,SRP)相结合,SRP-核糖体就移动到质膜上,并与质膜上的SRP受体蛋白相结合,将正在合成的含有信号肽的蛋白质连接到质膜的转运通道内。在周质腔表面含有信号肽酶,在信号肽进入周质腔后,肽链合成完成之前,信号肽酶切除信号肽。随后,蛋白质边跨膜边合成,并最终完成蛋白质的合成。同时,蛋白质也分泌到细胞外。
