7.2.4 链霉菌表达系统
链霉菌属于革兰氏阳性菌,它在原核生物中占有特殊的地位。在固体培养基上链霉菌有复杂的形态和生理生命周期。链霉菌还可以产生各种各样的具有生理活性的次级代谢物质。链霉菌从形态分化到次级代谢的产生以及蛋白质的分泌均受着高度的调控。因此,链霉菌可以作为表达外源基因的宿主。研究表明以链霉菌作为宿主,能表达并分泌出具有生物活性的真核基因产物的能力,使链霉菌成为继大肠杆菌、枯草芽孢杆菌之后又一个有价值的基因表达的宿主。
1.链霉菌作为表达系统的特点
链霉菌作为外源基因表达宿主,具有一定的优点和缺点。
链霉菌作为基因工程受体菌的优点:①利用链霉菌进行工业化规模生产抗生素的历史悠久,在工业规模发酵技术方面已积累了相当丰富的经验,因而可利用现有的技术及设备生产链霉菌表达的外源基因产物;②链霉菌产生丰富的胞外酶,这些酶常常直接分泌到培养基中,因而研究这些胞外酶分泌系统并应用于相应的基因工程技术中,使外源基因分泌性表达,可以简化链霉菌产生的外源基因产物的分离和纯化;③链霉菌的生长伴随着形态分化过程,它一直受到科学家的注意和广泛的研究。对链霉菌的分子遗传学研究的长足进展,特别是有关链霉菌质粒的分子生物学、链霉菌启动子、链霉菌蛋白质分泌的信号序列等方面研究的综合进展,给外源基因在链霉菌中的表达提供了理论基础;④在链霉菌中表达出的蛋白质常常是可溶性的,因此无须为了获得具有生物活性的蛋白质而使表达的蛋白质重新溶解并折叠成正确的构型;⑤链霉菌作为基因表达的受体,其致病性小,不产生内毒素。
链霉菌作为基因工程受体菌的缺点:①虽然链霉菌的克隆体系已建立得较为完善,然而在链霉菌中直接引入外源基因的操作如转化等要比大肠杆菌复杂;②大多数链霉菌由于可能存在着限制-修饰系统,一般难以转化或转化率较低;③能与大肠杆菌操作中相比拟的、用于基因表达的启动子和载体,特别是诱导型的超量表达载体的发展还只是刚刚起步;④在链霉菌中表达的真核异源蛋白往往产量较低,达不到工业化生产水平;⑤使外源蛋白糖基化的能力有限。
2.链霉菌表达系统的重要作用元件
1)链霉菌的启动子
(1)链霉菌的启动子的种类:链霉菌基因的启动子结构具有多样性,链霉菌启动子有以下几种类型:①SEP启动子。这类启动子的—10和—35区以及这两个保守区的间隔与大肠杆菌的多数基因启动子的序列类似。②类似于枯草芽孢杆菌的启动子。③有些启动子的—10区与保守性的大肠杆菌启动子相似,但—35区不相似,有的甚至没有—35区。④有些链霉菌启动子序列则与已知的启动子序列没有任何相似性,它们的序列看起来不像启动子,有时甚至随机克隆的片段也可能表现出相当大的启动子活性,可以直接用于启动基因的超量表达。
(2)几种常见的用于外源基因表达的链霉菌启动子。
①galp1启动子(半乳糖诱导启动子):半乳糖操纵子中两个独立的启动子中的一个(图7-5)。在gal基因转录起始位点上游区域中含有一系列核苷酸的六聚体(TNTNAT,N为A、T、C、G中的任何一个)和两对正向重复序列,这些六聚体被认为能与具有一螺旋-转角-螺旋结构的结合蛋白相互作用。这些六聚体核苷酸和正向重复序列中有两个碱基是相互重叠的,六核苷酸Ⅱ或Ⅳ具有TGTGAT序列,分别位于两个碱基的完全正向重复序列内。这两个碱基的完全正向重复序列紧接在—10和—35区的上游。分别将六核苷酸Ⅱ或Ⅳ中处于N位置的碱基进行替换,结果能使依赖于半乳糖的转录启动子控制的转录水平提高。但使六核苷酸Ⅱ或Ⅳ中N位置的碱基同时突变后,在缺乏半乳糖的情况下,转录水平显著提高。另外,含有galp1的高拷贝数质粒可以刺激染色体上控制的结构基因的转录,而染色体上不依赖于半乳糖的由galp1控制的结构基因的转录则不受高拷贝数突变(六核苷酸Ⅱ或Ⅳ同时诱变)的刺激,因此,六核苷酸和正向重复序列在galp1中起调节基因的作用。galp1的负调控表明在高拷贝数的载体中galp1启动子的严谨控制需要多个拷贝的galp1阻遏物基因。
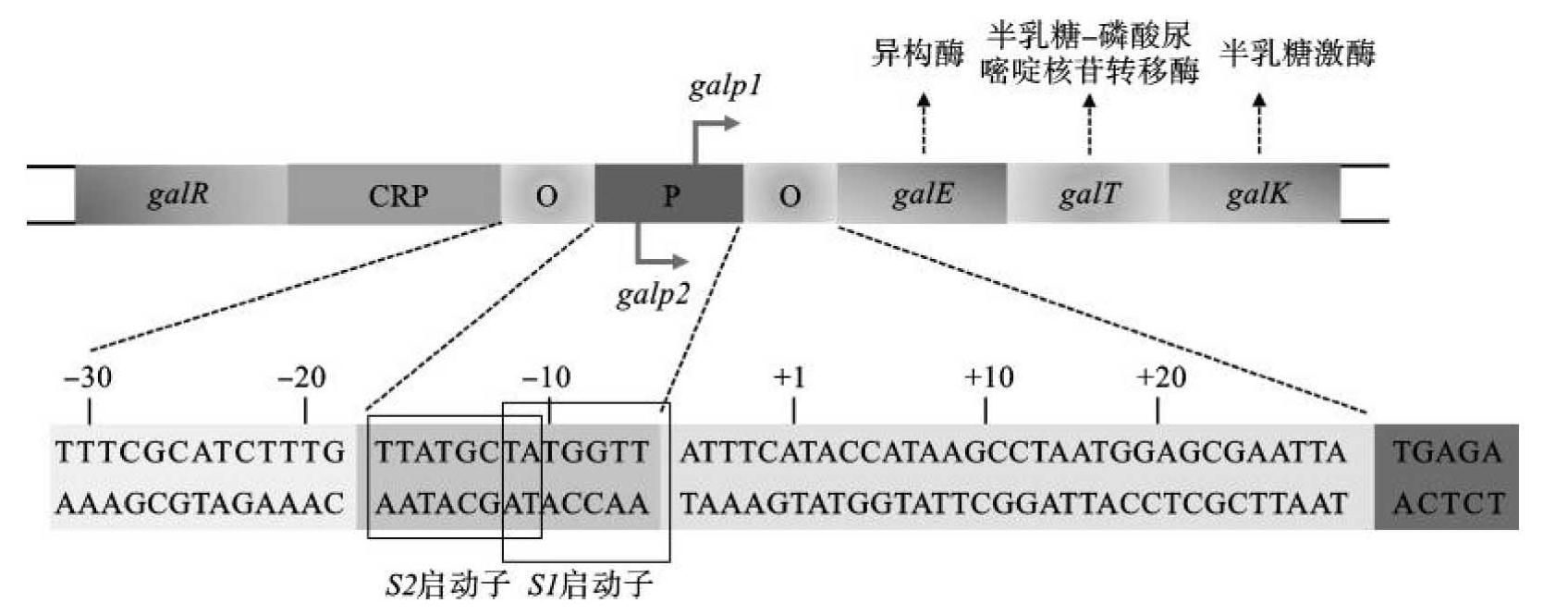
图7-5 半乳糖操纵子及双启动子结构
②PtipA启动子:来自变铅青链霉菌中的tipA基因上的硫链丝菌素诱导启动子。PtioA启动子是调控型启动子,PtipA启动子控制的转录绝对地依赖于硫链丝菌素的存在。tipA上含有两个相互重叠的基因——tipAL和tipAs。tipAL ORF编码一个DNA结合蛋白,无论是否有硫链丝菌素它都同PtipA结合。在离体情况下,当有硫链丝菌素存在时,这个结合蛋白才诱导启动子开始转录。运用印迹法定位TipAL蛋白的结合位点的结果表明它结合于一个含有45 bp的反向重复序列片段上,该重复序列与—10/—35区相互重叠。TipAL蛋白的N末端氨基酸序列区域与许多DNA结合蛋白质中的螺旋-转角-螺旋结构域同源,TipAL蛋白具有DNA结合蛋白活性。然而没有证据表明TipAL蛋白在没有硫链丝菌素时是作为阻遏物存在的。
③Pchi启动子:链霉菌产生能降解几丁质的几丁质酶。褶皱链霉菌中几丁质酶基因chi63和chi65上的启动子都受几丁质的诱导,但几丁质的诱导又受葡萄糖抑制。chi基因启动子的—10区和—35区类似典型的真细菌RNA聚合酶识别序列。将该启动子中—17区位置的C运用突变技术换为A后,其后的融合基因(xylE)的转录就不再依赖于几丁质,而且也不再受葡萄糖的抑制了。此外,含有正向重复序列的寡核苷酸在离体情况下能与序列特异的DNA结合因子相互作用。这些结果表明,可能存在一个还没有鉴定出来的DNA结合因子,该因子是一个阻遏物,它与正向重复序列结合。该阻遏物对受几丁质诱导和葡萄糖抑制、含正向重复序列的启动子的几丁质酶基因(包括chi63)有调控作用。
④温和型噬菌体ΦC31启动子:链霉菌噬菌体ΦC31中有强严谨型控制的启动子调控系统。系统中的一个关键成分就是由c基因编码的阻遏物,c基因编码3个in-frame的蛋白质,它们的相对分子质量分别为4.2×104、5.4×104和7.4×104。c基因的转录受控于两个启动子cp1和cp2,由cp1启动的转录产生编码相对分子质量为7.4×104蛋白质的mRNA,而编码相对分子质量为4.2×104和5.4×104蛋白质的mRNA则由cpl和cp2两个启动子转录而来。在变铅青链霉菌和天蓝色链霉菌中,ΦC31中溶源菌在诱导后20 min内c基因就表达出上述三种蛋白质。
在ΦC31的早期转录中存在一个复杂的级联调控系统,这种调控要么通过噬菌体编码的阻遏物(识别IRS因子)来抑制ΦC31的裂解生长,要么通过一个噬菌体编码的转录因子来刺激ΦC31的裂解生长。虽然利用ΦC31中的启动子来进行外源基因的表达仍然存在着可能,但是在利用一个ΦC31衍生的载体表达系统前,还有必要深入了解这种复杂的级联调控。
2)链霉菌的终止子
链霉菌基因转录终止的特性与大肠杆菌类似,大肠杆菌基因的终止子在链霉菌中具有转录终止的活性。反之,链霉菌终止子在大肠杆菌中同样具有终止子的活性(此外,链霉菌终止子在大肠杆菌中还具有明显的方向性)。例如,大肠杆菌的ampC(β-内酰胺酶基因)的终止信号在变铅青链霉菌中具有正常的终止功能。不依赖因子的终止信号fd同样在链霉菌的转录终止中具有活性,因此在构建链霉菌表达载体时,常常用fd作转录终止子。同时在链霉菌aph、vio、tsr、hyg和ssi等基因中也发现了茎环结构,推测这些茎环结构有利于转录的终止,因而在基因的表达中具有重要的作用。来自弗氏链霉菌中的aph基因的3'末端具有反向重复序列(inverted repeat sequence,IRS),在离体研究中,这段IRS能够诱导转录终止。曾把这段IRS插入人干扰素-α2基因的下游后再引入变铅青链霉菌中,研究其对转录终止的作用。结果表明,其有效率约达90%。相反地,在没有它的情况下,转录出来的则相对长些。进一步研究发现,它能够增加人干扰素-α2的产量,这表明形成的茎环结构可能具有稳定mRNA的功能。在大肠杆菌和λ噬菌体中发现的几个转录终止子具有同样的稳定mRNA的功能。此外,在tsr基因的3'末端存在一个长达30 bp的不完全重复序列,它们都能形成茎环结构,同时在邻近的tipA mRNA末端也可能形成类似的茎环结构。然而在这些茎环结构的3'端则没有发现富含尿嘧啶核苷酸区,而富含尿嘧啶核苷酸区被认为在大肠杆菌和枯草芽孢杆菌中有利于不依赖ρ因子的转录终止,同时有利于使mRNA从模板上释放出来。然而,至今还没有发现任何一个链霉菌终止子中具有富含尿嘧啶核苷酸区,但这些具有二重对称区富含G+C的序列具有一个共同的特征,即它们形成的茎环结构相对于大肠杆菌和细菌噬菌体中的要长些,因此也相对地要稳定些。所有这些都反映出链霉菌的转录终止在某些方面有其特征。
3)链霉菌的SD序列
在链霉菌中mRNA的翻译与其他细菌中的翻译一样,被翻译的基因常常从AUG或GUG开始,翻译遇到UAA或UAG则终止(很少出现UGA)。在变铅青链霉菌起始密码子的上游常能发现一段能与16S 3'端UCCUCC相配对的序列,这段序列与枯草芽孢杆菌中的相应序列类似,是比较典型的SD序列,但有的链霉菌基因没有这样的核糖体结合序列,有的基因甚至从作为起始密码子AUG的A处开始转录。(https://www.daowen.com)
4)信号肽
链霉菌的信号肽同其他微生物中已知的信号肽一样,由一个带电荷的N末端区、一个疏水区及带有信号肽酶识别位点的C末端区组成。在革兰氏阳性菌中,组成信号肽的氨基酸数目显著地大于大肠杆菌和人类基因的信号肽氨基酸组成数目。信号肽的加长有利于链霉菌有效地分泌蛋白质。链霉菌信号肽的N末端区的平均氨基酸残基数是12,净电荷为+3.5,一般地,链霉菌信号肽的N末末端区中精氨酸残基数较赖氨酸残基数少,这可能是因为链霉菌中密码子使用的偏好性不同。链霉菌信号肽中疏水区也相对长些(在链霉菌中是15个氨基酸残基,而在大肠杆菌中则为12个氨基酸残基),而且丙氨酸残基较亮氨酸残基多。
链霉菌信号肽酶的识别位点序列,似乎也遵循(—3,—1)规则。链霉菌中的枯草芽孢杆菌蛋白酶抑制剂(SSI)基因在大肠杆菌和白灰链霉菌、变铅青链霉菌中分泌表达的差异主要是由宿主的信号肽酶加工造成的。变铅青链霉菌和大肠杆菌产生的SSI具有相同的N末端,而白灰链霉菌表达出来的SSI蛋白的N末端则不同,这说明在不同的链霉菌中信号肽酶是不同的,但是其切割位点似乎都遵循(—1,—3)规则。
为了极大地优化蛋白质的运输步骤,必须精确地确定待表达蛋白质与信号肽之间的间隔。因此,在进行蛋白质表达时,就有必要重新设计信号肽酶切割位点周围的氨基酸残基。将外源蛋白与天然分泌蛋白C末端或其一部分相融合是解决上述问题的一种方法。另外,待分泌蛋白中还应该没有会影响蛋白质运输的序列,例如,蛋白质中的疏水区后如果紧随着带电荷的氨基酸残基,这些氨基酸残基将会引起蛋白质运输中止。此外,蛋白质如果在运输过程中形成稳定构型,也可能导致蛋白质通过细胞膜受阻。
3.链霉菌表达系统的组成
1)宿主
变铅青链霉菌是一种常用的重要的用于外源基因表达的链霉菌宿主菌。其主要优点如下:①缺乏明显的限制修饰系统;②能接受大多数的启动子;③能分泌蛋白质;④重组缺失突变株能保证质粒的稳定性;⑤使蛋白质糖基化。因此,变铅青链霉菌被认为是能产生有活性的异源蛋白的首选宿主菌。
2)载体
(1)高拷贝数载体:pIJ101是能在链霉菌中复制的高拷贝数载体,经常用于鸟枪克隆,它们有广泛的宿主范围,其拷贝数为40~800,与宿主有关,通常抗性基因标记为硫链霉素、红霉素、紫霉素和新霉素。pIJ702是由pIJ101衍生的质粒载体,其拷贝数为40~300,具有两个选择性标记,即酪氨酸酶和硫链霉素抗性。克隆在酪氨酸酶位点可使其失活,因不产生酪氨酸酶而导致不产生黑色素的表型,以此作为插入失活标记使用。
(2)低拷贝数载体:最常用的低拷贝数(1~2)载体是由SCP2*衍生的,有广泛的宿主范围,能插入30 kb以上的片段,如pIJ922、pIJ940等。
(3)穿梭载体:由于在链霉菌中提取质粒的操作不像在大肠杆菌中那么容易,构建同时能在大肠杆菌和链霉菌中复制的穿梭质粒,这样可以在大肠杆菌中完成重组质粒的构建,构建完成后转入链霉菌中进行表达,如pHJL197、pHJL210、pHJL302、pZH1351等。但是有许多穿梭载体在链霉菌中不够稳定,尤其是来源于大肠杆菌的部分易丢失。外源基因也会表现出结构的不稳定。
(4)柯斯质粒载体:含有柯斯位点的穿梭载体,因具有足够的外源DNA容量,被广泛地应用于链霉菌基因文库的构建。
(5)接合转移载体:穿梭转移质粒pPM801携带pBR322和pIJ 101复制起点以及有转移功能的RK2,质粒依靠760 bp顺式作用的ori T片段和反式因子RP4功能实施转移。
(6)噬菌体载体:链霉菌噬菌体载体大部分是由ΦC31衍生的,如KC304、KC505等。ΦC31与细菌噬菌体在形态和普通遗传学方面均相似,它能在大多数链霉菌中形成噬菌斑或形成溶源状态。它含有维持其溶源状态的阻遏基因及整合至宿主染色体的attP位点和一个黏性末端。
(7)表达载体:利用PtipA启动子构建的表达载体有pIJ6021、pIJ4123、pHZ1271和pHZ1272等。PtipA启动子是一个绝对依赖tsr诱导的强启动子,它来源于含有tsr抗性基因的变铅青链霉菌,经tsr诱导后超量表达tipA基因。
(8)分泌载体:S.albogriseolus S-3253和S.longisporus分泌的SSI,特异性地抑制微生物丝氨酸蛋白酶,利用SSI分泌和对蛋白酶抑制的特性,用pIJ702构建了外源基因分泌表达载体。已从S.venezuelae中筛选到新的SSI有效分泌蛋白VSI,其启动子有很强的转录活性。利用VSI信号肽使mTNF在变铅青链霉菌中得到达300 mg/L的高效表达。
(9)整合型载体:整合型载体可避免重组质粒的不稳定性,整合质粒可以在染色体上以单拷贝形式存在,不需要选择性压力而稳定存在。pSAM2所含的3.5 kb片段含有定点的重组酶。利用pSAM2的3.5 kb片段构建的整合型载体pPM927,可以在许多链霉菌染色体上整合。此外,变铅青链霉菌染色体中含有一段约80 kb的Ase Ⅰ片段,构建了在变铅青链霉菌中使外源基因能定点克隆的置换型载体pHZ808。
