6.2.3 重组DNA分子导入植物细胞
1.农杆菌介导的Ti质粒载体转化法
农杆菌是一类土壤习居菌,为革兰氏阴性菌,能感染双子叶植物和裸子植物,而对绝大多数单子叶植物无侵染能力。植物受伤后,伤口处细胞分泌大量的酚类化合物,如乙酰丁香酮(AS)和羟基乙酰丁香酮(HO-AS),它们是农杆菌识别敏感植物的信号分子。具有趋化性的农杆菌移向这些细胞,并将其Ti质粒上的T-DNA转移至细胞内部。根据这一性质,将待转移的目的基因组入Ti质粒载体,通过农杆菌介导进入植物细胞,与染色体DNA整合,得以稳定维持或表达(图6-4)。用于植物基因转化操作的受体通常称为外植体。选择适宜的外植体是成功进行遗传转化的首要条件,而外植体的选择主要是依据受体细胞的转化能力来决定的。
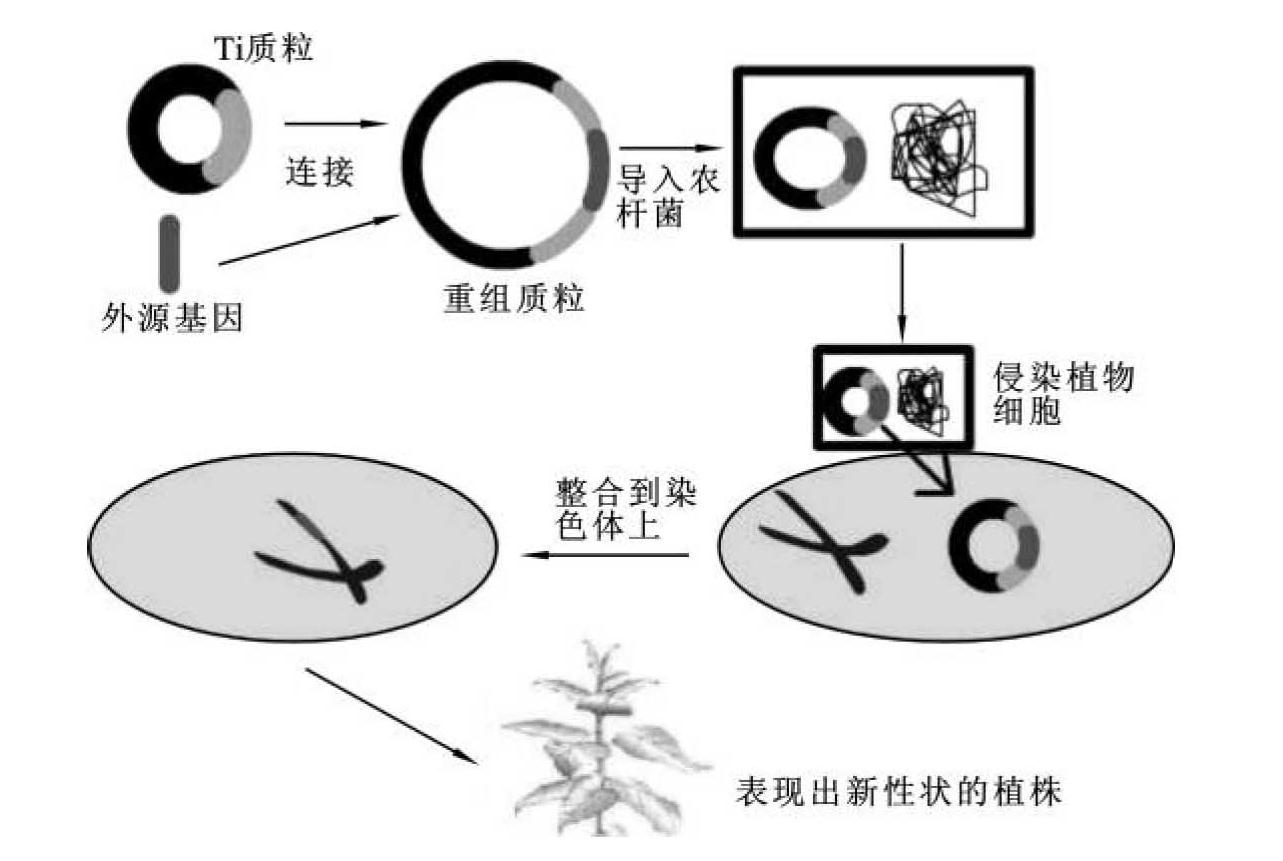
图6-4 农杆菌介导的Ti质粒载体转化法示意图
2.DNA的直接转移法
DNA的直接转移是指利用植物细胞的生物学特性,通过物理化学的方法将外源基因转入受体植物细胞。为克服农杆菌介导法的宿主局限性,至今已发展了电穿孔法、基因枪法(微弹轰击法)、激光微束穿孔转化法、显微注射法、超声波介导转化法、脂质体介导法、多聚物介导法、花粉管通道法等DNA直接转移技术。
(1)电穿孔法:细胞膜的基本成分是磷脂双分子层,在适当的外加电压作用下,细胞膜有可能被击穿,但不会导致细胞致命的伤害,当移去外加电压后,被击穿的膜孔可自行修复。根据这一性质,植物原生质体与外源DNA混合后,置于电击仪的样品室中,在合适的电压下进行短时间(微秒级到毫秒级)直流电脉冲处理,然后将原生质体转移到一定的培养基中培养,筛选并诱导植株的分化。利用此方法已获得转基因棉花、玉米和水稻等植物。为了避免原生质体再分化较难的问题,也可以利用此技术直接处理花粉粒。
(2)激光微束穿孔转化法:此方法是利用直径很小、能量很高的激光微束能引起细胞膜可逆性穿孔的原理,在荧光显微镜下找出合适的细胞,然后用激光光源替代荧光光源,聚焦后发出激光微束脉冲,造成膜穿孔,处于细胞周围的外源DNA分子随之进入细胞。这种利用激光微束照射受体细胞实现外源DNA直接导人、整合和表达的方法称为激光微束穿孔转化法。
激光微束穿孔转化法主要具有以下优点:操作简便快捷;基因转移效率高;宿主无限制,可适用于各种植物细胞、组织、器官的转化操作,并且由于激光微束直径小于细胞器,可对线粒体和叶绿体等细胞器进行基因操作。但该法需要昂贵的仪器设备,技术条件要求高,稳定性和安全性等都不如电穿孔法和基因枪法。
(3)显微注射法:这是一种利用显微注射仪,通过机械方法把外源DNA直接注入细胞质或细胞核的基因转化法。早期该技术主要用于动物细胞的基因转化等方面,现已逐步应用到植物细胞的转化操作中,成为一种重要的植物转基因手段。
这一技术的关键是原生质体或具壁细胞团的固定。由于动物细胞具有独特的贴壁生长特性,因此,不存在固定细胞的问题,这为动物细胞的显微注射创造了十分有利条件,也是动物细胞能广泛使用该技术的原因之一。但是,对于植物细胞而言,首先必须建立固定细胞技术,然后才能进行定位显微注射操作。常用的细胞固定方法有三种:第一种方法是琼脂糖包埋法,即把低熔点的琼脂糖熔化,冷却到一定温度后将制备的细胞悬浮液混合于琼脂糖中,使细胞体的一半左右埋在琼脂糖中,起固定作用,而暴露的一半则可用于微针注射;第二种方法是多聚赖氨酸粘连法,即先用多聚赖氨酸处理玻片表面,利用多聚赖氨酸对细胞的粘连作用,使分离的细胞或原生质体固定在玻片上;第三种方法是吸管支持法,即用一支固定的毛细管将原生质体或细胞吸附在管口,起到固定作用,然后用微针进行DNA注射(图6-5),这种方法的优点是毛细管可以旋转或移动位置,使操作者能选择最佳位置进行注射。显微注射法操作较为烦琐、耗时,但其转化效率很高,以原生质体为受体细胞,平均转化率达10%~20%,甚至高达60%以上。其缺点是需要使用专门的显微注射仪,并且要有精细的操作技术及低密度细胞培养技术。

图6-5 显微注射法操作局部图及显微镜下注射操作
(4)超声波介导转化法:利用低强度脉冲超声波的物理作用,可逆性地击穿细胞膜并形成过膜通道,使外源DNA进入细胞。利用超声波处理可以避免脉冲高电压对细胞的损伤作用,有利于原生质体存活,是一种有潜力的转化途径。
超声波的波长很短,可以在固体中传播,其生物学效应有机械作用、热化作用及空化作用。超声波的机械作用可以使细胞结构发生形变,且当强度增加到一定程度时,细胞会被击穿。空化作用的表现为空泡湮灭,再加上热化作用可使生物组织的温度上升,导致细胞内出现许多小泡,为细胞内外的物质交换提供便利。因此,超声波转化率较高。如果在转化反应中加入DMSO,则超声波转化率还能提高。但该转化法尚待进行更深入的研究,使之完善。
(5)基因枪法:又称微弹轰击法,是利用高速运行的金属颗粒轰击细胞时能进入细胞内的现象,将包裹在金属颗粒表面的外源DNA分子随之带入细胞进行表达的基因转化方法。其基本操作很简单,先将外源DNA溶液与钨、金等金属颗粒混匀保温,使DNA吸附在金属颗粒表面,然后在高压放电或炸药爆破的作用下加速金属微粒,轰击受体细胞,使外源DNA分子随之进入细胞内进行整合和表达。基因枪法简单、快速,可直接处理植物组织,接触面积大,并有较高的转化率。
基因枪的动力系统有三种类型:第一类是以炸药爆破力为加速动力,这是最早出现的一种基因枪;第二类是以高压气体(如氦气、氢气、氮气等)为动力;第三类是以高压放电为驱动力。三类基因枪的工作原理颇为相似,先将已包裹有外源DNA的钨(金)粉放在某种载体上,在驱动力作用下加速载体向下高速运动,遇到阻挡板阻遏后,载体前端或表面的钨(金)粉粒子凭借惯性继续以高速向下运动,击中样品室的靶细胞。
DNA颗粒载体的制备是利用CaCl2对DNA的沉淀作用以及亚精胺、聚乙二醇的黏附作用进行的。将这些化合物与DNA混合后再与钨粉或金粉混合,吹干后,DNA沉淀在载体颗粒上。制备好的DNA颗粒载体可在冰水中存放保存,数小时以内有效。常用的金属颗粒有钨粉和金粉两种,其中钨粉颗粒直径可根据不同植物材料进行选择,一般以0.6~4μm为宜,其优点是价廉易得,制备容易。但钨粉会产生一层对植物细胞有害的氧化物。金粉颗粒比钨粉颗粒比表面积大,DNA吸附力强,化学性质也更为稳定,不会形成表面有害的氧化膜。但金粉价格昂贵,应用仍较少。
(6)脂质体介导法:由人工构建的磷脂双分子层组成的膜状结构,可以将DNA包在其中,并通过脂质体与原生质体的融合或原生质体的吞噬过程,把外源DNA转运到细胞内。此方法的优点是包在脂质体内的DNA可免受细胞DNA酶降解。
脂质体的制备方法主要有Ca2+-EDTA螯合法和反相蒸发法。在Ca2+-EDTA螯合法中,先将复合双层膜囊(MLV)磷脂经超声波处理制成小型单一双层膜(SUV)磷脂,当加入Ca2+时可使各个SUV分子相互融合成卷曲状,包裹加入的DNA分子,最后加入EDTA螯合Ca2+而将之除去,即可制成包裹了核酸的大型单一双层膜(LUV)脂质体。反相蒸发法制备脂质体时,首先是在溶于有机溶剂的磷脂中加入核酸水溶液。磷脂即以其亲水基团朝向水相,疏水的尾链伸向有机相而整齐地排列在两相界面上,经超声波处理后,在有机相中形成包有DNA水溶液的囊泡,减压蒸馏有机溶剂,并加入水溶液后即可形成包含DNA的脂质体。
脂质体可直接转化外源DNA或RNA,也可用于基因的瞬时表达检测,特别对植物病毒RNA具有较高的转化率。如用PEG诱导脂质体与原生质体融合,可获得较高的转化率,比单独使用脂质体介导转化法提高100倍。
(7)多聚物介导法:这是植物遗传转化研究中较早建立、应用广泛的一种转化方法。聚乙二醇(PEG)、多聚赖氨酸、多聚鸟氨酸等是常用的协助基因转移的多聚物,尤以PEG应用最广。这些多聚物和二价阳离子(如Mg2+、Ca2+、Mn2+)与DNA混合,能在原生质体表面形成沉淀颗粒,通过原生质体的内吞噬作用吸收进入细胞。
(8)花粉管通道法:此法是将外源DNA涂于授粉的柱头上,使DNA沿花粉管通道或传递组织通过珠心进入胚囊,转化还不具正常细胞壁的卵、合子及早期的胚胎细胞。此方法由于操作简单,易于掌握,且能避免体细胞变异等问题,故有一定的应用前景。
