3.6.3 逆转录病毒
逆转录病毒(retroviruses)的特点是感染宿主细胞后可以将病毒单链RNA基因组逆转录为dsDNA,进行病毒基因组的复制。逆转录病毒可以分为简单型(致瘤型逆转录病毒)和复杂型(慢病毒和泡沫病毒)。此部分主要探讨简单型逆转录病毒,如最常见的鼠白血病病毒(murine leukemia virus),复杂型逆转录病毒在慢病毒部分介绍。简单型逆转录病毒在组织工程领域有很好的应用前景,尤其是在骨修复领域,但其应用也受到其缺点的限制,即这种病毒只感染分裂细胞,而对非分裂细胞不敏感。
1.逆转录病毒结构
(1)衣壳:逆转录病毒大小约100 nm(80~110 nm),外层具有表面突起的脂蛋白被膜。被膜内包裹着呈二十面体的衣壳蛋白,衣壳蛋白内部包裹着病毒基因组。病毒被膜为脂质双层结构,脂质双层来源于宿主细胞膜,并和病毒编码的表面糖蛋白和跨膜糖蛋白组装在一起。基本的逆转录病毒结构(图3-28)和HIV-1慢病毒结构相似。
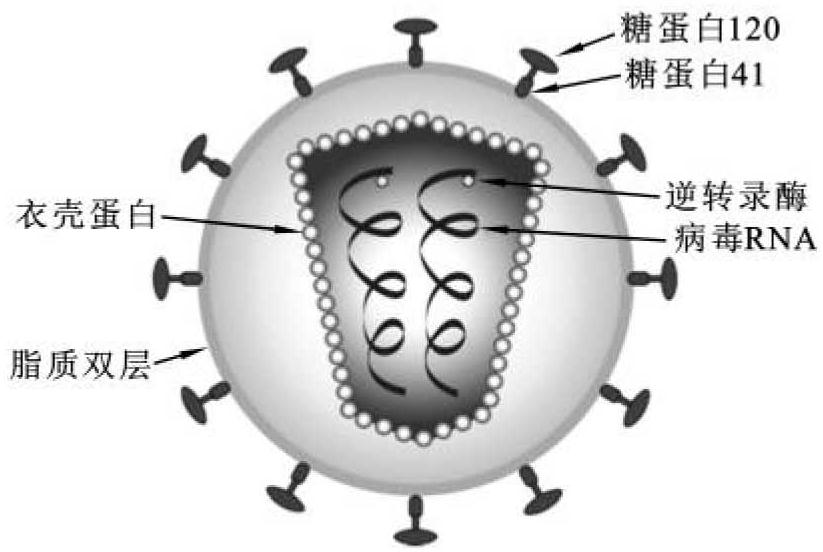
图3-28 典型的逆转录病毒结构
(引自James N.Warnock,2011)
(2)基因组:逆转录病毒基因组为线状单链RNA分子,长度为7~12 kb。简单型逆转录病毒含有三个大编码区域和一个小编码区域(表3-5)。大编码区域含有三个基因(gag、pol和env),它们在病毒与宿主细胞的结合、复制和病毒包装过程中发挥重要作用。小编码区域含有pro基因,编码一种病毒蛋白酶。
表3-5 简单型逆转录病毒基因与功能

2.生命周期
逆转录病毒的生命周期开始于病毒被膜糖蛋白与宿主细胞表面受体的接触。此时,病毒的被膜和宿主细胞膜融合在一起,病毒核心被释放进入宿主细胞质。病毒单链RNA释放出来后,pol基因编码的逆转录酶先利用单链RNA合成dsDNA。由于dsDNA不能穿越非分裂细胞的细胞膜,因此只有当宿主细胞周期进入分裂期,核膜解体时,在病毒整合酶的作用下,病毒dsDNA才能和宿主基因组发生整合,整合结果将使病毒dsDNA永久存在于宿主基因组中,这种整合状态称为前病毒状态(provirus)。接下来,在RNA聚合酶Ⅱ作用下,前病毒转录出一系列mRNA,合成出病毒复制组装所需要的各种蛋白质,在这些蛋白质的作用下,病毒在细胞质中完成组装。子代病毒通过出芽方式释放到细胞外,这种出芽过程也使病毒从宿主细胞膜处获得脂质双层结构的被膜。(https://www.daowen.com)
从生物安全方面考虑,用于基因工程载体的逆转录病毒载体必须是复制缺陷型病毒载体。因此,病毒基因组中的gag、pol和env被删除,只保留长末端重复序列、包装信号和对于病毒基因表达很重要的位点。这三个区域的删除也为外源基因提供了插入空间。病毒载体只有在包装辅助细胞系中才能复制。辅助细胞系是转染了含有gag、pol和env基因质粒的细胞系,这些质粒在细胞中为病毒包装提供所需要的酶和结构蛋白。为了保证安全性,第一种质粒中含有gag和pol基因,第二种质粒含有env基因,而病毒载体在第三种质粒中。这种策略可以避免产生具有自主复制能力的病毒颗粒。
3.基因治疗应用研究
逆转录病毒载体广泛应用于组织修复和组织工程。由于这种病毒只能感染分裂期细胞,不产生具有免疫型的病毒蛋白,且病毒载体DNA可以和宿主细胞基因组永久整合,这些特点非常适合基因治疗研究。这些载体的主要缺点是外源基因承载量较低,并且不能感染非分裂期细胞,但这些缺点并没有阻碍其在基因转移和基因治疗领域中的广泛应用。
在逆转录病毒治疗性研究领域中,骨修复是一个重要研究方向。目前,骨修复的主要治疗办法是骨移植,但移植材料的来源受限制,并且受体也有获得供体传染性疾病的风险。然而,在动物模型研究中,利用逆转录病毒所进行的骨修复研究获得了很多良好结果。在这一领域中,逆转录病毒载体可以携带各种生长因子和分化因子进入成熟的骨细胞或干细胞,这些基因工程修饰的细胞可以用于构建组织框架。同时,逆转录病毒载体也用于软骨损伤修复和治疗心血管疾病的组织工程血管的研究。
逆转录病毒介导的基因治疗策略已经用于临床试验,例如,利用逆转录病毒载体治疗婴儿或青春期前患者的X连锁的严重复合型免疫缺陷(X-SCID),已经公认这一策略具有良好的治疗效果。这一治疗过程是将人正常的IL2RG cDNA利用逆转录病毒载体导入自体离体的CD34+造血细胞,再将基因工程细胞导入患者体内,临床研究表明可以达到治愈X-SCID的效果,但也发现这种治疗策略增加了患者患淋巴瘤的危险。
