11.1.2 条件基因敲除技术
条件基因敲除技术是指在完全基因敲除技术的基础上,通过重组酶对靶位点进行特异性重组,在小鼠发育的特定阶段或特定细胞组织类型中将目的基因进行敲除的技术。该技术能够在时间和空间上调控基因组的修饰,近些年取得了迅猛发展。条件基因敲除技术主要通过Cre-loxP系统、CRISPR-Cas9系统、FLP-frt系统来实现,下面以Cre-loxP系统为例说明条件基因敲除技术的基本原理和过程。
1.Cre-loxP系统
1994年第一例基于Cre-loxP系统的特异性基因敲除小鼠问世,从此条件基因敲除技术得到迅猛发展。Cre重组酶相对分子质量为3.8×104,来自噬菌体P1,由于其可以作用于两个lox P位点之间并发生特异性的同源重组,因此被广泛使用。若两个lox P位点方向相反,Cre重组酶无法切除中间序列,而使序列产生倒位;反之,若方向相同,lox P位点之间的DNA序列可以被切除。可借助此原理将某一DNA序列使用两端插入lox P位点的方式删除(图11-3)。同时,Cre重组酶还可通过条件性表达控制在特定部位(在特定细胞种类或组织中)或特定时间(在细胞及组织发育的特定阶段)删除中间的DNA序列。
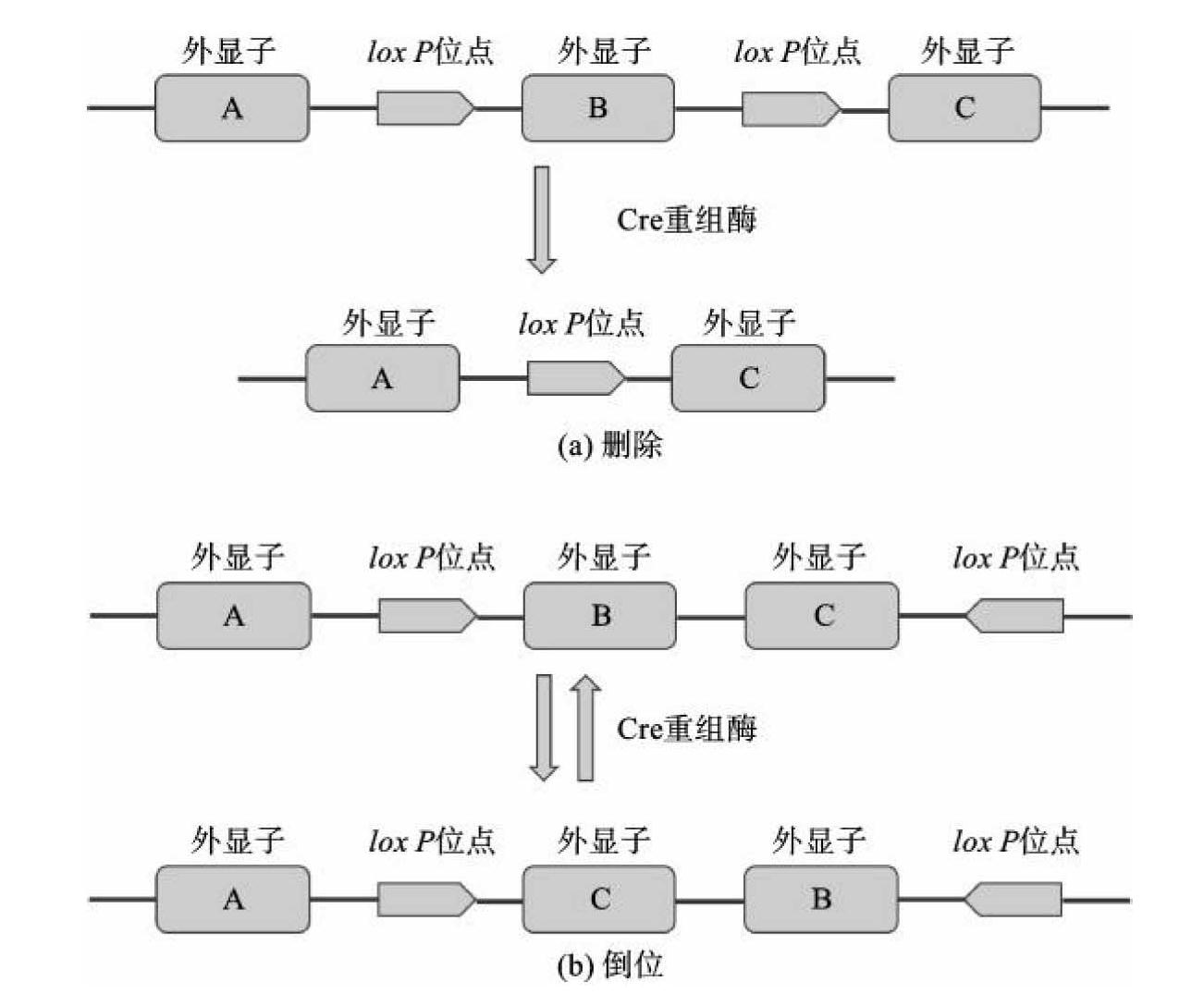
图11-3 Cre-loxP系统介导的删除和倒位
2.Cre-loxP系统介导的条件基因敲除基本过程
Cre-loxP系统介导的条件基因敲除主要分为两步。第一步需要在获得的ES细胞基因组中引入lox P的序列,该序列长约34 bp,包括两个13 bp的反向重复序列和中间的8 bp的非回文序列,此步骤需要控制好lox P位点的方向。第二步为靶基因的修饰,需要通过Cre介导的重组来实现,此步骤可在ES细胞水平实现,也可以利用转基因小鼠来实现。以小鼠为例,首先构建含有loxP序列的条件基因敲除小鼠,该小鼠表型和发育正常,与组织特异性cre转基因小鼠杂交后,杂交后代含有Cre酶,能将lox P序列中间锚定的靶基因删除,从而使得靶基因缺失,表现出某一表型缺陷,进而推断靶基因的特定功能(图11-4)。
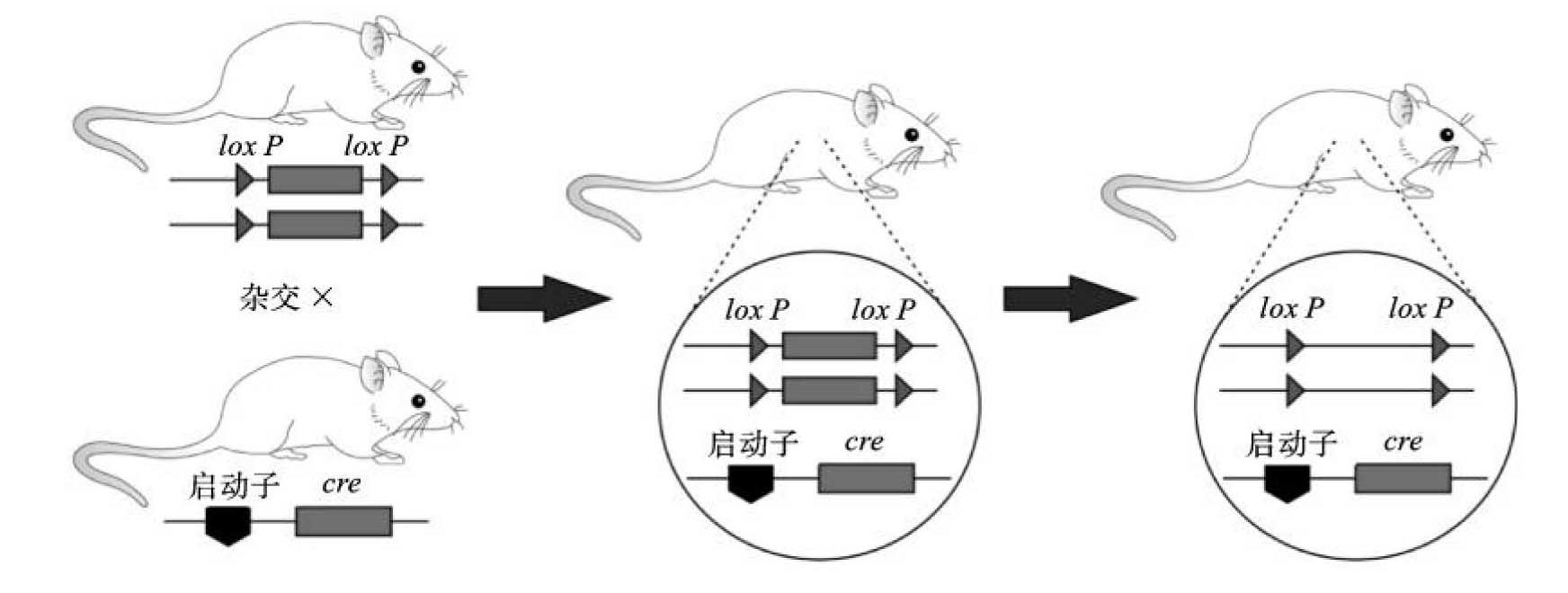
图11-4 Cre-loxP系统介导的重组
