10.2.1 外源基因导入动物细胞的方法
1.显微注射法
显微注射法(microinjection)是利用极细的玻璃毛细管,将外源基因片段直接注射到受精卵的原核期胚胎中,然后使外源基因嵌入宿主的染色体内,是目前使用最为广泛、发展最早的,也是最为有效的方法。
显微注射法是美国科学家Gordon等在研究小鼠转基因技术时发明的,这也是目前为止使用较多、比较有效的一种方法。显微注射法的具体做法是,在一台倒置相差显微镜下,用一根直径为80~100μm的细玻璃管将胚胎固定,再用另一根直径为1~5μm的玻璃管刺入细胞原核,把DNA溶液直接注射到原核期胚胎的一个或两个原核中。完成显微注射DNA的胚胎经过1~3 h培养,证明未因显微注射而发生裂解后,即可直接移植到受体母畜的输卵管中;也可以转移到适当培养液中,让它们继续发育到桑葚胚或囊胚阶段,然后再进行胚胎移植。用这一方法建立转基因动物的过程至少涉及以下四个主要步骤:①构建外源基因表达载体并生产用于注射的DNA溶液;②准备供注射用的胚胎并制订显现原核的技术方案;③实施显微注射并将注射后的胚胎进行相应的技术处理,然后移植到受体母畜中;④对出生的幼畜进行基因整合和表达的检测,把筛选出来的转基因动物繁殖传代培育,进而建立转基因动物的家系和群体。其基本流程见图10-1。
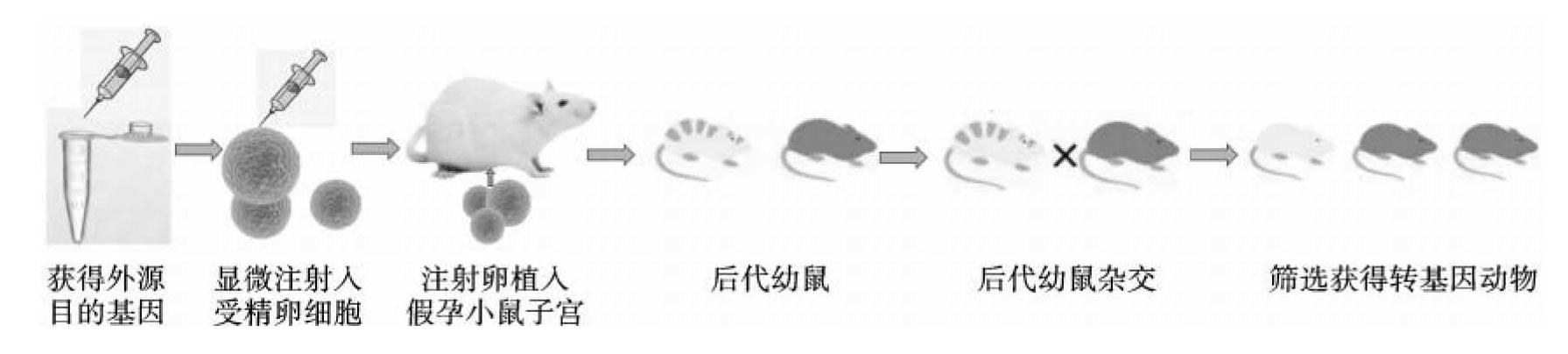
图10-1 显微注射法获得转基因动物流程
以显微注射法转外源基因没有长度上的限制,基因的转移率高,实验周期相对较短,目前已证明数百kb的DNA片段也可以生产出转基因动物。显微注射法的缺点是所需要的仪器设备精密而昂贵,对操作者的技术要求高,每次只能注射有限的细胞;开孔时容易对受体产生损伤,造成卵内物质外流,降低孵化率;无法控制被导入的目的基因拷贝数,宿主DNA易突变等。尽管如此,由于直接对基因进行操作,整合率较高,因而该方法目前仍是建立转基因动物极为重要的方法。
2.逆转录病毒法
逆转录病毒是一类RNA病毒,含有逆转录酶,病毒的RNA进入宿主细胞后,在逆转录酶的作用下合成病毒DNA。由于逆转录病毒具有侵染动物细胞并整合进细胞染色体DNA的能力,因此逆转录病毒可以用于构建转基因动物的载体。逆转录病毒载体已经广泛地应用于体外细胞的转染和基因治疗的研究。
逆转录病毒法是指将外源基因替换病毒基因组的反式元件,通过顺式元件的调控序列和感染成分重组病毒载体,然后注射到MⅡ期的卵母细胞,进行体外受精和筛选。即将目的基因重组到逆转录病毒载体上,制成高浓度的病毒颗粒,人为感染着床前或着床后的胚胎,也可以直接将胚胎与能释放逆转录病毒的单层培养细胞共孵育以达到感染的目的,通过病毒将外源目的基因插入整合到宿主基因组DNA中。
早在1976年,Jaenisch等就成功地用逆转录病毒法制作转基因小鼠,其后用这一方法生产出转基因鸡和转基因牛。近年来,同属于逆转录病毒科的慢病毒载体被广泛应用于转基因动物的制备,可使转基因效率提高到10%~30%。2003年Hofmann等用慢病毒载体法首次成功制备了绿色荧光蛋白转基因猪,McGrew等利用同样的方法高效制备了转基因鸡,效率比以往任何方法高出100倍以上。
通过病毒DNA插入宿主DNA的机制,将外源目的基因整合到宿主基因组,呈单一位点单拷贝整合,整合率高,以及插入位点克隆分析较容易等都是逆转录病毒法的优点。但由于逆转录病毒载体构建较为复杂,携带外源基因的能力有限(通常小于10 kb),转基因动物大多为嵌合体,而且还存在安全隐患,因此该技术的应用受到一定的限制。
3.胚胎干细胞法
胚胎干细胞(ES细胞)是高度未分化的全能干细胞,通过人工培养和定向诱导,可分化为多种组织细胞。将外源基因导入ES细胞后进行必要的筛选,筛选出的细胞转移到原肠时期的胚胎中便得到带有目的基因的嵌合体动物,再通过杂交的方法得到一个品系。目前这种方法仅用于转基因小鼠的基础研究。
Robertson等用mos-neo逆转录载体感染EK.CCE系小鼠干细胞。当确定逆转录载体整合进干细胞基因组后,将每10~12个整合外源DNA的干细胞植入一枚小鼠囊胚期胚胎的囊胚腔。在得到的21只小鼠中,20只小鼠体细胞及生殖细胞中含有外源载体的序列,部分嵌合体小鼠可将外源DNA传递给F1代。
在小鼠ES细胞的应用上,目前着重于利用基因的定位整合、同源重组等手段研究基因的功能,包括ES细胞的建立、对ES细胞进行电击转入外源基因、筛选稳定整合有外源基因的ES细胞、体外克隆成系、ES细胞的囊胚注射、囊胚移植入输卵管中、子代鼠的检测等过程。
该方法的优点是,在将ES细胞植入胚胎前,可以在体外选择一个特殊的基因型,用外源DNA转染以后,ES细胞可以被克隆,继而可以筛选含有整合外源DNA的细胞用于细胞移植,由此可以得到很多遗传上相同的转基因动物。用这种方法制作转基因小鼠的阳性率接近100%,经过耐心细致的选择,极有可能得到稳定遗传的动物新品系。ES细胞已被公认是转基因动物、细胞核移植、基因治疗等研究领域的一种新试验材料,具有广泛的应用前景。其缺点是许多嵌合体转基因动物生殖细胞内不含有转基因。
4.精子载体法
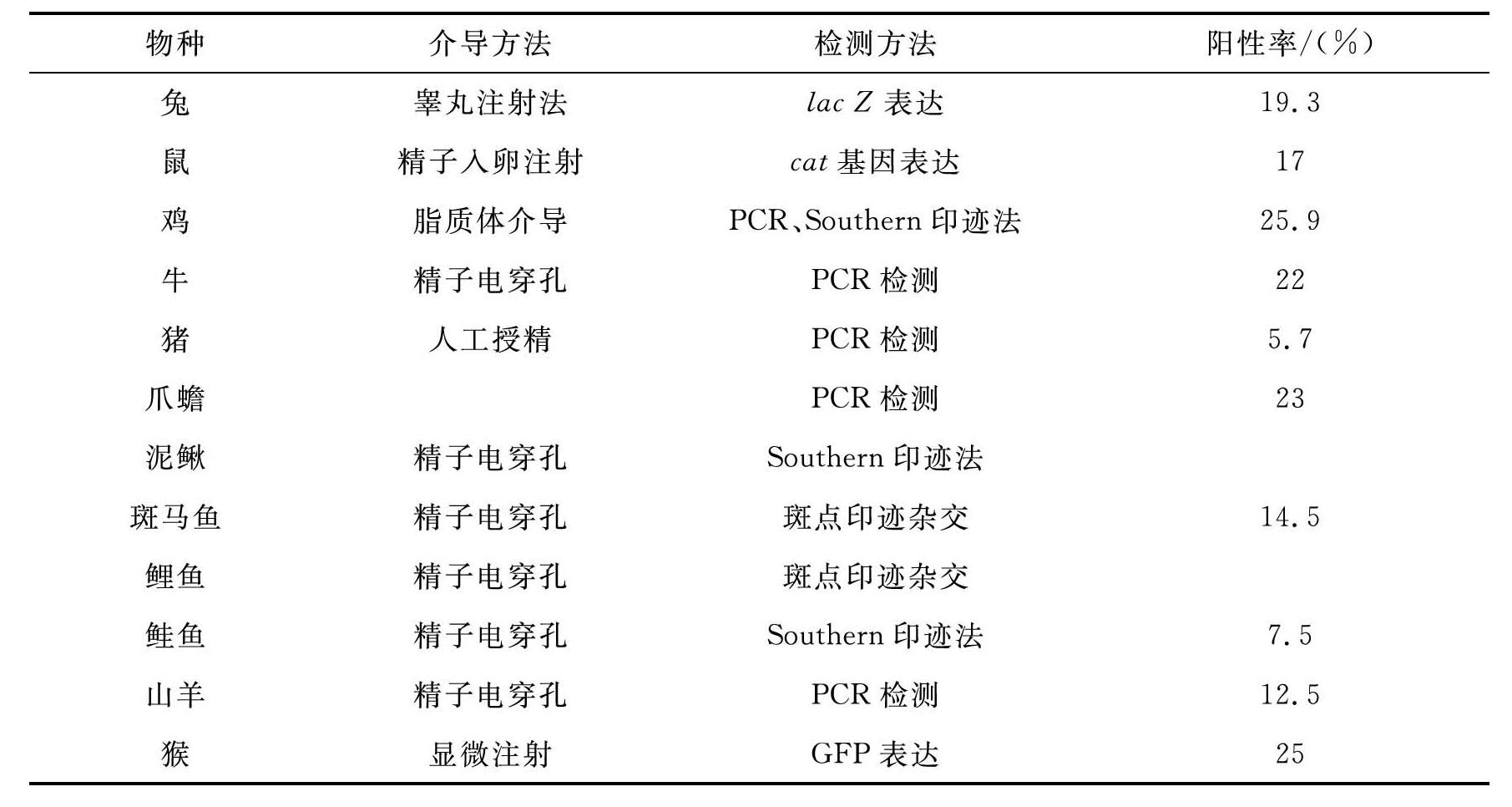
精子载体法(sperm mediate gene transfer,SMGT)最早由Brackett于1971年提出,直到1989年,才有人首次报道用精子载体法成功获得转基因小鼠。随后这种方法也被应用到其他动物中,其中在转基因猪上运用较为广泛,涉及的主要动物物种及其转基因阳性率等见表10-2。(https://www.daowen.com)
表10-2 精子载体法成功转基因动物

续表
1)精子结合外源DNA的机制
虽然对外源DNA如何整合到受精卵的过程仍有诸多不清楚之处,但许多实验结果表明精子具有潜在的结合外源DNA并在受精过程中将其转入卵内的能力。长期以来,对精子介导机理的研究主要集中于精子与外源DNA结合的能力以及影响因素研究。对多个物种的实验证明,精子有瞬间吸收外源DNA的能力,其结合率从15%到80%不等。在这一结合过程中,MHCⅡ、CD4、IF-1等一系列因子起重要调节作用。1998年,Spadafora提出外源DNA内化的模型,对这些因子与DNA之间的相互作用给予了充分的分子层面的解释。Lavitrano发现,在精子吸收外源DNA的时候,其吸收区域是特异性的,位于精子头部的顶体后区,靠近精核的区域。
Brinster在1989年对部分探索实验的失败进行了总结,对这种方法的可靠性进行了质疑。部分学者提出还需要对这种方法中精子和外源DNA之间相互作用的各个方面进行研究,从而提高其转化效率。
虽然研究者对精子与外源DNA作用原理做了大量深入细致的研究,但很多实验证据仅仅来自对小鼠的研究。鉴于各个物种在转基因率、DNA进入精子的介导方式及外源DNA在后代中的表达上都存在很大的差异,很有必要对各个物种的精子对DNA的吸收和内化及整合的生化、分子生物学特征与机制进行深入研究。
2)精子载体法的技术类型
根据转基因途径实现方式的不同,精子载体法可分为体外精子载体法和体内精子载体法。
(1)体外精子载体法。
①SMGT法(外源DNA与精子共孵育):这是精子介导法最基本的转移技术。将已获能的精子与外源DNA直接混合孵育,利用精子体外培养或人工授精等方法将携带外源DNA的精子转移到体内得到转基因动物。
②SMGT-脂质体法:为防止外源DNA在导入的过程中被降解或被稀释,使用脂质体将外源DNA包裹起来,形成脂质体-DNA复合体。这种复合体较易与精子细胞质膜融合,从而进入细胞内部。
③SMGT-电穿孔法:电穿孔法的原理是通过高压电场使精子细胞质膜通透性产生暂时的可逆性变化,从而使外源DNA分子进入精子细胞内。该方法能够使精子结合外源DNA的比率提高5~8倍。但由于电击过程也可能对精子造成不可逆的损伤,导致精子细胞死亡,因此,应根据物种差异、个体差异,对电穿孔的脉冲强度、脉冲时间等进行优化。
(2)体内精子载体法。
体内精子载体法与体外精子载体法不同之处是通过注射的方式把外源DNA直接注射到动物体内(睾丸、输精管、曲精细管等),之后使精子在体内完成转染过程,从而使外源DNA进入胚胎,发育成转基因动物。这类方法避免了精浆中部分物质对DNA的降解作用,简化了精子体外处理的过程,从一定程度上优化了SMGT的方法。但由于注射过程需要根据不同的动物进行条件和方法探索,可能对动物生殖器官造成伤害,因此要选择适宜的注射位置、注射手段和注射工具等。
利用精子载体法转基因既简便易行,又具有很好的物种适应性,对胚胎发育影响小,成为最受关注的动物转基因方法之一。该法操作起来相对简单,但是效果不够稳定,实验重复性很差,且外源基因整合进基因组后基因出现严重的重排现象。不过,最近有研究显示,将外源基因与精子表面蛋白的抗体结合可以提高外源基因进入受精卵的效率,而且整合效率高,能表达并能遗传到后代,目前已成功生产出转基因小鼠和猪。
