7.4.1 胰岛素基因工程
1.胰岛素的结构和功能
胰岛素(insulin,INS)是人体唯一具有降糖功效的蛋白质、多肽类激素,在糖代谢的调节中具有重要作用,目前主要用于治疗糖尿病。1921年,加拿大科学家Frederic Banting和Charles Best首次从动物胰脏中提取出胰岛素。随后动物胰岛素被广泛应用于临床,并取得了较好的疗效,因此胰岛素的发现也被称为医学界最重大的成就之一。但由于动物胰岛素的来源有限及异种免疫反应,其应用逐渐不能满足市场的需求。基因工程技术的诞生为开发动物胰岛素的替代品提供了可能,不仅满足了胰岛素的市场需求,而且减少了动物胰岛素导致的过敏反应。1978年Genentech公司使用大肠杆菌利用重组DNA技术生产出人源胰岛素,随之1982年诞生了世界上第一个基因工程药物——重组人胰岛素,这标志着基因重组技术实现产业化。
胰岛素来自胰岛素原,胰岛素原的结构包括A肽链、B肽链和C 肽链,成熟的胰岛素则为去掉C肽链后的结构,包括A 肽链和B肽链。人胰岛素分子由16种共51个氨基酸残基组成,其中A链包含21个氨基酸残基,B链包含30个氨基酸残基。A链、B链通过二硫键相连,其中A7(Cys)与B7(Cys)、A20(Cys)与B19(Cys)4个半胱氨酸残基中的巯基两两形成二硫键,使A、B两链连接起来(图7-6)。若二硫键断裂,则胰岛素失去生物活性。
2.基因工程技术生产胰岛素
采用基因工程技术生产人胰岛素主要通过“A链和B链分别表达法”,美国礼来(Eli Lilly)公司率先利用大肠杆菌工程菌生产出人胰岛素,生产过程如图7-7所示。首先构建含有细菌启动子、lac Z基因的融合表达载体,分别将胰岛素A链和B链与表达载体连接后,各自转化大肠杆菌工程菌;培养一定时间,待表达出胰岛素A链融合蛋白(β-半乳糖苷酶-A 肽)和胰岛素B链融合蛋白(β-半乳糖苷酶-B肽)后,通过亲和色谱柱将融合蛋白纯化,纯化后使用溴化氰切断β-半乳糖苷酶肽段,得到纯化的胰岛素A链和B链;将A链和B链通过二硫键连接,即得到有活性的人胰岛素分子。在胰岛素基因的表达过程中,基因表达产物为融合蛋白,因为β-内酰胺酶信号肽的存在,可促使表达产物穿过细胞膜,分泌到胞外,易于实现蛋白质的提取和分离。
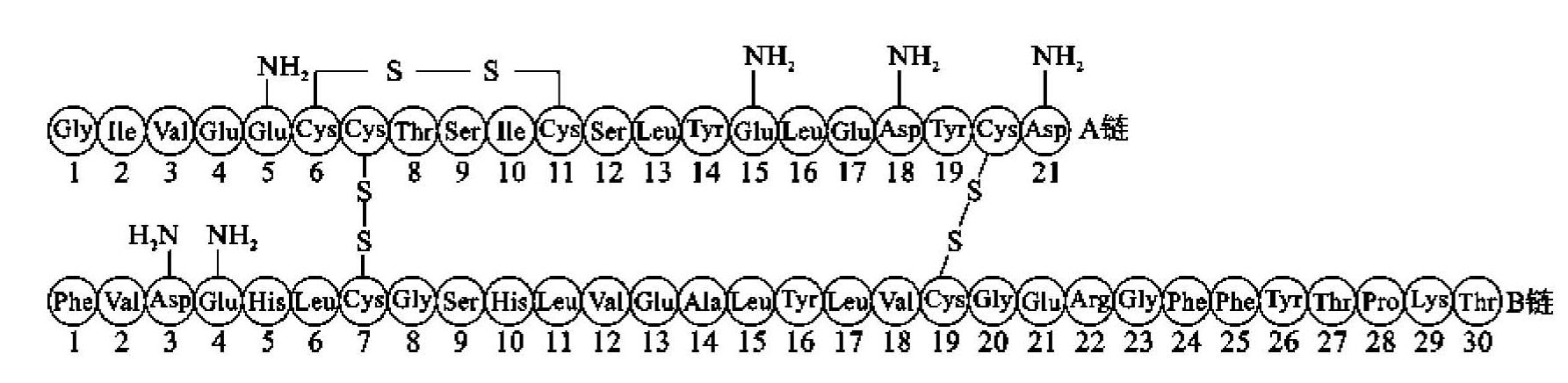
图7-6 人胰岛素的一级结构图
(引自袁婺洲,2010)
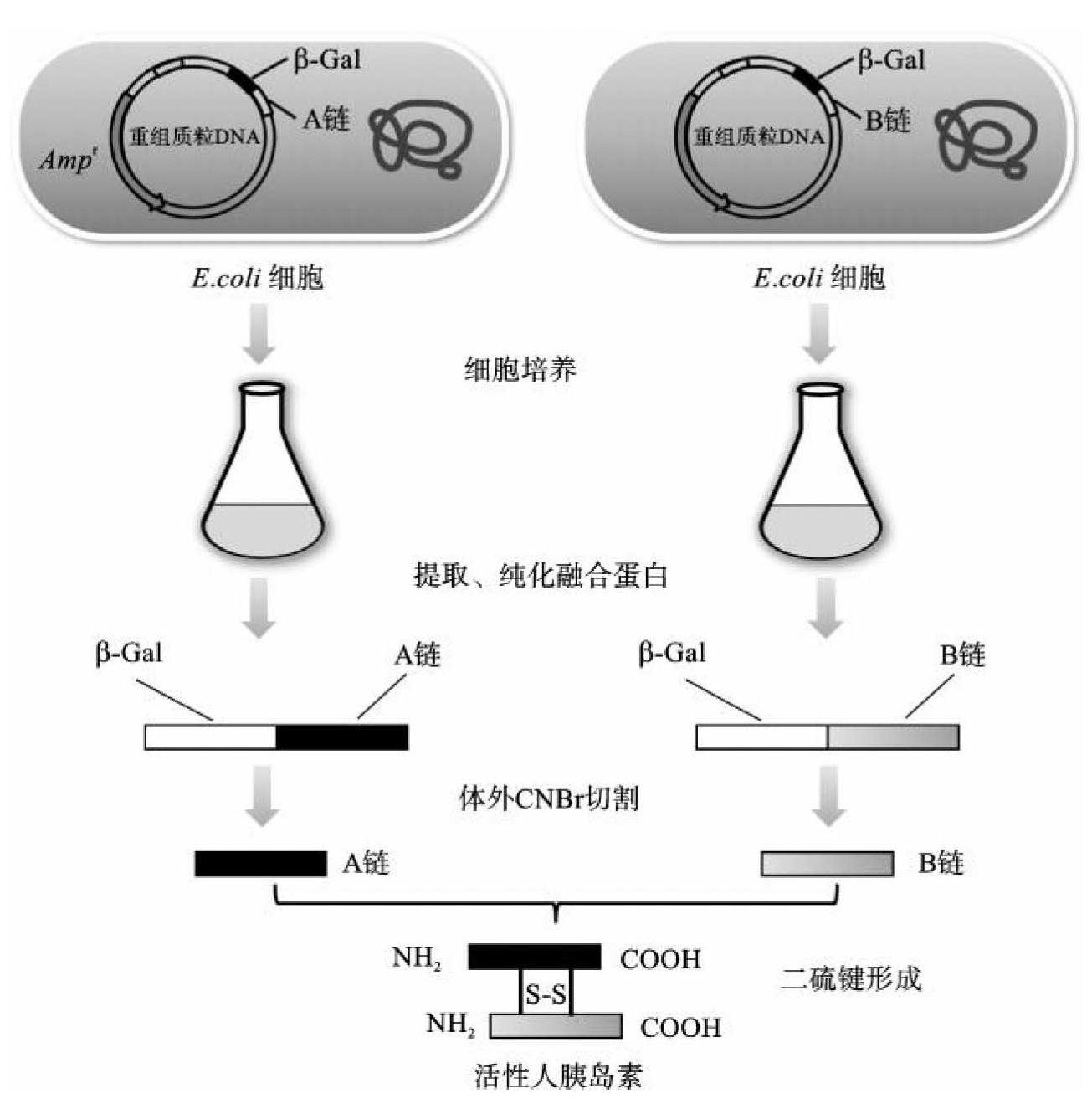
图7-7 基因工程技术生产人胰岛素的流程
在基因工程生产人胰岛素的工艺中,最初由于人胰岛素A链和B链中共有6个半胱氨酸残基存在,而A链和B链只有通过A7(Cys)与B7(Cys)、A20(Cys)与B19(Cys)4个半胱氨酸残基中的巯基形成两个二硫键连接才能成为有活性的胰岛素。空气氧化法得到的二硫键正确配对率较低,因此最初的工艺步骤较多且生产成本较高;在此基础上,又发展了人胰岛素原表达法,即将含有C肽的人胰岛素原基因与含有lacZ基因的融合表达载体连接,转化大肠杆菌工程菌后,表达出融合蛋白(β-半乳糖苷酶-胰岛素原),随后在C肽链的帮助下,二硫键正确配对率明显提高,使得胰岛素原能够折叠成正确的空间构象。该方法不仅显著地提高了二硫键的正确配对率,并且极大地降低了生产成本。
3.基因工程胰岛素的应用
1982年第一支重组人胰岛素的上市为重组人胰岛素和胰岛素类似物的开发奠定了良好的基础。重组人胰岛素因其具有安全性强、疗效好、产量高和成本低等优点,在临床上得到了广泛的应用。我国在1998年成功研制了重组人胰岛素“甘舒霖”,进入基因重组技术的世界领先行列。在此基础上,又发展了速效、中效、长效胰岛素制品,胰岛素药物得到迅猛发展。
重组人胰岛素类似物赖脯胰岛素(insulin lispro)是将人胰岛素B链的第28位与第29位氨基酸残基互换得到的胰岛素类似物。研究显示,该类似物在控制高血糖时,比人胰岛素的作用更快。重组人胰岛素类似物于2000年获批上市,在临床上得到广泛应用。门冬胰岛素(insulin aspart)是速效人胰岛素类似物,在人胰岛素B链第28位上,用天冬氨酸残基替代了原有的脯氨酸残基,与普通胰岛素相比,药效达峰快2倍,作用更快。甘精胰岛素(insulin glargine)是一种长效胰岛素类似物,在人胰岛素A链第21位上,用甘氨酸残基替代了原有的丙氨酸残基,同时在B链的C末端加入2个精氨酸残基,甘精胰岛素的作用持续时间长达24 h,因此主要用于需长效控制血糖的2型糖尿病患者和1型糖尿病患者的治疗。
