3.2.6 实验室常用的基因工程质粒载体
这里介绍几种实验室常用的质粒载体,其中pBR322和pUC系列载体属于早期设计构建的用于基因工程的经典质粒,也是后来很多质粒载体设计构建和改造的基础。伴随基因工程技术的发展,多种不同功能和结构的载体被设计构建出来,以适应不同用途。在这一过程中,多家公司加入载体开发研究中,例如Promega公司、BD公司、Invitrogen公司、Novagen公司和GE公司等,都开发了商业化的多用途的质粒载体,而且这些商业化的质粒载体由于具有功能优异、使用便利、设计严谨和多样化等优点,已经成为实验室基础研究和应用研究过程中不可缺少的重要工具。
1.pBR322质粒载体
pBR322质粒载体(图3-4)属于克隆载体,是使用最早且应用最广泛的大肠杆菌质粒载体之一。载体名称“pBR322”中的“p”代表质粒,“BR”代表两位研究者F.Bolivar和R.L.Rodriguez(姓氏的首字母),“322”是实验编号。它的亲本包括pMB1、Rldrd19、pSC101和Co1E1,由多个亲本质粒经过复杂的重组过程构建而成。其复制起始位点(ori)来源于pMB1质粒,氨苄青霉素抗性基因(Ampr)来源于pSF2124质粒,四环素抗性基因(Tetr)来源于pSC101质粒。
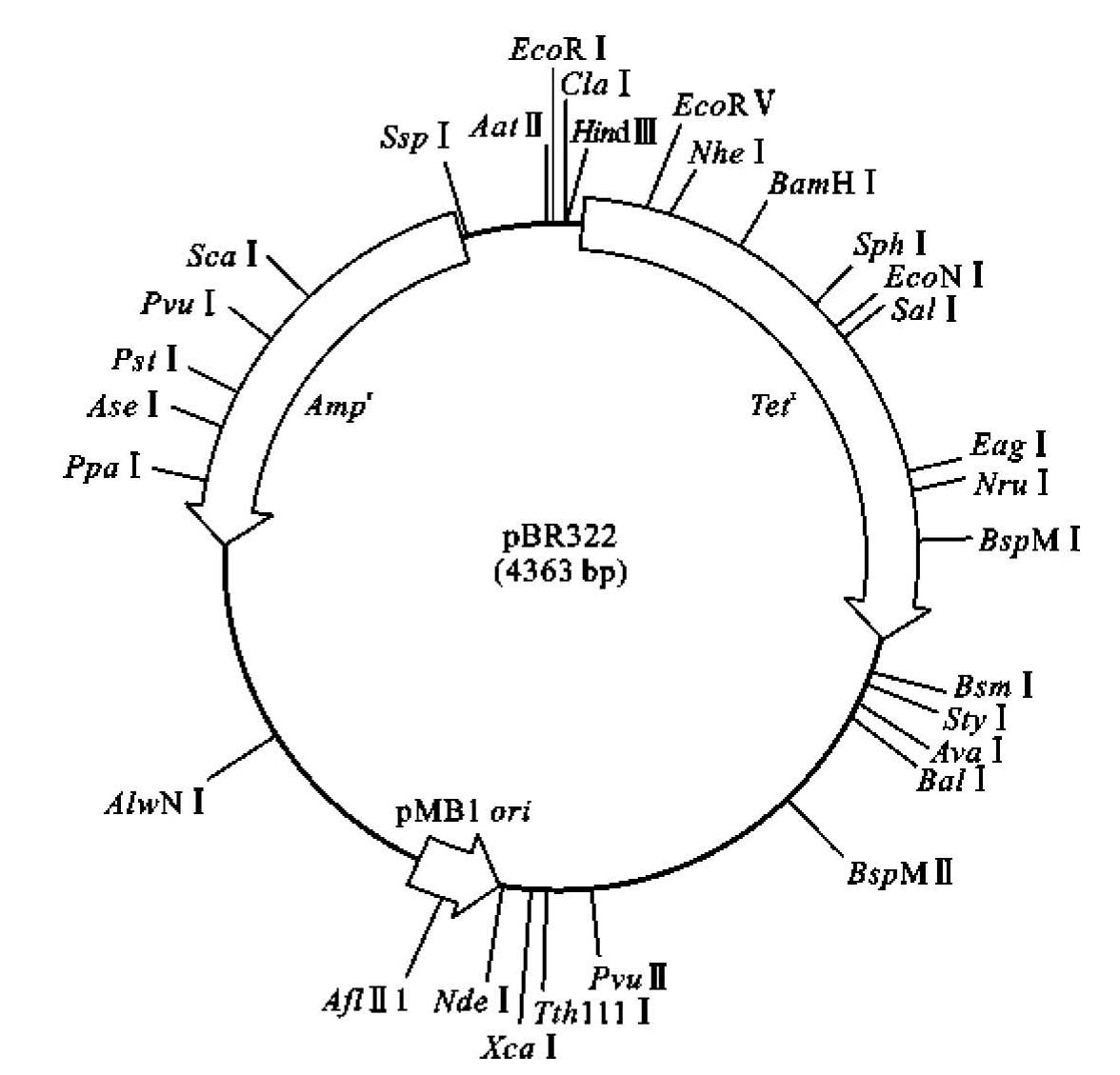
图3-4 pBR322质粒载体结构
pBR322质粒载体的优点如下:
(1)质粒长度为4361 bp,相对分子质量较小,易于纯化和转化。
(2)质粒带有一个来自pMB1的复制起始位点,保证其在大肠杆菌细胞内正常复制。
(3)质粒具有两种抗生素选择标记基因,即氨苄青霉素抗性基因(Ampr)和四环素抗性基因(Tetr),可以用来筛选转化子和重组子;氨苄青霉素抗性基因(Ampr)内部含有3个限制性核酸内切酶单一识别位点。这3个位点都可以作为克隆位点,插入外源DNA后会使抗性基因插入失活。这一原理可用于筛选重组子。
(4)具有较高的拷贝数,经过氯霉素扩增以后,每个细胞中可累积1000~3000个拷贝,这为重组体DNA的制备提供了极大的方便。
(5)质粒含有24种不同限制性核酸内切酶的单一识别位点。其中,9个酶切位点位于四环素抗性基因(Tetr)区域,其启动子区域含有2个位点,编码区含有7个位点。在这9个位点插入外源DNA都可以导致Tetr失活。这些酶切位点便于重组子的筛选。
(6)在载体构建过程中,删除了接合转移功能相关的区域,因此,不能在自然界的宿主细胞间转移,也不会引起抗生素抗性基因传播。
2.pUC系列质粒载体
1987年J.Messing和J.Vieria构建了pUC质粒,两位科学家以所在学校的名称“University of California(加利福尼亚大学)”命名了该质粒。pUC质粒载体是在pBR322质粒基础上引入了一段带有多克隆位点的β-半乳糖苷酶α片段基因(lac Z'),从而成为具有抗性筛选和蓝白斑筛选双重功能的载体。pUC质粒含有来自pBR322质粒的复制起点(ori)、氨苄青霉素抗性基因(Ampr)、大肠杆菌β-半乳糖苷酶基因(lacZ)的启动子及其编码α-肽链的DNA序列(lac Z')和靠近lac Z'5'端的一段多克隆位点(MCS)。
pUC系列质粒载体的优点如下:
(1)具有更小的相对分子质量和更高的拷贝数。这些质粒大小一般在2.7 kb左右,小相对分子质量保证了其可以容纳更大的外源DNA和更容易进入受体细胞。pUC质粒属于松弛型质粒,由于pUC质粒中所带有的pBR322复制起始位点发生突变,导致控制质粒复制的蛋白质缺失,因此pUC质粒在受体细胞中有更高的拷贝数,不需氯霉素扩增情况下,每个细胞中可以达到500~700个拷贝,可以高效获得外源DNA。
(2)利用蓝白斑筛选鉴定重组子。β-半乳糖苷酶α片段基因(lac Z')编码的α-肽链可以参与α-互补作用。当外源DNA片段被克隆到pUC的lac Z'区域时,lac Z'基因失活。所以当重组体转化β-半乳糖苷酶基因缺陷型大肠杆菌后,在IPTG和X-gal存在下培养,会得到白色菌落,而未插入外源DNA的pUC质粒转化子,由于正常功能的lac Z'表达的α-肽链的互补作用产生出正常功能的β-半乳糖苷酶,酶和底物X-gal作用后,就能产生蓝色菌落。因此,根据所产生菌体的颜色可以区分出重组子。
(3)含有多克隆位点区域(MCS)。MCS区域的引入为外源DNA的插入和移除提供了方便的工具。而且,克隆外源DNA时选择两种不同酶切位点进行切割和连接,解决了克隆片段的方向问题。
pUC18和pUC19载体(图3-5)为含有相同MCS区域,但方向相反的一对载体,这种成对的载体的使用为选择克隆DNA的方向提供了很大的便利。
3.pGEM-T系列克隆载体
Promega公司的pGEM-T系列载体(图3-6)及配套试剂盒是实验室常用的PCR产物克隆载体。此系列载体长度约3 kb,为高拷贝数载体。此载体是通过EcoR V酶切,并在3'末端加入胸腺嘧啶(T)构建而成,且3'末端的T可以防止载体的自身环化。由于目前常用的PCR聚合酶都含有末端加A功能,利用PCR产物末端的A和载体末端T的碱基互补,可以简便、快捷地将PCR产物克隆到载体中,序列未知的DNA片段经过聚合酶末端加A处理后也可以插入克隆位点,利用载体上已知的序列对未知片段进行测序,可以很快获取未知DNA片段的序列信息。载体上含有氨苄青霉素抗性筛选基因(Ampr)和β-半乳糖苷酶α片段基因(lac Z'),外源DNA的T-A克隆位点位于lac Z'内部。这样的设计既实现了转化子的抗性筛选,又实现了重组子的蓝白斑筛选。在外源DNA插入位点两侧分别带有一段多克隆位点区域和包含T7和SP6 RNA聚合酶的启动子,便于插入片段的卸下,连入其他载体,且利用双向T7和SP6启动子可以进行体外转录。其载体上的噬菌体fl ori可以用于制备单链DNA。这些优点使pGEM-T系列载体成为实验室常用的克隆载体。
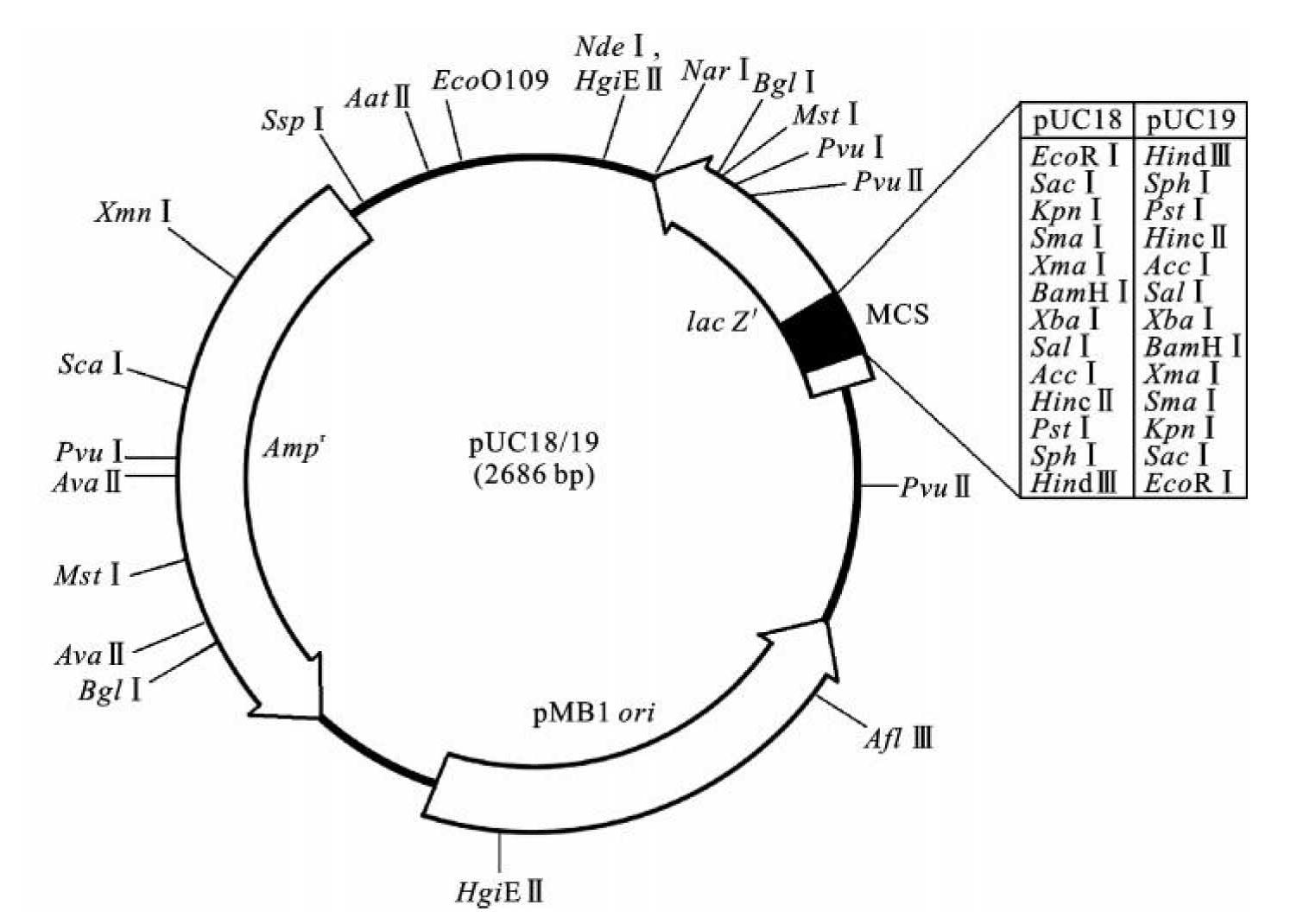
图3-5 pUC18和pUC19载体结构
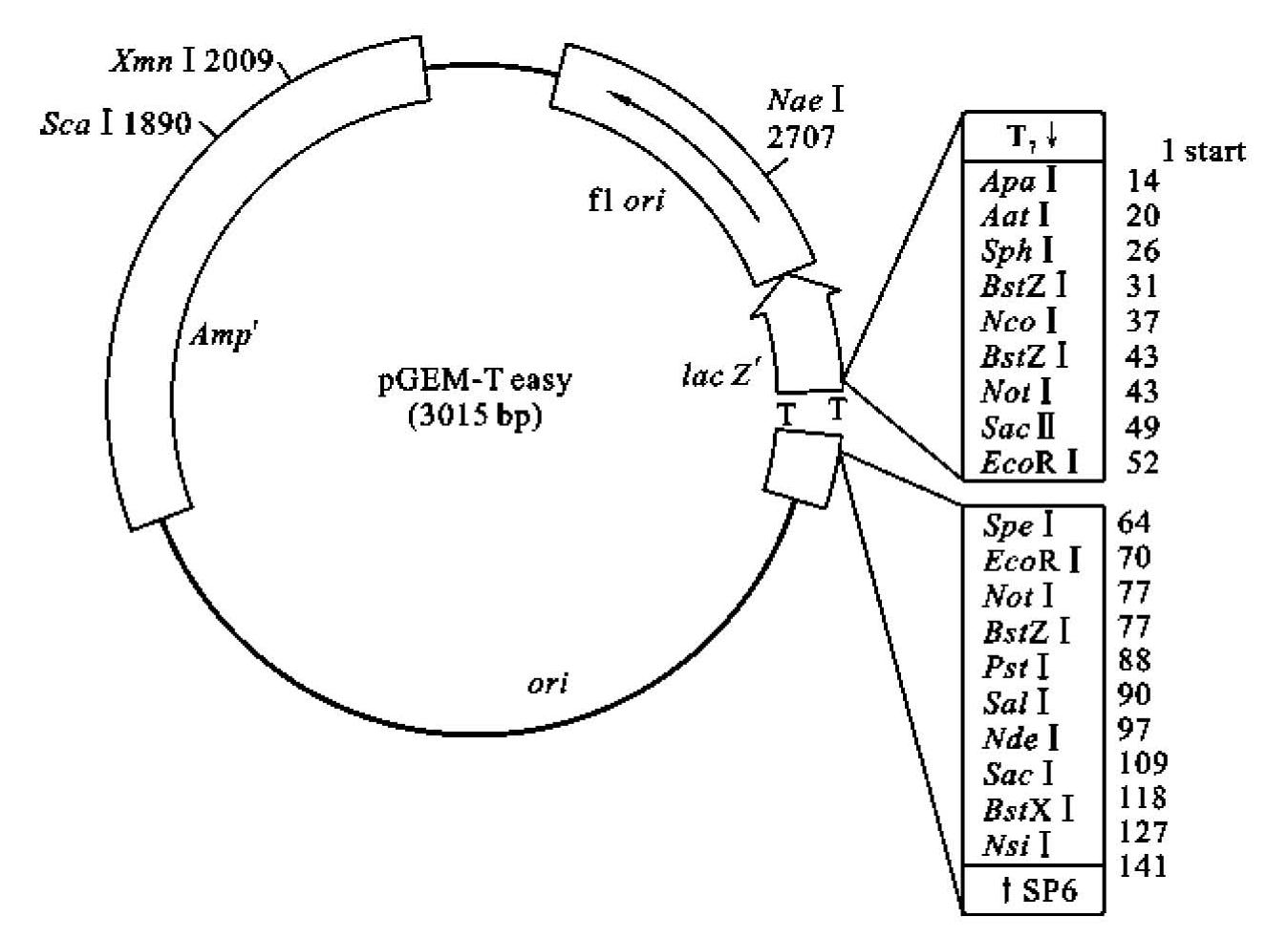
图3-6 pGEM-T easy载体结构
4.pET系列原核表达载体
Novagen公司设计构建的pET系列载体是一种实验室常用的蛋白原核表达系统(图3-7)。pET载体最初由Studier等于1986年构建,经过Novagen公司改造后的新的pET载体则使目的蛋白的克隆、检测以及纯化更加容易。目的基因被克隆到pET质粒载体上,其表达受噬菌体T7强转录及翻译信号调控。目的基因的表达由宿主细胞提供的T7RNA聚合酶诱导。在诱导条件下充分诱导时,几乎所有的细胞资源都用于表达目的蛋白,诱导表达后仅几小时,目的蛋白通常可以占到细胞总蛋白的50%以上。IPTG作为该系统的诱导物之一,可以通过调节IPTG浓度调节诱导水平,这样更有利于控制目的蛋白的可溶部分产量。而且,利用载体上带有的His-Tag融合标签可以快速纯化目的蛋白,尤其是以包含体形式表达的蛋白质,可以将蛋白质在完全变性条件下溶解,进行亲和纯化。该系统的另一个优点是在非诱导条件下,可以使目的基因完全处于沉默状态而不转录,这个优点对于克隆编码有毒蛋白基因非常有利。用不含T7RNA聚合酶的宿主菌克隆目的基因,可避免因目的蛋白对宿主细胞的可能毒性造成的质粒不稳定。如果用非表达型宿主细胞克隆,可以通过两种方法启动目的蛋白的表达:①通过在细菌培养基中加入IPTG来启动表达;②用带有受λpL和pI启动子控制的T7 RNA聚合酶的λCE6噬菌体侵染宿主细胞,或将质粒转入带有受lacUV5控制的T7RNA聚合酶基因的表达型细胞。配合pET载体常用的宿主菌包括BL21、BL21(DE3)以及BL21(DE3)pLysS。利用pET载体表达的蛋白质可以满足多种需要,如目的蛋白活性分析、制备抗体和蛋白质结构研究等。(https://www.daowen.com)
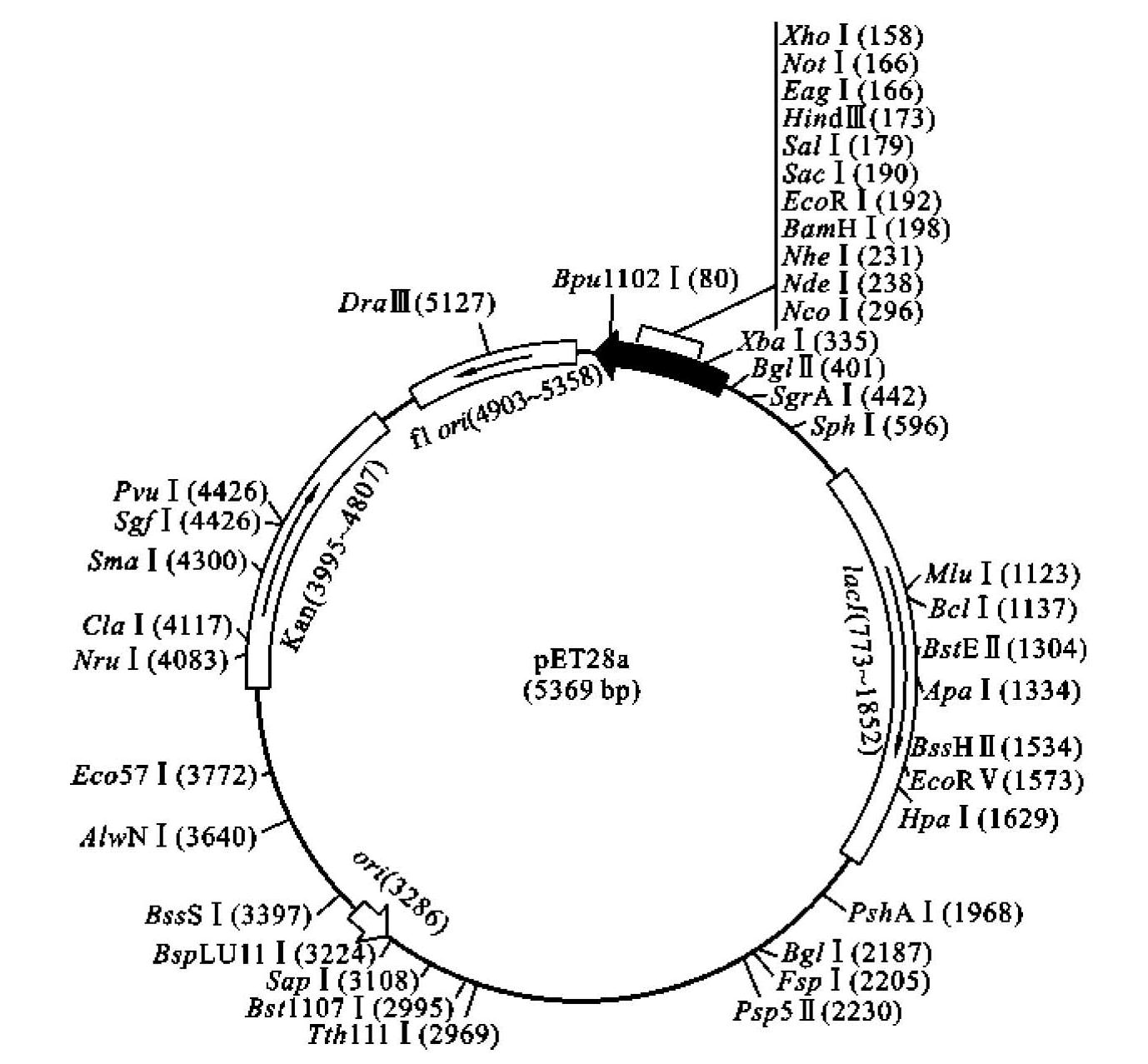
图3-7 pET28a载体结构
(引自Novagen,manual no.TB055,2003)
5.pGEX系列GST融合蛋白原核表达载体
pGEX是GE公司设计构建的GST融合蛋白原核表达pGEX系列载体。pGEX-6p-1载体结构如图3-8所示,将目的基因的开放阅读框(ORF)插入该载体MCS后,导入E.coli表达菌细胞中,在IPTG诱导条件下,可以表达目的蛋白和GST的融合蛋白。lac Ⅰ是大肠杆菌中乳糖操纵子的调节基因,它所表达的阻遏蛋白是乳糖操纵基因的抑制因子,这种阻遏蛋白能与过量的乳糖结合而失去对操纵基因的抑制,使乳糖操纵子上的结构基因lac Z(β-半乳糖苷酶基因)、lacY(透性酶基因)、lacA(乙酰基转移酶基因)得以正常表达。IPTG(异丙基-β-D-1-硫代半乳糖苷)作为乳糖的类似物与Lac Ⅰ阻遏蛋白结合而使操纵基因不被抑制。因此,IPTG经常作为乳糖操纵子的诱导剂而使用。在此载体结构中的基因型lac Ⅰq(lac Ⅰ基因发生变异)使其增加大量的表达阻遏蛋白,从而使乳糖操纵基因几乎完全被抑制。利用带有这种基因型的载体进行目的蛋白表达时,可以使目的基因的表达得到更有效的人为控制。pGEX载体所表达的GST标签相对分子质量为26000,它与目的蛋白形成融合蛋白有以下优点:①GST是高度可溶的蛋白质,可以增加外源蛋白的可溶性。②GST可以在大肠杆菌中大量表达,起到一种促进表达的作用。③利用GST标签可以通过亲和层析方法纯化融合蛋白。而且pGEX-6p-1表达出的融合蛋白在目的蛋白和GST标签间含有一个PreScission蛋白酶作用位点,可以在低温(4℃)下将融合蛋白上的GST标签卸下。这种设计更有利于防止目的蛋白在卸下GST标签过程中降解,而传统蛋白酶必须在常温甚至37℃下进行作用,这样会加速蛋白质的降解。此外,GST融合蛋白表达系统的另一个重要功能是可以用GST-pulldown技术分析蛋白质间的相互作用,这使其成为研究基因功能的辅助工具。
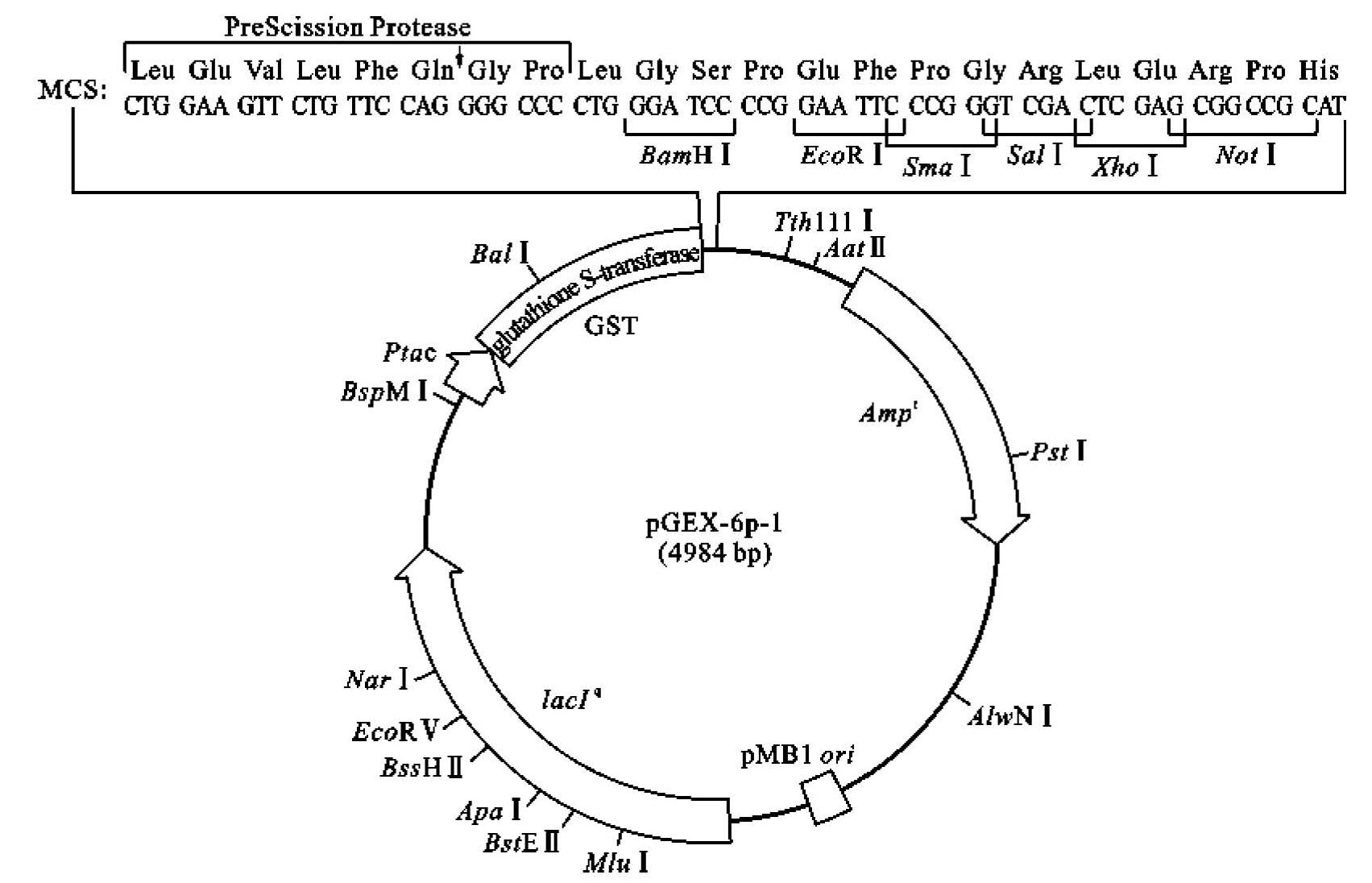
图3-8 pGEX-6p-1载体结构
(引自GE Healthcare,manual no.18-1157-58 AC,2013)
6.pcDNA3.1真核细胞表达系列载体
Invitrogen公司设计构建的pcDNA3.1系列载体是目前实验室中常用的真核细胞表达载体,大小约5.5 kb,是一种典型的穿梭载体,pUC ori使其可以在大肠杆菌细胞中稳定复制,人巨细胞病毒启动子PCMV可以引导外源基因在真核细胞中高效表达。因此,pcDNA3.1载体可以利用大肠杆菌进行外源基因克隆、筛选和目的基因扩增,在真核细胞中利用外源基因的高效表达进行基因功能相关研究。而且,在不同的pcDNA3.1载体中,表达产物可以融合V5-Tag和His-Tag标签,例如pcDNA3.1/V5-His载体如图3-9所示,V5-Tag可用于检测外源基因在真核细胞中的表达水平和细胞定位分析,利用His-Tag可以非常便利地将真核表达的外源蛋白分离纯化。同时,pcDNA3.1系列载体也可以用于目的基因在真核细胞中的稳定表达细胞系的构建。由于载体内部含有Neor抗性基因,因此可以用G418筛选真核细胞稳定转染细胞系。这些优秀的特点使pcDNA3.1载体成为在真核细胞中进行蛋白表达、纯化和基因功能研究的便利工具。
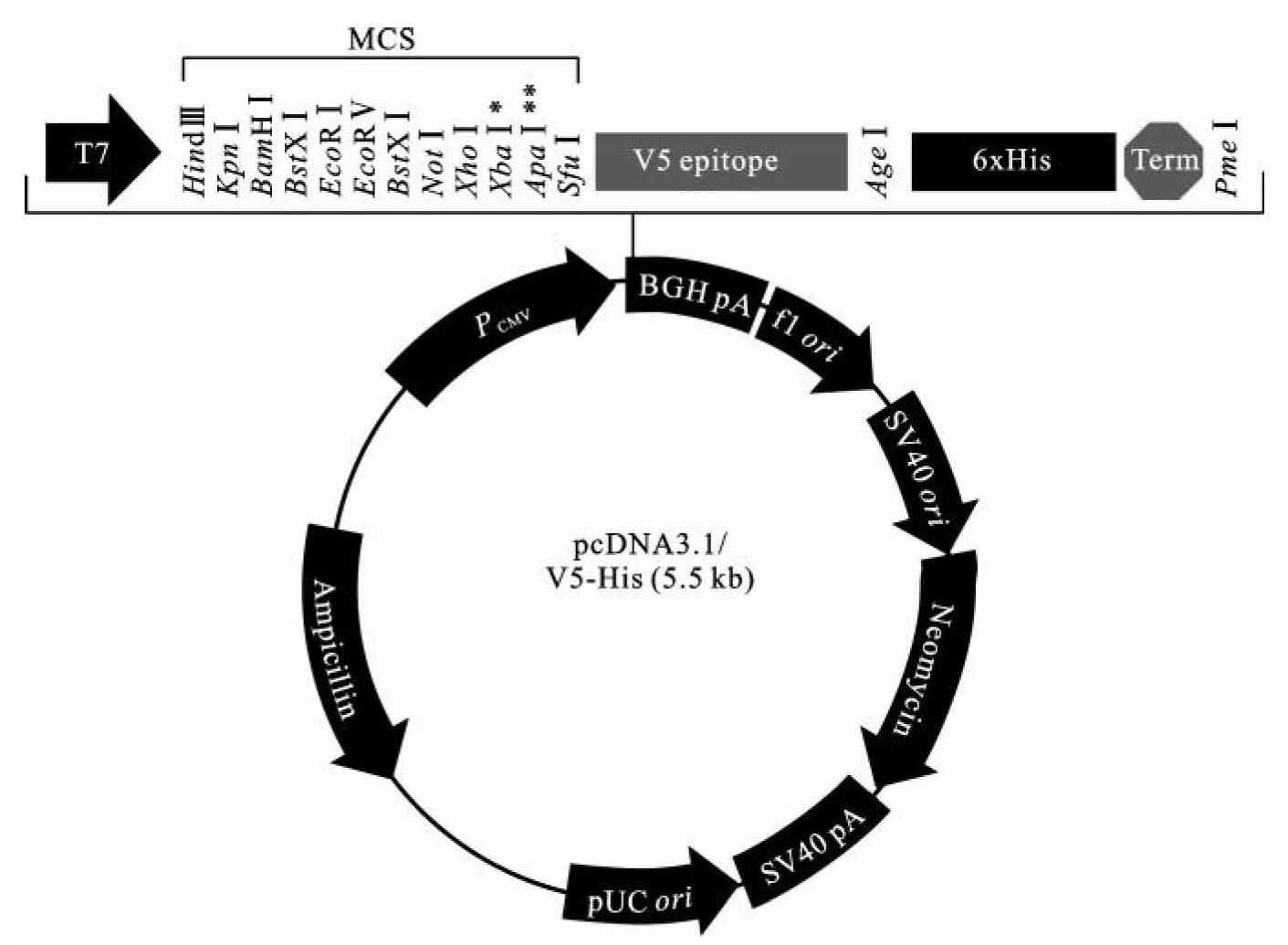
图3-9 pcDNA3.1/V5-His载体结构
(引自Invitrogen,manual no.28-0141,2010)
7.pEGFP系列目的蛋白亚细胞定位载体
BD公司设计构建的载体pEGFP-N1和pEGFP-Cl经常用来分析目的基因的表达产物在细胞内的位置,即亚细胞定位分析。具有特定功能的蛋白质通常含有一段细胞内定位信号肽链,通过特异受体对这段肽链的识别和结合,将其运输到细胞内特定的位置发挥功能,例如,通常转录因子带有核定位信号。因此,在研究未知功能的基因时,其表达产物在细胞内的位置可以给研究人员提供很多基因功能的线索。虽然利用目的蛋白的抗体进行免疫组织化学分析是一种更理想的分析方法,但在通常情况下无法购得未知功能的新基因的表达蛋白抗体。因此,利用pEGFP系列载体进行亚细胞定位是一种简单、快捷、低成本的解决办法。
pEGFP系列载体提供了两种EGFP融合蛋白表达策略,即如果计划把目的蛋白连接在EGFP的C末端,选择pEGFP-C1型载体,此时必须保证目的基因和EGFP在相同的密码子阅读框内;如果计划把目的蛋白连接在EGFP的N末端,选择pEGFP-N1末端,此时注意目的基因插入载体时必须去除终止密码子,而且不能导致EGFP密码子阅读框改变。pEGFP-N1载体结构如图3-10所示,载体中人巨细胞病毒启动子(CMV promoter)可以引导融合蛋白在真核细胞中高效表达,利用新霉素抗性基因(Neor)可以进行真核细胞稳定转化子的G418筛选。此系列载体属于穿梭载体,pUC ori和SV40 ori保证了载体在大肠杆菌和真核细胞内都可以进行自主复制,利用卡那霉素抗性基因(Kanr)可以实现在大肠杆菌中的转化子筛选。
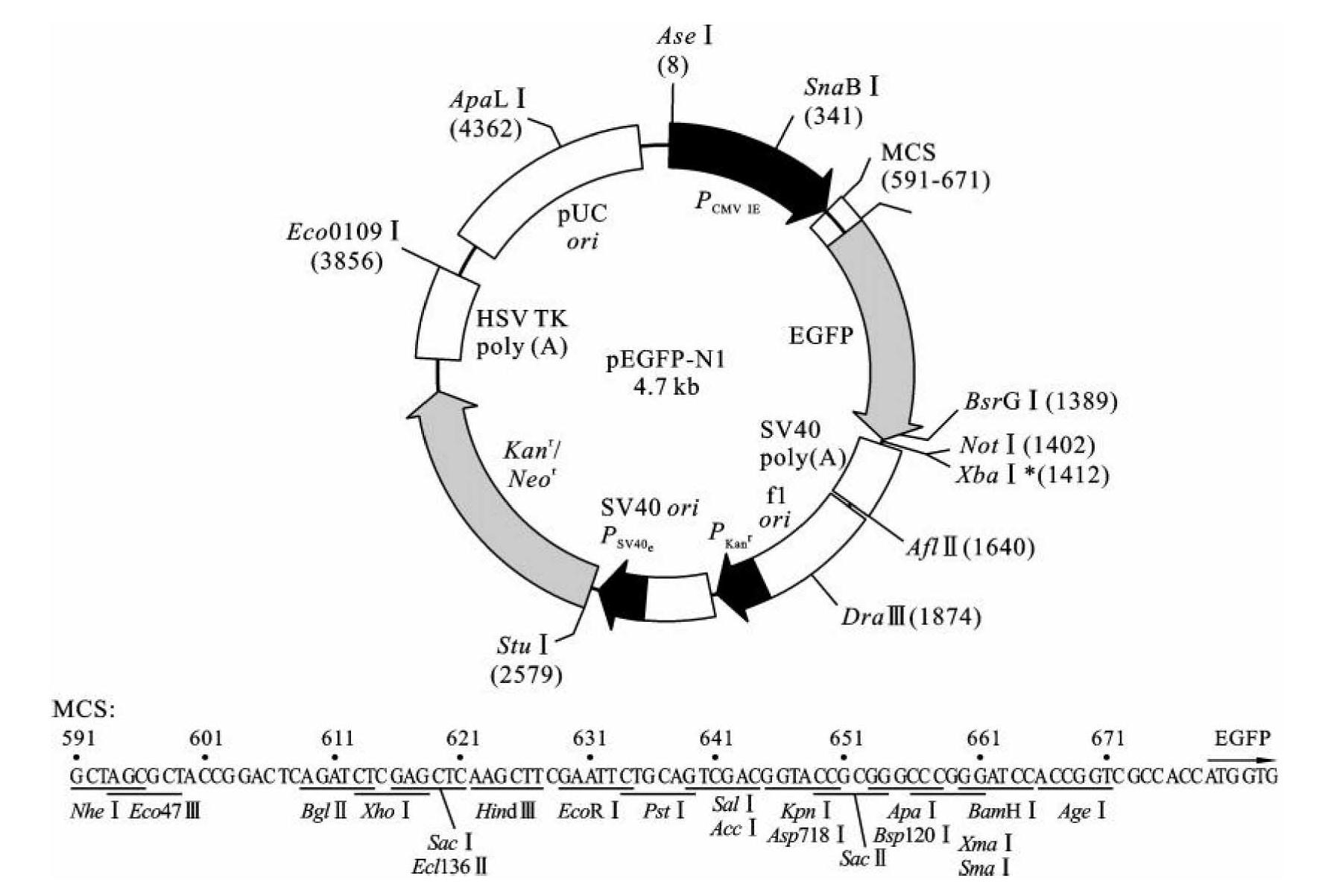
图3-10 pEGFP-N1载体结构
(引自BD Biosciences Clontech,manual no.28-0141,2010)
8.pGL3系列基因启动子活性探针分析载体
Promega公司的pGL3系列载体是大小为4.8~5.2 kb的探针型载体。它可用于分析目的DNA片段在特定遗传背景下对下游基因的调控活性,也可以用来分析调控蛋白和目的DNA片段相互作用对基因转录活性的影响。pGL3-Basic载体结构如图3-11所示,载体MCS下游含有萤火虫荧光素酶编码基因,且此基因上游不含有启动子结构。在此结构中萤火虫荧光素酶发挥报告基因的作用,当外源DNA片段插入MSC区域时,外源DNA片段发挥调控序列的启动子功能,引导萤火虫荧光素酶表达,其表达水平直接反映出外源DNA调控基因表达的能力。萤火虫荧光素酶的表达量可以通过光度计检测。光度计是酶与底物相互作用催化化学发光的监测系统,具有灵敏度高、速度快、可定量操作的优点。pGL3系列载体内部含有Ampr抗性基因,便于大肠杆菌转化子的筛选。在萤火虫荧光素酶基因下游含有SV40 poly(A)信号序列,可以增加萤火虫荧光素酶在真核细胞中的稳定性。凭借这样的特点,pGL3系列载体已经成为研究DNA序列的启动子活性和调控功能的便利工具。
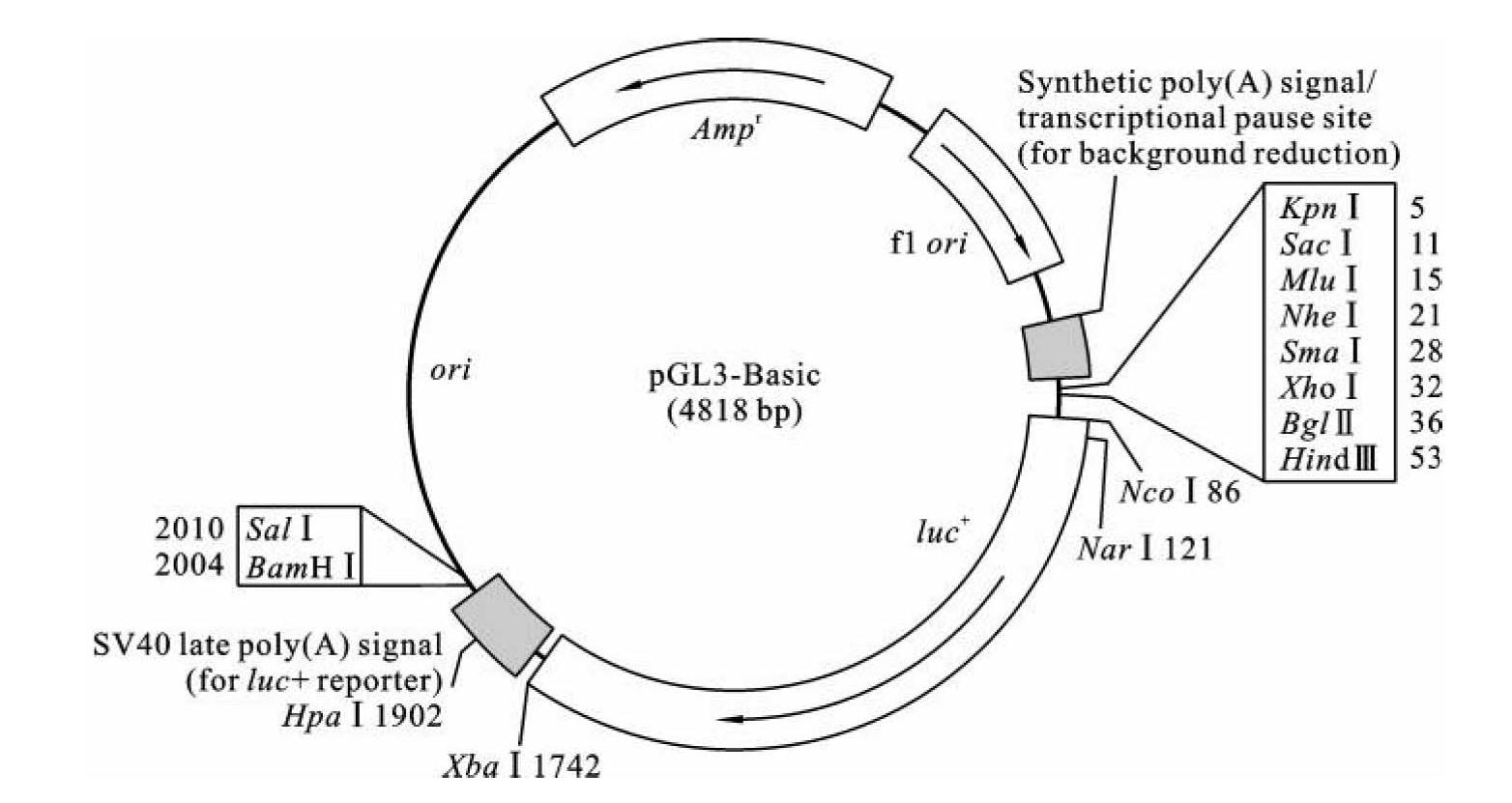
图3-11 pGL3-Basic载体结构
(引自Promega,manual no.TM033,2002)
9.pSilencer 4.1-CMV siRNA表达载体
siRNA分子是一类双链RNA小分子,它可以通过细胞内RNA干涉(RNAi)过程和目的基因mRNA互补序列结合,降解目的基因mRNA,从而降低目的基因表达量(原理见11.3节)。目前,RNAi技术已经成为研究基因功能的常规技术,被广泛用于哺乳动物基因功能研究。在早期研究中,通常将体外制备的siRNA分子转染到细胞内,使其发挥RNA干涉作用,只能维持6~10天降低目的基因的作用,伴随细胞分裂和siRNA降解,RNAi作用消失。伴随基因工程载体的发展,目前通常的做法是将可以表达出功能性siRNA或shRNA的基因功能载体转染进入受体细胞,由于siRNA表达载体在细胞中可以更加稳定地表达siRNA分子,因此这种方法可以获得更加持久的降低目的基因表达量的作用,可以达到数周或数月。Life Technologies公司的pSilencer 4.1-CMV siRNA表达载体结构如图3-12所示,此载体结构中人巨细胞病毒CMV启动子可以引导插入Hind Ⅲ和BamH Ⅰ酶切位点间的siRNA模版在哺乳动物细胞中的高效转录,利用新霉素抗性基因(Neor)的G418筛选可以在哺乳动物细胞内筛选转化子,建立pSilencer 4.1载体的稳定转染细胞系;其内部的ColE1 origin可以引导其在大肠杆菌内的稳定复制,而氨苄青霉素抗性筛选标记基因(Ampr)可以被用来在大肠杆菌细胞内筛选转化子。
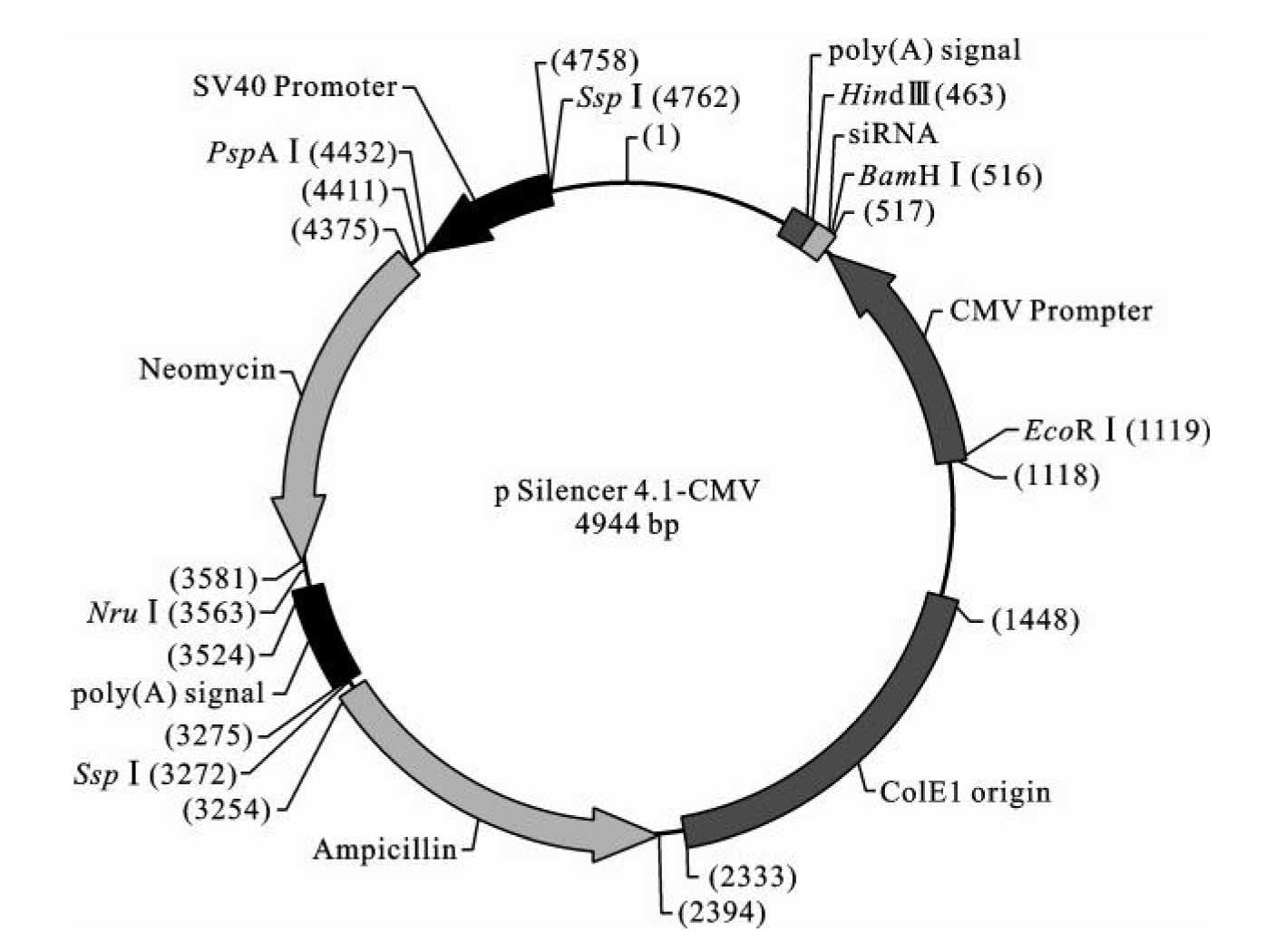
图3-12 pSilencer 4.1-CMV siRNA表达载体结构
(引自Ambion,manual no.AM5779,2008)
