7.2.2 大肠杆菌表达系统
大肠杆菌表达系统是基因表达技术中应用最早和最广泛的经典表达系统。随着分子生物学技术的不断进步,大肠杆菌表达系统也不断得到完善和发展。与其他表达系统相比,大肠杆菌表达系统具有遗传背景清楚、操作简单、转化导入效率高、培养周期短、抗污染能力强、成本低、目的基因表达水平高等优点。因此,大肠杆菌表达系统在基因表达技术中占有重要的地位,是分子生物学研究和生物技术产业化发展进程中的重要工具。
1.大肠杆菌表达载体的特征
大肠杆菌质粒是一类独立于染色体外自主复制的双链、闭环DNA分子。大肠杆菌质粒可分为接合转移型和非接合转移型两种。非接合转移型质粒在通常培养条件下不在宿主间转移,整合到染色体上的频率也很低,具有遗传学上的稳定性和安全性。又因其大小一般在2~50 kb范围内,适合于制备和重组DNA的体外操作,因此几乎所有的大肠杆菌表达系统都选用非接合转移型质粒作为运载外源基因的载体,这些表达载体通过对天然质粒的改造获得。理想的大肠杆菌表达载体具有以下特征:①具有稳定的遗传复制、传代能力,在无选择压力下能存在于大肠杆菌细胞内;②具有显性的转化筛选标记;③启动子的转录是可以调控的,抑制时本底转录水平较低;④启动子转录的mRNA能够在适当的位置终止,转录过程不影响表达载体的复制;⑤具备适用于外源基因插入的酶切位点。复制子、筛选标记、启动子、终止子和核糖体结合位点是构成表达载体的最基本元件。
2.各种类型大肠杆菌表达系统的构成及特点
一个完整的大肠杆菌表达系统至少要由表达载体和宿主菌两部分构成。为了改善表达系统的性能和提高对各类外源基因的适应能力,表达系统有时还需要有特定功能基因的质粒或溶源化噬箘体参与。到目前为止,已经成功发展了许多表达载体和相应的宿主菌。
1)Lac和Tac表达系统
(1)原理:Lac表达系统是以大肠杆菌lac操纵子调控机理为基础设计、构建的表达系统。lac操纵子在无诱导物的情况下,负调节因子lacⅠ基因产物(阻遏蛋白)与启动子下游的操作基因紧密结合,阻碍转录的起始。在诱导剂IPTG存在的情况下,IPTG与阻遏蛋白结合后,导致与操纵基因的结合能力降低而解离出来,lac操纵子的转录因此被激活。野生型lac操纵子受启动子上游的CAP位点调控,但lacUV 5突变体能够在没有CAP存在的情况下非常有效地起始转录,受它控制的基因在转录水平上只受lacⅠ的调控,因此,lacUV5突变体的启动子常用于构建表达载体,便于操作。
用tac启动子构建的表达系统称为Tac表达系统。tac启动子是由trp启动子的—35序列和lacUV 5的Pribnow序列(—10序列)拼接而成的杂合启动子,调控模式与lacUV5相似,但mRNA的转录水平比trp启动子和lacUV 5启动子更高。当需要有较高基因表达水平时,选用tac启动子比用lacUV 5启动子更优越(图7-3)。
(2)Lac和Tac表达系统的应用:在Lac和Tac表达系统中,使用的诱导物IPTG具有一定的毒性,从安全角度考虑,对表达和制备用于医疗目的的重组蛋白是不适合的。有些国家规定:在生产人用的重组蛋白的生产工艺中不能使用IPTG。于是就需要其他诱导方法:①温度诱导。将阻遏蛋白LacⅠ的温度敏感突变株lacⅠ(ts)应用于Lac和Tac表达系统。这些突变体基因插入表达载体或整合到染色体后,均能使lac和tac启动子的转录受到温度严谨调控,在较低温度(30℃)时抑制,在较高温度(42℃)时开放。②乳糖诱导。用乳糖替代IPTG作为诱导物。乳糖要通过转运和转化等过程变为异乳糖,才能变为诱导物,但其效率受到多种因素的影响和制约,因此乳糖诱导的有效剂量大大高于IPTG。乳糖本身作为一种碳源可以被大肠杆菌代谢利用,较多的乳糖存在也会导致菌体生理及生长特性变化。乳糖代替IPTG作为诱导剂的研究要与发酵工艺结合起来,才能显示其良好的前景。
2)PL和PR表达系统
(1)原理:以λ噬箘体早期转录启动子PL、PR为核心构建的表达系统称为PL和PR表达系统。启动子PL、PR具有很强的启动转录功能,利用它们来构建表达载体并控制外源基因在大肠杆菌表达系统中表达。PL、PR启动子的转录是由λ噬箘体PE启动子控制的cⅠ基因编码的阻遏物调控的。cⅠ基因的产物在E.coli中的浓度取决于一系列宿主与噬菌体因子之间的错综复杂的平衡关系,因此,通过细胞因子来控制cⅠ因子的产生和消失是相当困难的。利用温度敏感突变体c Ⅰ857(ts)的基因产物来调控PL、PR启动子的转录,它在较低温度(30℃)时以活性形式存在,在较高温度(42℃)时失活。
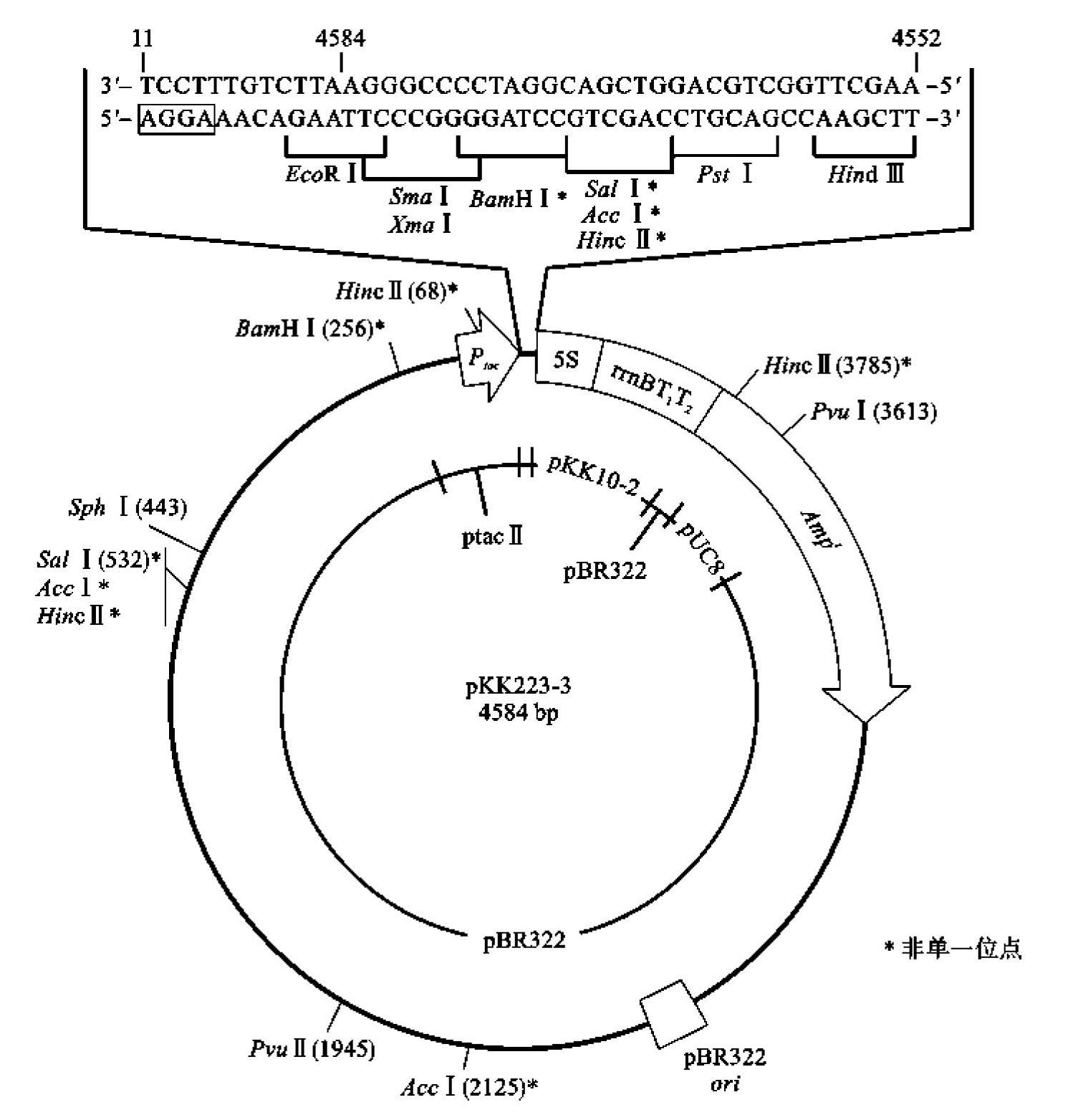
图7-3 tac启动子调控的大肠杆菌表达载体pKK223-3结构图
(引自孙明,2006)
带有PL、PR启动子的表达载体在普通大肠杆菌中相当不稳定,这是因为菌体中没有cⅠ基因的产物,PL或PR启动子高强度直接转录。解决这个问题的办法之一是用溶源化λ噬箘体的大肠杆菌cⅠ+菌株作为PL和PR启动子表达载体的宿主菌,例如N99cⅠ+菌株(溶源化野生型λ噬箘体)、N4830-1菌株和POP2136菌株(溶源化c Ⅰ857(ts)λ噬箘体)等;办法之二是把cⅠ857(ts)基因组装在表达载体上,这样就可以有更大的宿主菌选择范围。
(2)PL和PR表达系统的应用:由于PL和PR表达系统在诱导这一环节上不加入化学诱导剂,成本又低廉,因此最初几个在大肠杆菌中制备的药用重组蛋白质都采用PL或PR表达系统。利用温度诱导的方法,采用较高温度(42℃),使cⅠ因子失活,可以诱导外源基因在大肠杆菌中大量表达。此表达系统的缺陷如下:首先是在热刺激过程中,大肠杆菌热休克蛋白的表达也会被激活,其中一些是蛋白水解酶,有可能降解所表达的重组蛋白;其次是在大体积发酵培养菌体时,通过热平衡交换方式把培养温度从30℃提高到42℃需要较长的时间,这种缓慢的升温方式影响诱导效果,对重组蛋白的表达量有一定的影响。(https://www.daowen.com)
3)T7表达系统
(1)原理:利用大肠杆菌T7噬箘体转录体系中的转录元件为基础构建的表达系统称为T7表达系统。T7噬箘体基因1编码的T7 RNA聚合酶选择性地激活T7噬箘体启动子的转录。它是一种高活性的RNA聚合酶,合成mRNA的速度比大肠杆菌RNA聚合酶快5倍,并可以转录某些不能被大肠杆菌RNA聚合酶有效转录的序列。在细胞中存在T7RNA聚合酶和T7噬箘体启动子的情况下,大肠杆菌宿主本身基因的转录竞争力低于T7噬箘体转录体系。最终受T7噬箘体启动子控制的基因的转录能达到很高的水平。T7表达载体启动子选用的是T7噬箘体主要外壳蛋白φ10基因的启动子。pET系列载体是这类表达载体的典型代表。
(2)T7表达系统的应用:外源基因在T7表达系统的表达完全受T7 RNA聚合酶调控,T7 RNA聚合酶的转录调控的模式决定了表达系统的调控方式。T7 RNA聚合酶的调控模式如下:①噬箘体DE3是λ噬箘体的衍生株,一段含有lacⅠ、lacUV5启动子和T7RNA聚合酶基因的DNA片段被插入其int基因中,如用含有噬箘体DE3的溶源菌(如BL21(DE3)、HMS174(DE3)等)作为表达载体的宿主菌,调控方式为化学信号诱导(IPTG),类似于Lac表达系统(图7-4)。②噬箘体CE6是λ噬箘体含有裂解缺陷突变和温度敏感突变的衍生株,其T7RNA聚合酶基因处于PL启动子控制下。噬箘体CE6转染宿主菌后可通过热脉冲诱导方式激发T7噬箘体启动子的转录。这种在需要时才把T7 RNA聚合酶基因导入的方式可以使本底转录降到很低的水平,尤其是用于表达对大肠杆菌宿主有毒性的重组蛋白质。③T7 RNA聚合酶可以由共转化质粒提供。大肠杆菌GJ100含有透明颤菌血红蛋白基因(vgb)启动子控制下的T7RNA聚合酶基因表达质粒。vgb基因的转录是受环境溶解氧浓度控制的。在贫氧条件下vgb基因的启动子被激活。用GJ100作为宿主时,表达系统调控方式为贫氧诱导型。
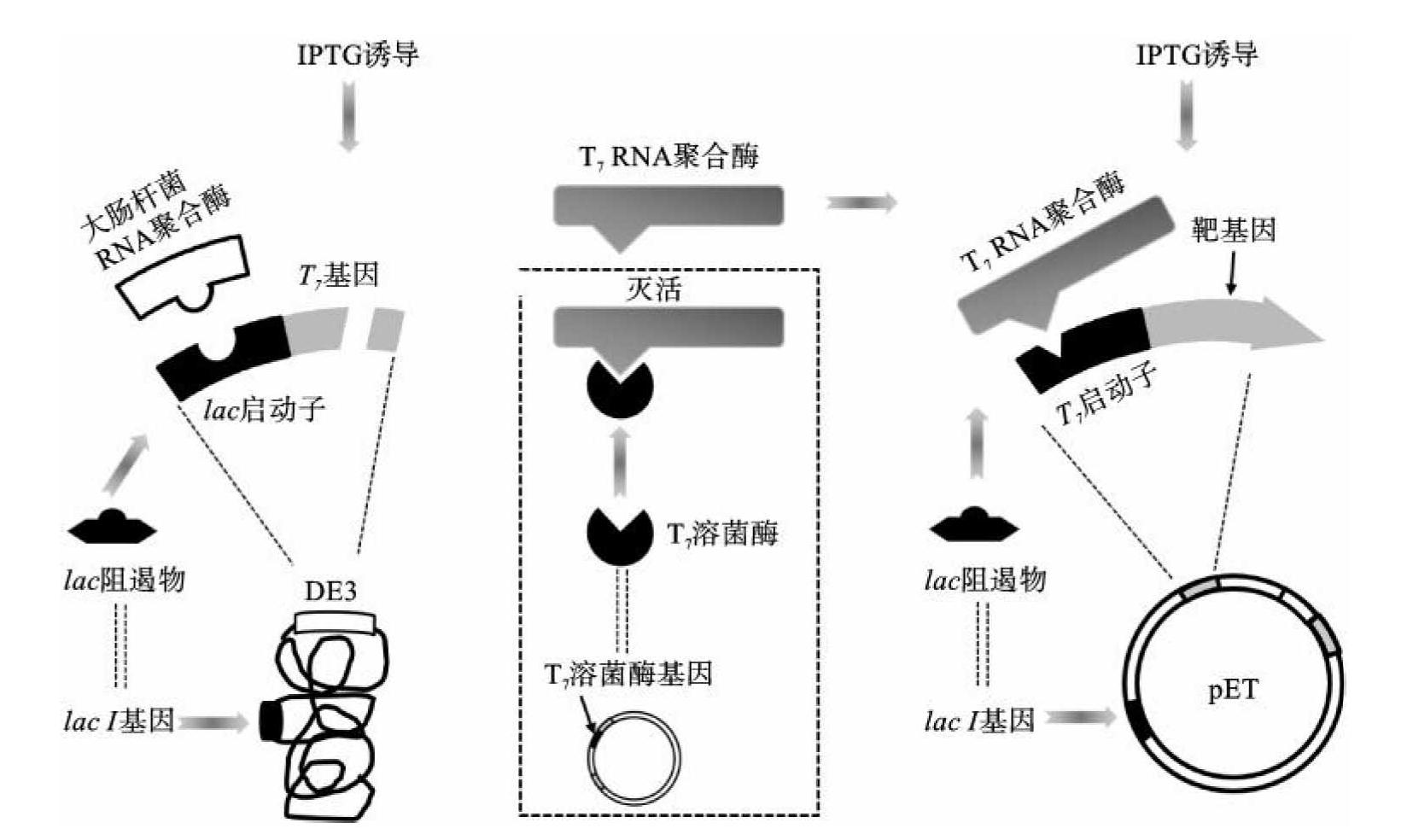
图7-4 大肠杆菌T7RNA聚合酶表达系统
T7表达系统表达目的基因的水平是目前所有表达系统中最高的,但也不可避免产生相对较高的本底转录,如果目的基因产物对大肠杆菌宿主有毒性,就会影响它的生长。解决这一问题的办法之一就是在表达系统中低水平表达T7溶菌酶基因。因为T7溶菌酶除了作用于大肠杆菌细胞壁上的肽聚糖外,还与T7 RNA聚合酶结合抑制其转录活性。目前T7溶菌酶基因都通过共转化质粒导入表达系统,它能明显降低本底转录,但对诱导后目的基因的表达水平没有明显影响。
4)其他诱导表达系统
(1)营养调控型:采用大肠杆菌碱性磷酸酶基因phoA启动子或甘油3'-磷酸转移系统ugp启动子构建的表达载体,受培养基中的无机磷浓度调控。无机磷浓度大于5 mmol/L时抑制,无机磷浓度小于1 mmol/L时激活。
(2)糖原调控型:采用大肠杆菌岩藻糖转移系统mgl启动子或沙门氏菌阿拉伯糖基因araB启动子构建的表达载体,受葡萄糖抑制,岩藻糖和阿拉伯糖分别是它们的诱导物。
(3)pH调控型:采用大肠杆菌赖氨酸脱羧酶基因cadA启动子构建的表达载体,cadA启动子受培养基中的H+浓度调控。pH>8时抑制,pH<6时激活,pH=6时,转录活力最高。
(4)溶解氧调控型:采用大肠杆菌丙酮酸甲酸裂解酶基因pfl启动子、硝基还原酶基因nirB启动子或透明颤菌血红蛋白基因vgb启动子构建的表达载体,含有对氧响应的调节因子fnr的作用位点。在富氧条件下转录被抑制,在贫氧和微氧条件下转录被激活。
(5)生物素调控型:采用大肠杆菌生物素操纵子及其调控区构建的表达载体,在培养基生物素浓度低于2 ng/mL时,生物素启动子被激活。
