5.5.2 抑制差减杂交技术
生物体的各种生命活动和基因的时空表达差异密切相关,通过比较组织器官在不同生理状态下或在不同生长发育阶段的基因表达差异,可为剖析生命活动过程提供重要信息。抑制差减杂交(SSH)技术是一种基于抑制PCR和扣除杂交技术建立的,在转录水平上研究基因表达的技术,具有稳定、高效、可靠的特点,可对生物的生长、发育、衰老、死亡等生命过程及生物或非生物逆境胁迫对生物所造成的影响等进行全面、系统的分析。
1.SSH技术的基本原理
SSH技术是基于抑制PCR和扣除杂交技术建立的技术,兼具扣除杂交技术的消减富集和抑制PCR技术的高效富集的特点。该技术运用杂交二级动力学原理(高丰度的单链DNA/cDNA序列在退火时产生同源杂交的速度比低丰度的更快),使原本在不同丰度的单链DNA序列相对含量趋于一致。抑制PCR则是利用链内退火优于链间退火的特性,两端接上同一接头的非目的序列片段,由于具有反向重复序列,在退火时容易形成类似发夹的互补结构,在PCR中不能作为模板与引物配对,从而选择性扩增目的基因,而抑制非目的基因片段的扩增。扣除杂交消减了实验组和对照组之间同源序列,结合抑制性PCR的动力学富集,从而高效分离低丰度特异性非同源片段。
2.SSH技术的操作过程
SSH技术的操作过程如图5-16所示,表达目的基因的称为试验组(tester),不表达目的基因的称为驱动组(driver)。具体步骤如下:
(1)限制性核酸内切酶RsaⅠ酶切试验组与驱动组的cDNA后得到平末端。
(2)将试验组cDNA分成两份,分别接上接头1和接头2。接头是由一长链(40 nt)和一短链(10 nt)组成的一端是平端的双链DNA片段,长链3'端与cDNA 5'端相连。长链外侧序列(约20 nt)与第一次PCR引物序列相同,而内侧序列则与第二次引物序列相同。此外,接头上含有T7启动子序列及限制酶切位点,为以后连接载体和测序提供方便。
(3)用过量的驱动组cDNA样品分别与两份试验组样品进行第一次扣除杂交,每一杂交体系产生a、b、c和d四种类型的产物,由于试验组与驱动组cDNA中序列相同片段大都形成异源双链分子,这种不充分杂交使得单链cDNA分子在浓度上基本相同,原来在丰度上有差别的单链cDNA达到均一化,使得试验组cDNA中差异表达基因得到第一次富集。
(4)混合两份杂交样品,同时加入新的变性驱动组cDNA进行第二次扣除杂交。此次杂交只有第一次杂交后经扣除和丰度均等化的单链试验组cDNA能与驱动组cDNA形成双链分子。这一次杂交进一步富集了差异表达的cDNA,并且形成了两个5'端分别接不同接头的双链分子e。
(5)5'填平末端,加入根据接头长链序列设计的内、外侧引物进行PCR扩增。第一次PCR是基于其抑制效应,只有两端连有不同接头(接头1和接头2)的差别表达片段进行指数式扩增,而两端连接上同一接头的同源双链片段仅呈线性扩增,非目标序列因两端存在反向重复序列,退火时易产生类似锅柄的结构,无法与引物配对,扩增受到抑制。第二次PCR极大提高扩增的特异性,使得差异表达的目的基因片段得到大量富集,并可用于后续的筛选工作。
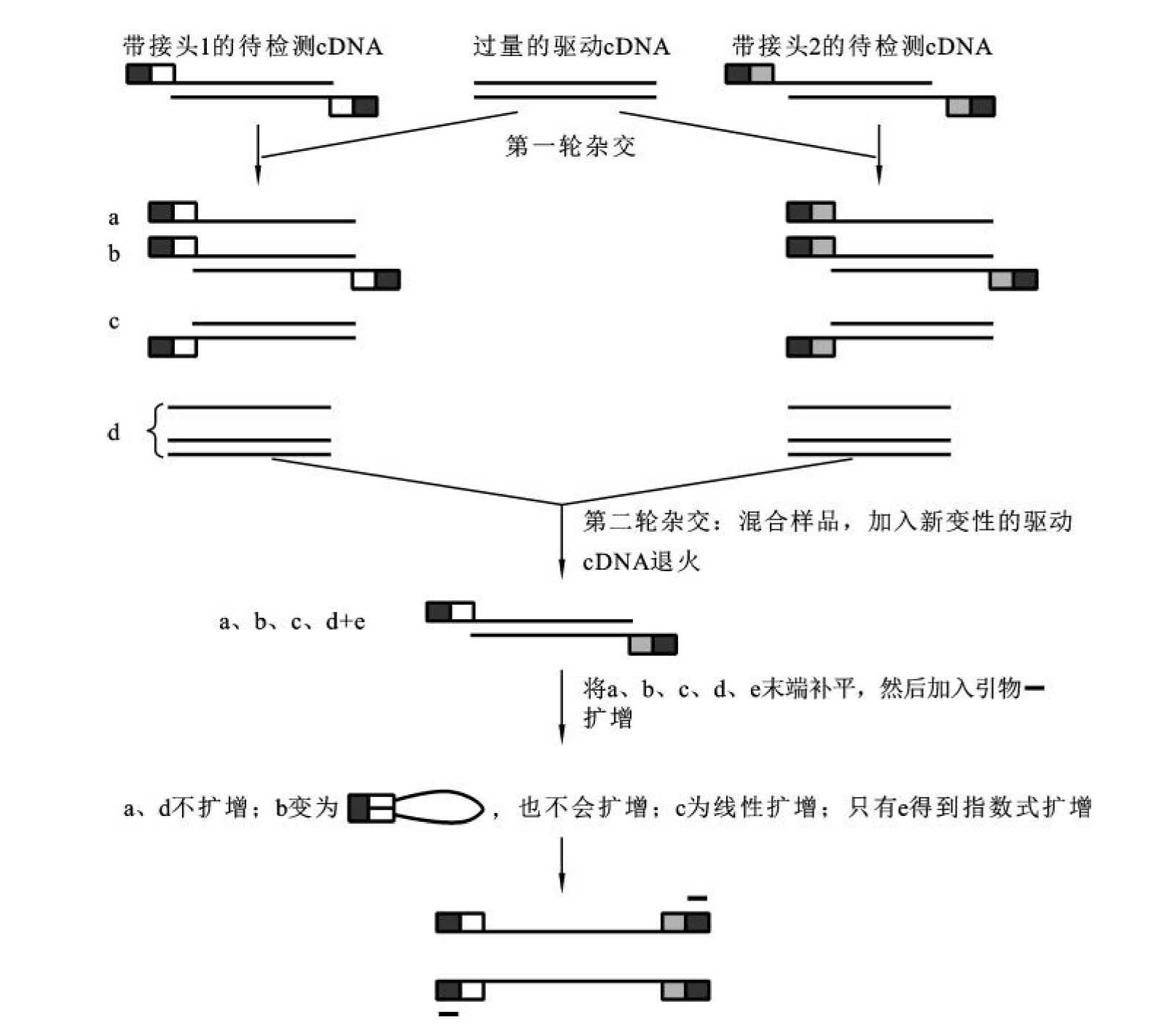
图5-16 抑制差减杂交技术
(引自阮红,2007)
(6)克隆PCR产物,构建扣除文库和筛选文库。
3.SSH技术的应用
SSH技术是依据扣除杂交和抑制PCR分离差异表达基因的方法,主要用于分离两种细胞或两种组织的细胞中的差异表达基因。利用这种有效的技术来比较两个mRNA群体,并获得只在一个群体中过量表达或特异性表达的基因的cDNA。SSH技术以其假阳性率低、灵敏度高、背景值低、重复性强和检测范围广等优点迅速得到广泛应用,已成功应用于不同细胞株、不同器官组织、个体不同发育阶段以及机体在外界因子作用下差异表达基因,在动植物发育、肿瘤与疾病,以及外界因子诱导组织细胞中相关的应答基因特别是分离低丰度差异表达基因的分析和克隆方面具有广阔的应用前景。
