2.1.4 影响限制性核酸内切酶活性的因素
影响限制性核酸内切酶活性的因素有许多,概括起来主要有以下几种。
1.DNA的纯度
限制性核酸内切酶消化DNA底物的反应效率,很大程度上取决于所使用的DNA本身的纯度。在DNA样品中常见的一些物质,如蛋白质、酚、氯仿、乙醇、乙二胺四乙酸(EDTA)、SDS(十二烷基硫酸钠),以及高浓度的盐离子等,都有可能抑制核酸内切酶的活性。所以高纯度的DNA样品对酶解反应是必需的。当条件受到限制,且必须在DNA纯度不高的情况下进行切割时,一般采用以下几种方法。
(1)增加限制性核酸内切酶的用量,平均每微克底物DNA可高达10单位甚至更多些。
(2)扩大酶催化反应的体积,以使潜在的抑制因素被相应地稀释。
(3)延长酶催化反应的保温时间。
(4)在反应混合物中加入终浓度为1~2.5 mmol/L的多聚阳离子亚精胺,有利于限制性核酸内切酶对基因组DNA的消化作用。由于在4℃下亚精胺会促使DNA沉淀,因此应将反应混合物在适当的温度下保温数分钟之后方可加入。
还有些DNA样品中会因污染而有少量的DNase。由于DNase的活性需要有Mg2+的存在,在DNA的储存缓冲液中含有二价金属离子螯合剂EDTA,因此,在这种制剂中DNA不会被DNase降解。然而在加入了限制性核酸内切酶缓冲液之后,DNA则会被DNase迅速地降解掉。要避免发生这种情况,唯一的办法就是使用高纯度的DNA。
2.DNA的甲基化程度
在真核生物和原核生物中存在大量的甲基化酶(methylase)。原核生物中的甲基化酶作为限制与修饰系统中的一员,用于保护宿主DNA使其不被相应的限制性核酸内切酶切割,所以当识别序列中特定核苷酸发生甲基化时,便会强烈地影响限制性核酸内切酶的活性。在E.coli中,大多数有两种位点特异性的DNA甲基化酶:一种是dam甲基化酶(DNA adenine methylase),可在GATC序列中的腺嘌呤N(6)位置上引入甲基;另一种是dcm甲基化酶(DNA cytosine methylase),识别CCAGG或CCTGG序列,在第二个胞嘧啶的C(5)位置上引入甲基。

通常从大肠杆菌宿主细胞中分离而来的质粒DNA,都混有这两种作用于特定核苷酸序列的甲基化酶,因此,质粒DNA只能被限制性核酸内切酶局部消化,甚至完全不能消化,是属于对甲基化作用敏感的一类。为了避免产生这样的问题,在基因克隆中使用失去了甲基化酶的大肠杆菌菌株制备质粒DNA。
限制性核酸内切酶不能够切割甲基化的核苷酸序列,这种特性在有些情况下是很有用的。例如,当甲基化酶的识别序列同某些限制性核酸内切酶识别序列相邻时,就会抑制在这些位点的切割作用,这样便改变了限制性核酸内切酶识别序列的特异性。另一方面,若要使用合成的衔接物修饰DNA片段的末端,一个重要的处理是在衔接物被酶切之前,通过甲基化作用将内部的限制性核酸内切酶识别位点保护起来。(https://www.daowen.com)
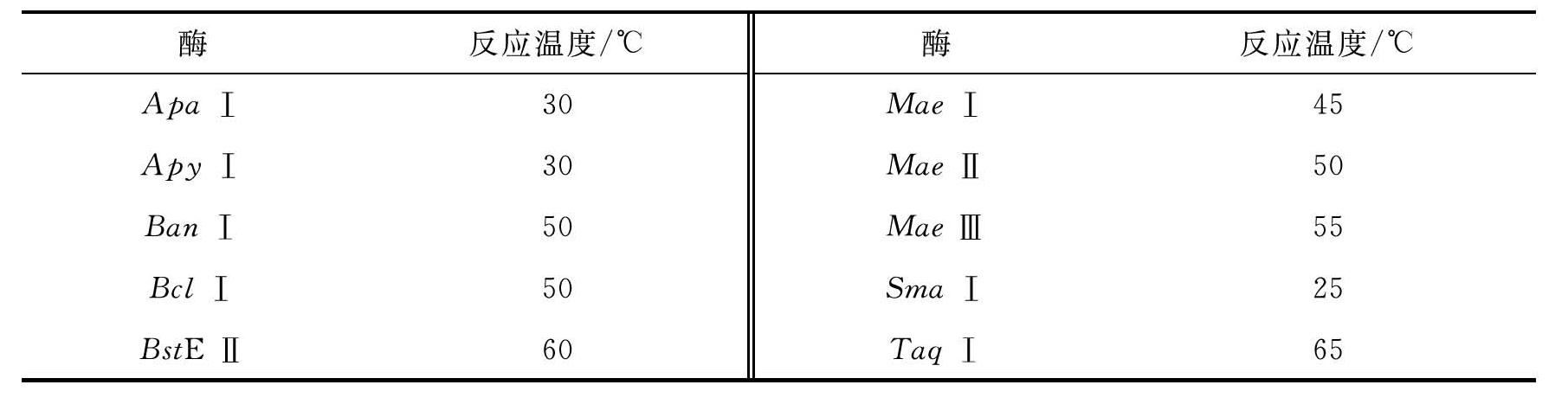
3.酶切反应的温度
大多数限制性核酸内切酶的标准反应温度都是37℃,但也有例外(表2-2)。如Sma Ⅰ是25℃,Apa Ⅰ是30℃,Mae Ⅰ是45℃,有的甚至高达60℃以上,如BstE Ⅱ是60℃等。消化反应的温度低于或高于最适温度,都会影响限制性核酸内切酶的活性,甚至最终导致完全失活。如Taq Ⅰ限制性核酸内切酶,正常反应温度为65℃,在37℃时酶活性只有在65℃时的10%;Apo Ⅰ正常反应温度为50℃,在37℃时酶活性只有在50℃时的50%。
表2-2 部分限制性核酸内切酶的最适反应温度
4.DNA分子结构
DNA分子的不同构型对限制性核酸内切酶的活性也有很大的影响。某些限制性核酸内切酶,切割超螺旋的质粒DNA或病毒DNA所需要的酶量要比消化线状DNA的高出许多倍,最高的可达20倍。
还有些限制性核酸内切酶切割它们自己的处于不同部位的限制位点,其效率也有明显的差别,即对同一底物中的有些位点表现出偏爱性切割,这种现象称为位点偏爱(site preference)。例如EcoR Ⅰ酶切割λ噬菌体的5个位点时并不是随机的,靠近右端的位点比分子中间的位点快10倍。入噬菌体DNA有4个Sac Ⅱ位点,3个在中央,1个在右臂,对中央3个位点的酶切速度快50倍。据推测这很可能是由识别序列两侧的侧翼序列的核苷酸成分的差异造成的。在腺病毒2中,CTCGAG位点对PaeR7Ⅰ完全抵抗,但同裂酶XhoⅠ很易切割,原因是5'末端有1个CT二核苷酸。尽管这样的偏爱性切割在通常的实验中是无关紧要的,然而当涉及局部酶切消化时,则是必须考虑的重要参数。
5.限制性核酸内切酶缓冲液
一般的限制性核酸内切酶的标准缓冲液的组分包括MgCl2、NaCl或KCl、Tris-HCl、β-巯基乙醇(β-ME)或二硫苏糖醇(DTT)以及牛血清蛋白(BSA)。二价的阳离子,通常是Mg2+,是酶活性正常发挥所必需的。Tris-HCl的作用在于维持反应体系pH值的稳定,对于绝大多数限制性核酸内切酶来说,在pH=7.4的条件下,其功能最佳。巯基试剂对于保持某些限制性核酸内切酶的稳定性是有用的,但它同样也有利于潜在污染杂质的稳定性。有些酶反应体系中需要加入BSA,以防止酶在低浓度蛋白质溶液中变性,使用浓度为100μg/mL。
不同的限制性核酸内切酶对离子强度的要求差异很大,因此可将限制性核酸内切酶的缓冲液按离子强度(以NaCl计)的差异分为高(100 mmol/L)、中(50 mmol/L)、低(0 mmol/L)三种类型。厂商提供某种限制性核酸内切酶时,一般会同时提供一种相应的缓冲液。厂商提供的缓冲液是5倍或10倍浓度的液体,使用时只需分别加反应总体积的1/5或1/10。一般来讲,不同厂商的缓冲液成分不完全相同,最好是购买哪家公司的酶就使用其配套的缓冲液。
每种限制性核酸内切酶都有自己特异的识别位点,在正常的反应条件下,其序列识别特异性不会改变。但当条件发生改变时,许多酶的识别位点会发生改变,切割与识别序列相似的序列,这种特性称为星号活性(star activity)。如EcoR Ⅰ,在正常情况下,其靶序列为GAATTC,但若缓冲液中甘油超过5%(体积分数),可在NAATTN(N代表任一碱基)处切割,降低识别和切割序列特异性,以EcoR Ⅰ*表示这种活性。实际上星号活性是限制性核酸内切酶的一般性质,如Apo Ⅰ、Ase Ⅰ、BamH Ⅰ、BssH Ⅱ、EcoR Ⅰ、EcoR Ⅴ、Hind Ⅲ、HinfⅠ、Kpn Ⅰ、Pst Ⅰ、Taq Ⅰ、Xmn Ⅰ等酶在非标准条件下皆可表现星号活性(表2-3)。引起星号活性的因素很多,如甘油浓度高(>5%),酶过量(>100 U/μL),离子强度低(<25 mmol/L),pH值过高(>8.0),或是加了有机溶剂(二甲基亚砜、乙醇、乙二醇、二甲基乙酰胺和二甲基甲酰胺),使用其他二价阳离子(如Mn2+、Cu2+、Co2+或Zn2+)代替了Mg2+。由于星号活性会导致DNA的切割反应过程出现非特异性DNA片段,严重影响进一步的DNA连接重组,因此在使用过程中需要严格控制反应条件,避免出现星号活性。
表2-3 能产生星号活性的部分限制性核酸内切酶

(引自龙敏南等,2010)
