9.3.1 间接转化法
间接转化法也称为载体介导转化法,是指通过载体将目的DNA导入植物细胞,从而获得转基因植物的方法。目前最常用的转化载体为农杆菌Ti质粒和Ri质粒,此外,植物病毒、线粒体DNA、叶绿体DNA、人工染色体、核复制子、SI类质粒等也可用作转化载体。
1.农杆菌介导的植物基因转化技术
农杆菌是普遍存在于土壤中的一种革兰氏阴性菌,它能在自然条件下趋化性地感染大多数双子叶植物的受伤部位,并诱导产生冠瘿瘤或发状根。与植物基因转化有关的有根癌农杆菌和发根农杆菌这两种类型。
1)根癌农杆菌
(1)Ti质粒的结构。
Ti质粒是农杆菌染色体外的遗传物质,能诱导被侵染的植物细胞形成肿瘤,即诱发冠瘿瘤,大小为200~250 kb,为双链共价闭合环状DNA分子。原始的Ti质粒根据其基因功能的不同可分为5个区(图9-2)。
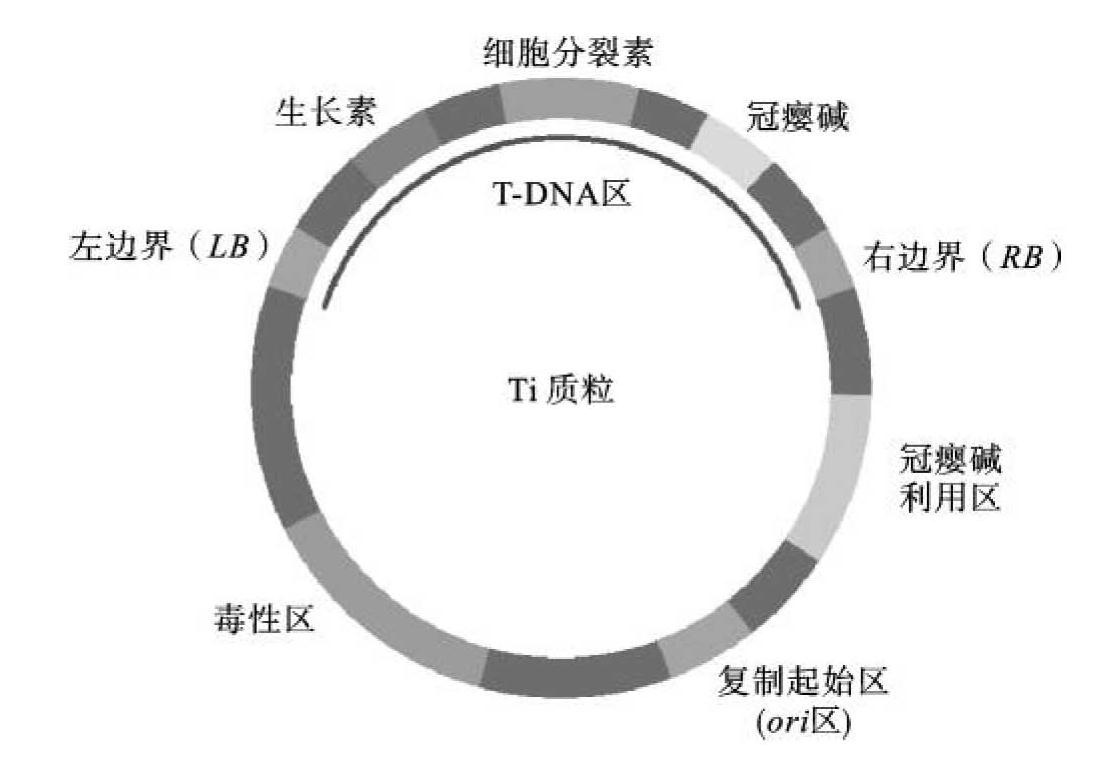
图9-2 Ti质粒的结构
(引自Wikipedia)
①T-DNA区(transfer-DNA region,T区,转移-DNA):指的是在农杆菌侵染细胞时,从Ti质粒上切割下来转移到植物基因组中的一段DNA,长度为12~24 kb,其携带的基因与肿瘤的形成有关。T-DNA上共含有tms、tmr和tmt 3套基因。其中tms和tmr 2套基因分别控制合成植物生长素与分裂素,促使植物创伤组织无限制地生长与分裂,形成冠瘿瘤。tms由iaa H和iaaM 2个基因组成,控制生长素吲哚乙酸的生物合成;tmr基因组中的iptZ负责由异戊烯焦磷酸和AMP合成细胞分裂素的反应。tmt编码产物可催化合成冠瘿碱(opine)。冠瘿碱的代谢产物为氨基酸和糖类,是根癌农杆菌生长必需的物质。依据Ti质粒诱导植物细胞产生的冠瘿碱的种类不同,根癌农杆菌可分为四种类型:章鱼碱(octopine)型、胭脂碱(nopaline)型、农杆碱(agropine)型和琥珀碱(succinamopine)型。
T-DNA区两端的边界各为25 bp的重复序列,其中14 bp是完全保守的,分10 bp(CAGGAATATA)和4 bp(GTAA)不连续的2组。左、右2个边界(LB和RB)是T-DNA转移所必需的,只要其存在,T-DNA就可以将携带的任何基因转移并整合到植物基因组中。转移的方向是从右向左,T-DNA区的右边界在T-DNA的整合中对于靶DNA位点的识别具有重要作用,因此,以右边界更为重要。
②毒性区(virulence region,vir区):临近T-DNA区的一段长30~40 kb的区段,该区段编码的基因并不整合进植物基因组中,但其编码产物对T-DNA的加工和转移,即农杆菌表现毒性是必需的。这些基因也称为Ti质粒编码毒性基因。
目前,对章鱼碱型农杆菌Ti质粒pTi15955和胭脂碱型农杆菌Ti质粒pTiC58的vir区进行了全序列分析,在章鱼碱型Ti质粒的vir区发现了8个操纵子,分别为virA~virH,共包括23个基因(virA、virBl~virB11、virC1、virC2、virD1~virD4、virE1、virE2、virF、virG、virH)。而胭脂碱型Ti质粒的vir区不含virF和virH操纵子,它含有另一个基因tzs,也有学者认为有大约35个vir基因成簇排布于vir区。
③接合转移编码区(region of encoding conjuction,con区):该区有与细菌间接合转移有关的基因(tra和trb),冠瘿碱能激活tra基因,诱导Ti质粒的转移,因此将该区称为接合转移编码区。
④复制起始区(region of origin of replication,ori区):该区调控Ti质粒的自我复制。
⑤冠瘿碱利用区(region of opine catabolism):该区含有40多个与冠瘿碱的摄取及分解代谢相关的基因,分解植物细胞产生的冠瘿碱作为唯一的碳源和氮源,满足农杆菌生长的需求。
(2)转化过程。
农杆菌介导的T-DNA的转移和整合是细菌和植物细胞相互作用发生生物学效应的过程,兼具原核生物中的细菌接合转移及真核细胞加工修饰的特点。其转化过程如下(图9-3):a.受伤的植物在伤口处分泌乙酰丁香酮、丁香醛或香荚兰乙酮等酚类分子;b.这类分子激化vir区基因的表达;c.vir区基因激活单链T-DNA;d.T-DNA转移;e.T-DNA复合物引入细胞核并整合到植物基因组中;f.合成冠瘿碱,合成生长素和细胞分裂素;g.生长素和细胞分裂素在农杆菌侵染的植株中启动致瘤;h.冠瘿碱回到农杆菌中代谢产生农杆菌生长所需的营养物质。
①vir区基因的诱导表达:根癌农杆菌具有趋化性,即植物的受伤组织会产生一些糖类和酚类物质吸引根癌农杆菌向受伤组织集中。研究证明,主要酚类诱导物为乙酰丁香酮(acetosyringone,AS)和羧基乙酰丁香酮,这些物质主要在双子叶植物细胞壁中合成,通常不存在于单子叶植物中,这也是单子叶植物不易被根癌农杆菌侵染的原因。还发现一些中性糖,如L-阿拉伯糖、D-木糖等也有诱导作用。当根癌农杆菌接收到此类信号时,其vir区基因可被诱导转录。vir区基因的活化首先是从virA基因开始的。VirA蛋白是一种结合在膜上的化学受体蛋白,可直接感应植物产生的酚类化合物,其感应部位可能位于细胞质区域。VirA蛋白的细胞质区域有自激酶的功能,C端特定的组氨酸被磷酸化激活后,磷酸组氨酸高能磷酸键的不稳定性传递给VirG的天冬氨酸残基,使VirG蛋白活化。VirG蛋白是DNA结合活化蛋白,可以二体或多体形式结合到vir启动子的特定区域,从而成为其他vir基因转录的激活因子,打开virB、virC、virD、virE、virH等几个基因。virC、virD、virE参与T-DNA复合体的形成和转移。ChvE(染色体毒性蛋白)可结合一些单糖,也可直接与VirA周质区相互作用,以加强AS对vir基因的诱导。
②T-DNA复合物的形成:T-DNA的加工与转移是由vir基因被诱导后产生的蛋白质来完成的。virD基因编码的VirDl和VirD2直接参与加工过程。VirDl蛋白是一种拓扑异构酶,可将超螺旋型DNA变成松弛型DNA。VirD2蛋白具有特异剪切单链DNA的内切酶活性,可以在T-DNA边界区25 bp重复序列的第三和第四个碱基之间产生切口,在此过程中,VirD2蛋白通过Tyr29与切断的T-DNA的5'端共价连接,避免核酸外切酶降解。这种单链形式的T-DNA称为T链。VirD2/T-DNA释放需复制酶作用,以未切断的顶链为模板,从右向左复制合成新的T-DNA。当复制到左边时,T链释放。释放的T链的3'端带有左边界4~25个核苷酸,5'端带有右边界1~3个核苷酸。T链形成后全身被VirE2蛋白包裹,形成一种半刚性、中空圆柱形的丝状螺旋结构的T-DNA复合物(或称T-复合物)。这种结构有利于保护T-DNA链,使其免受细胞中核酸酶的降解。
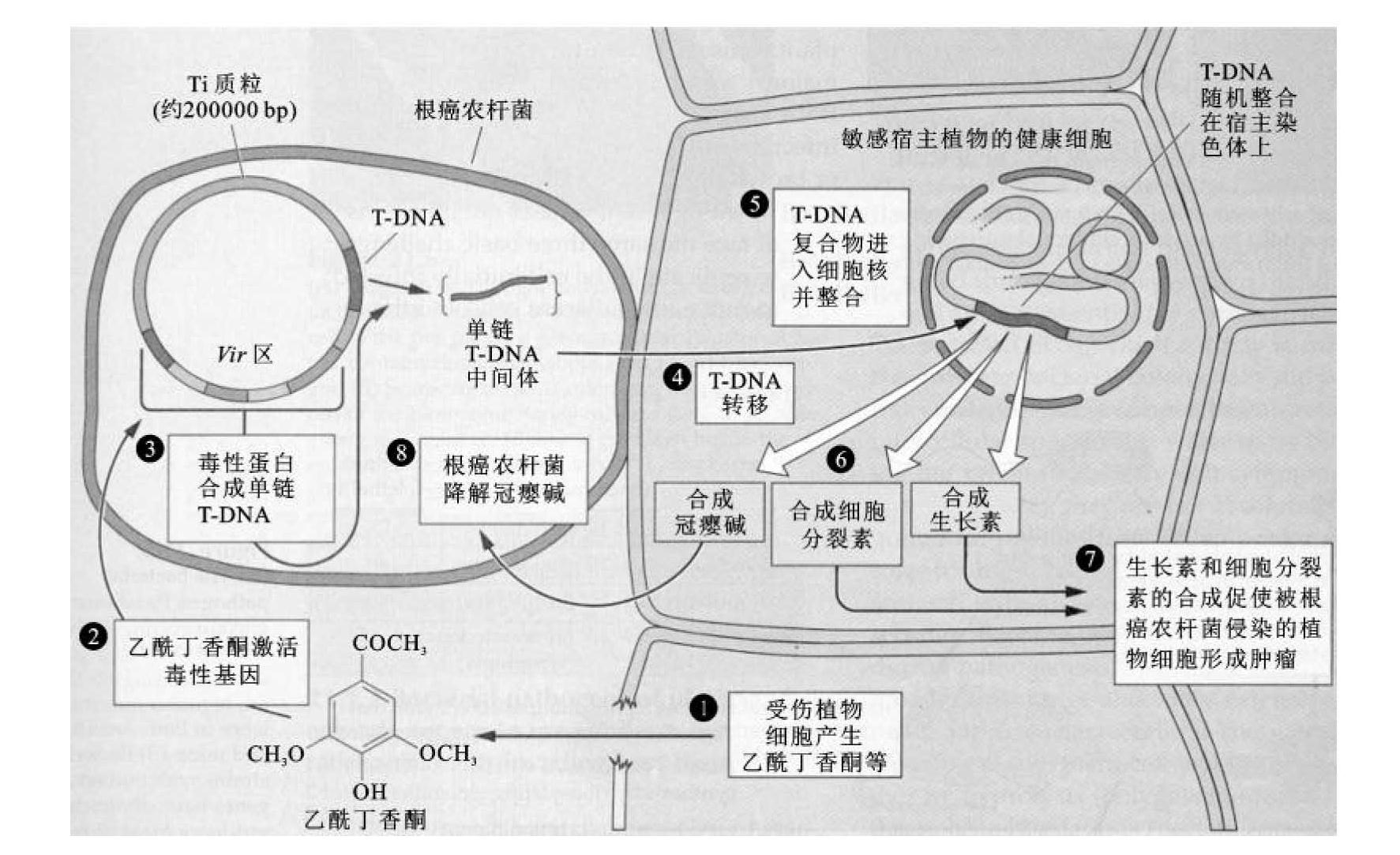
图9-3 根癌农杆菌介导的肿瘤的形成过程
③T复合物的跨膜转运核输入:农杆菌的T-DNA转移通道由多达12种蛋白质组成,包括两个主要部分:纤毛附属丝(或纤毛)和膜结合复合物。该通道也可称为T-复合物运输器,由virB编码的11种蛋白质和VirD4蛋白组成。VirB1可在细菌膜上为T-复合物运输器的装备提供位点;VirB2和VirB5可被移动到细胞表面形成纤毛;其余的VirB、VirD4为T-复合物的运输提供能量。合成的T-复合物经过T-复合物运输器,以类似于细菌转导过程的方式注射到植物细胞内(图9-4)。
T-复合物需穿过植物细胞质并定位于细胞核,才能实现基因组的整合。农杆菌的部分毒性蛋白和宿主植物的部分蛋白参与了这个过程(图9-5)。这个过程是由核定位信号(nuclear localization signal,NLS)介导的,VirD和VirE蛋白在核定位过程中起主导作用。VirD蛋白有2个核定位序列,分别位于N末端和C末端,C末端的NLS能将VirD蛋白定位于细胞核上。VirF和VirB等蛋白也参与该过程。
T-DNA和Vir蛋白核定位还需要一些植物蛋白参与,主要有VirE2互作蛋白(VirE2 interacting proteins,VIP)和核输入蛋白(nuclear importin)等。VIP1不仅协助将农杆菌来源的T-DNA定位于细胞核,还可以通过被促分裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)磷酸化后参与农杆菌诱导的植物免疫信号转导过程。核输入蛋白包括输入蛋白α和类输入蛋白β。两者首先要形成依赖能量的核孔-定位复合体(nuclear pore-targeting complex,PTAC),输入蛋白α可识别具有NLS的蛋白质,作为PTAC的接合器,并且可与类输入蛋白β结合,类输入蛋白β作为PTAC的载体,通过结合核孔蛋白将携带具有NLS的蛋白质的PTAC定位于细胞核中。
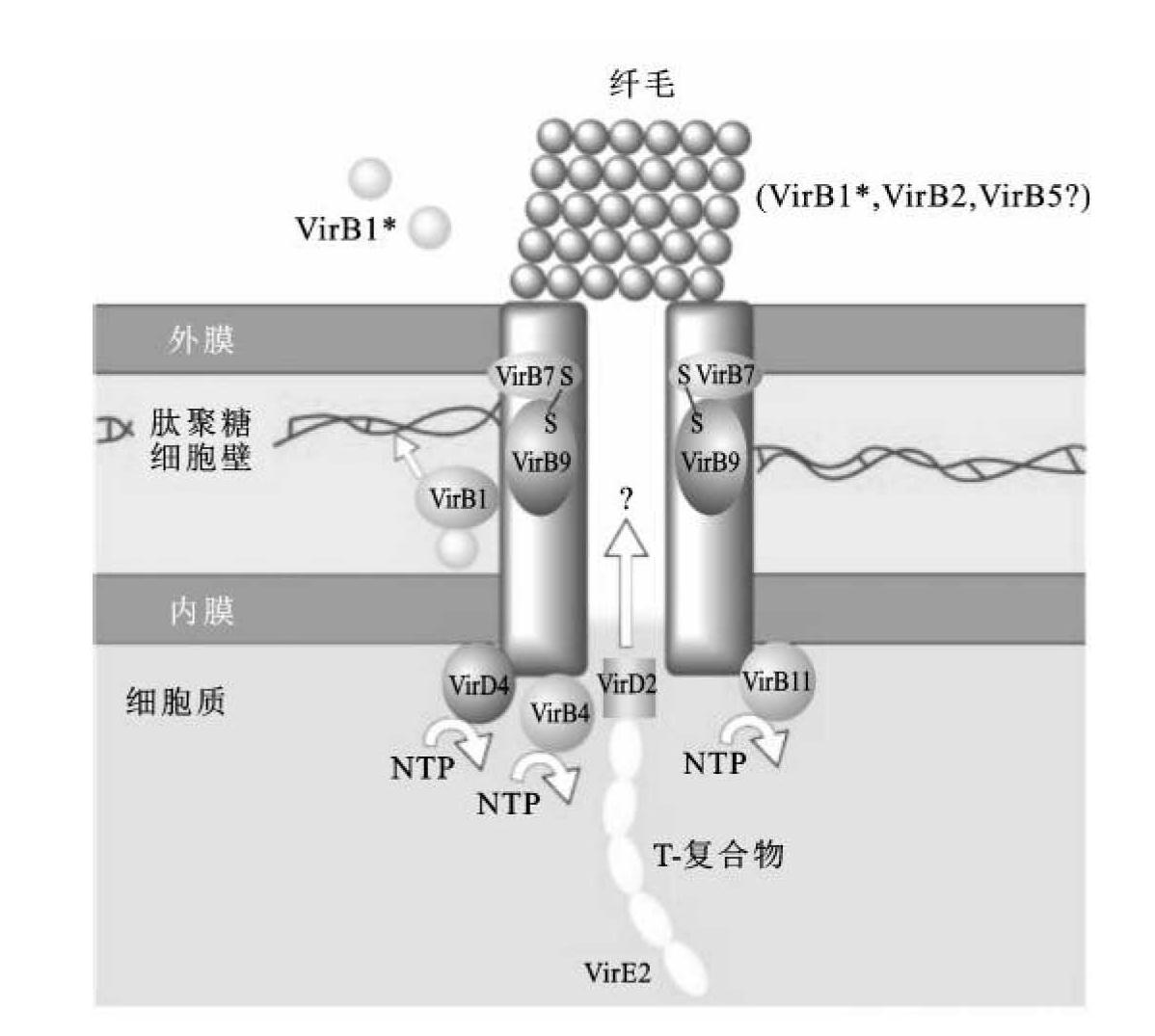
图9-4 由跨膜VirB复合物形成的T-复合物转移通道模型
(引自Christian Baron)
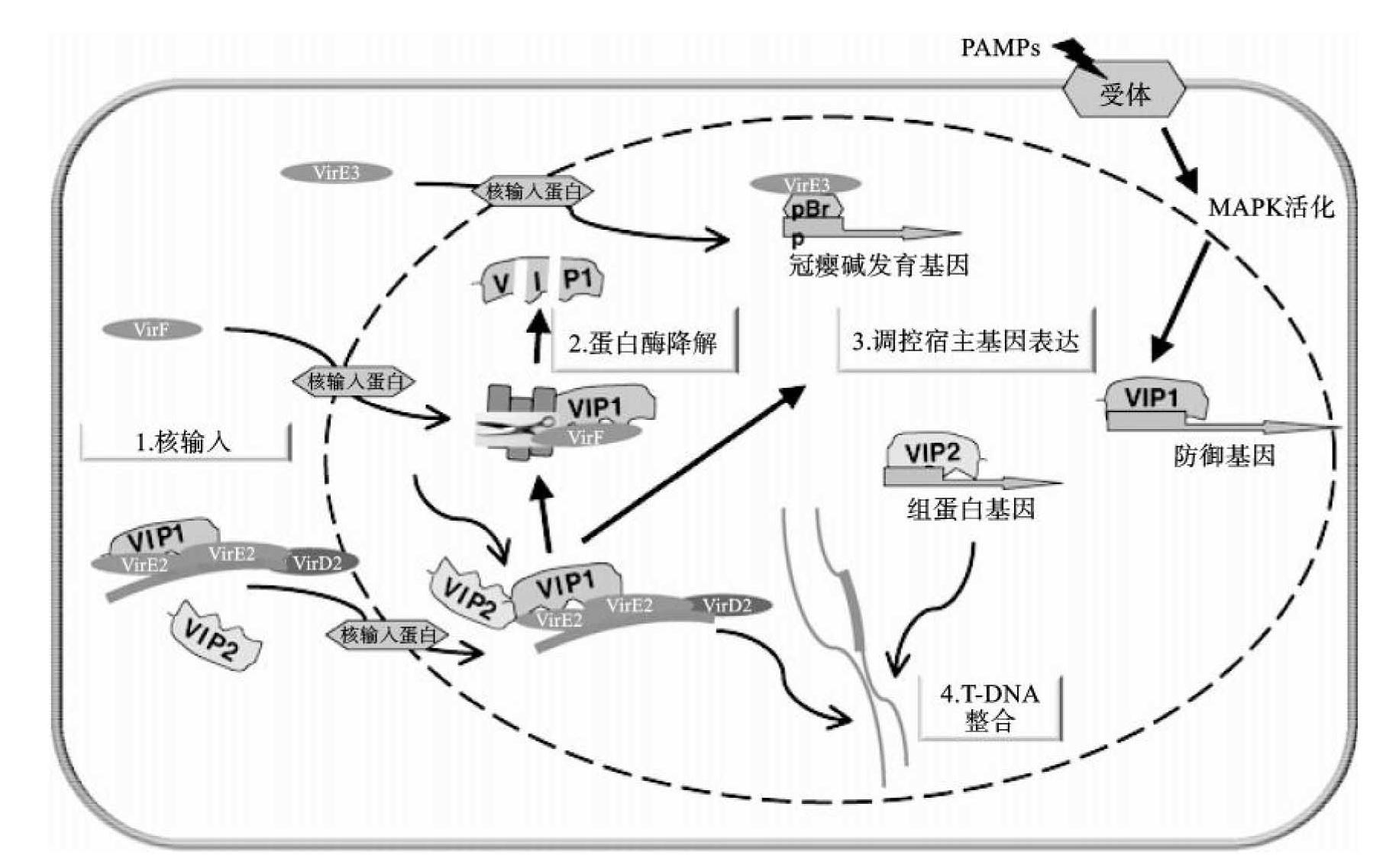
图9-5 T-DNA转移和宿主响应涉及因子的分子机制
(引自Heribert Hirt)
T-DNA复合体靶向植物基因组区域后,相关蛋白需要从复合体中卸载下来,便于T-DNA在植物基因组上的整合,VirF蛋白参与VirE蛋白和VIP1蛋白的降解和T-DNA的释放。
④T-DNA整合进入植物基因组并表达产生生物学效应:T-DNA整合进入宿主细胞基因组,是转化过程中最关键的步骤。目前关于T-DNA整合的机理并不十分清楚,已提出多种模型解释T-DNA整合到植物基因组的过程。如单链侵入模型,即T-DNA单链在VirD2蛋白的协助下,在植物基因组内寻找与T-DNA序列有小片段同源的区域,随后T-DNA单链入侵同源区,将植物基因组的部分DNA链置换,在植物DNA复制的过程中T-DNA的互补链也被合成而形成T-DNA双链。虽然该模型可以很好地阐明单链T-DNA如何入侵并整合到植物基因组中,但它无法解释T-DNA插入位点的复杂性。第二种是双链断裂修复整合模型,即T-DNA首先在植物细胞中复制形成双链,随后双链的T-DNA插入植物基因组双链断裂的区域。这种模型不涉及植物基因组上与T-DNA同源的区段,能够解释T-DNA反向插入植物基因组的情况。较新的是2016年Kregten等提出的DNA聚合酶θ介导的T-DNA整合模型(图9-6)。DNA聚合酶θ具有解旋酶和聚合酶活性,聚合过程中能进行模板的转换,这对于T-DNA的整合至关重要。DNA聚合酶θ在植物基因组DNA双链断裂处的3'末端或附近,通过微同源性捕获T链的3'末端。在每个断裂的植物DNA末端捕获两个T-DNA可能产生头对头T-DNA二聚体,而对于尾对尾或头对尾二聚体的产生,目前很难解释。这些整合方式不能解释所有的实验现象,意味着这些方式或途径不一定是互斥的,可能同时存在。
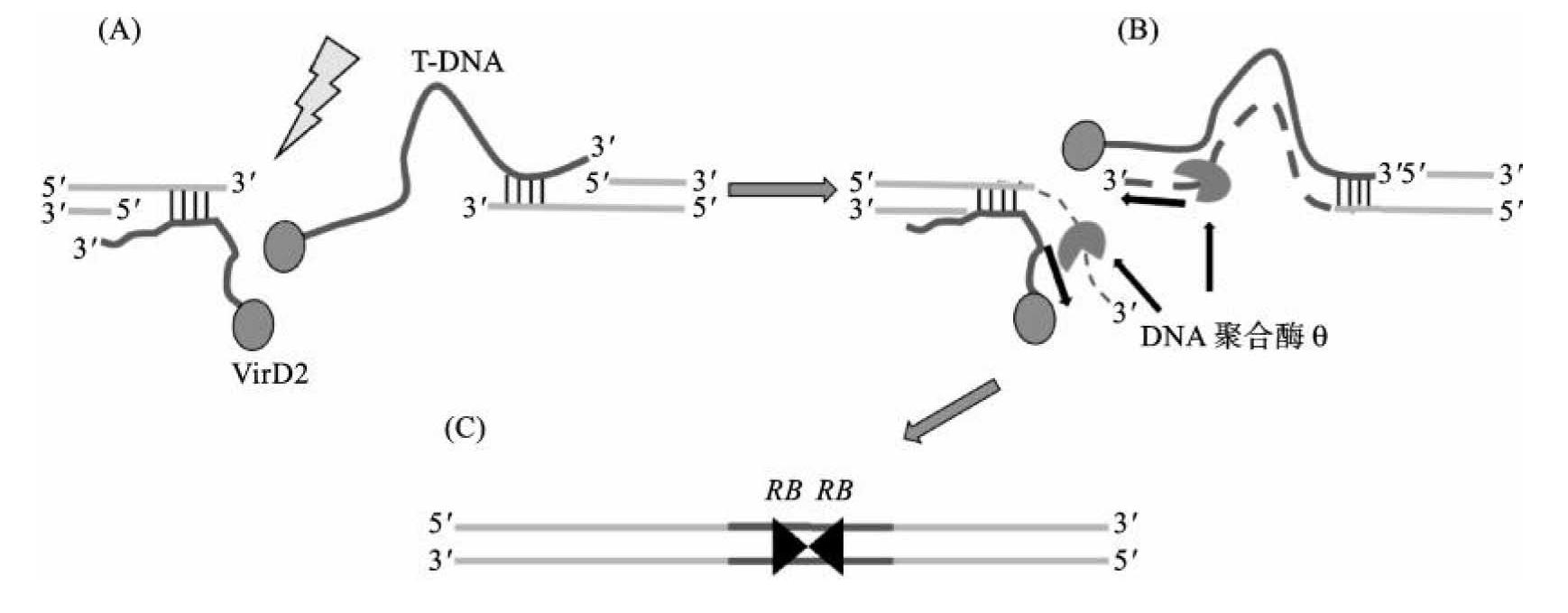
图9-6 DNA聚合酶θ介导的T-DNA整合模型
(引自Gelvin S.B.)
(3)野生型Ti质粒的改造和中间载体的构建。
由于T-DNA能够进行高频转移,而且Ti质粒上可插入大至150 kb的外源基因,因此Ti质粒是植物基因转化中理想的载体系统。但野生型Ti质粒不能直接用作载体,主要原因如下:①野生型Ti质粒分子过大,近250 kb,操作困难;②野生型Ti质粒上分布着各种限制性核酸内切酶的多个酶切位点,难以找到可利用的单一切割位点的内切酶;③T-DNA上的tms和tmr基因产物干扰受体植物内源激素的平衡,导致冠瘿瘤的产生,阻碍转化细胞的分化和植株的再生;④冠瘿碱的合成过程消耗大量的精氨酸和谷氨酸,直接影响转基因植物细胞的生长代谢;⑤野生型Ti质粒没有大肠杆菌的复制起点和作为转化载体的选择标记基因。因此,必须对野生型的Ti质粒进行改造后才能将其作为转基因植物的载体。
对野生型Ti质粒的改造,主要包括以下几个方面:①删除T-DNA上的tms、tmr和tmt基因;②加入大肠杆菌复制起点和选择标记基因,构建根癌农杆菌-大肠杆菌穿梭质粒,便于重组分子的克隆与扩增;③引入植物细胞的筛选标记基因,如细菌来源的新霉素磷酸转移酶(neomycin phosphotransferase)Ⅱ基因(npt Ⅱ),便于转基因植物细胞的筛选;④引入植物基因的启动子和poly(A)信号序列;⑤插入人工多克隆位点,以利于外源基因的克隆;⑥除去Ti质粒上的其他非必需序列,最大限度地缩短载体的长度。
(4)农杆菌Ti质粒载体构建。
从上述转化过程中可以看出,要实现农杆菌介导目的基因转化植物细胞,需要满足以下几个条件:a.毒性基因,但并不需要和T-DNA连接在一起,只需要共存在于同一个细胞中;b.T-DNA左右边界区;c.顺式调控区,如启动子、终止子等;d.选择标记基因。可以帮助筛选鉴定转化的植物细胞,细菌选择标记基因还可以帮助鉴定带有标记基因的载体是否转化到农杆菌中。依据上述的基本元件构建了以下两种载体类型。
①共整合载体(co-integrated vector)系统:大肠杆菌具有能与农杆菌高度接合转移的能力,因此可以将含有T-DNA边界区的片段克隆到大肠杆菌载体中,在大肠杆菌中进行外源基因的克隆。带有重组T-DNA片段的大肠杆菌质粒的衍生载体称为中间载体(intermediate vector)。存在于农杆菌中的含有毒性基因但缺少T-DNA和致瘤基因的Ti质粒载体,称为卸甲Ti质粒(disarmed Ti plasmid)。缺失的T-DNA部分可以被与中间载体同源的序列(如pBR322)取代。这样要转移的目的基因通过中间载体在大肠杆菌中克隆,筛选的含有目的基因的重组载体可以通过一定的方法(如电击法、冻融法或三亲交配法)转化到含有卸甲Ti质粒的农杆菌中。在农杆菌内,通过同源重组形成可穿梭的共整合载体,在vir基因产物的作用下完成目的基因向植物细胞的转移和整合(图9-7)。
②双元载体(binary vector)系统:研究发现,Ti质粒上的vir区对T-DNA的转移是通过反式作用因子来实现的,虽然vir区对T-DNA的转移必不可少,但这一区域并不一定与T-DNA连在一起,可以分别位于不同的复制子(质粒)上,甚至可以放在细菌的染色体中,而不影响T-DNA的转移。根据这一原理,双元载体系统由两个分别含有T-DNA和vir区的相容性突变Ti质粒构成,即微型Ti质粒(mini-Ti plasmid)和辅助Ti质粒(helper Ti plasmid)。微型Ti质粒是含有T-DNA边界、缺失vir基因的Ti质粒,同时还具有广谱质粒复制位点、选择标记基因和多克隆位点,方便分子克隆操作。这种载体既含有大肠杆菌的复制位点,也有农杆菌的复制位点,也称大肠杆菌-农杆菌穿梭质粒,但载体上不带vir基因。转化根癌农杆菌之前,所有的克隆操作步骤都可以在大肠杆菌中进行。完成克隆后,通过一定的方法将其转入含有辅助Ti质粒的农杆菌中(此时农杆菌中含有2个质粒),该Ti质粒包括一整套vir基因,但T-DNA序列则由于缺失而无法转移,由辅助Ti质粒提供,合成vir基因产物——毒性蛋白,使双元克隆载体中的T-DNA能够整合到植物染色体中(图9-8)。在双元载体的基础上,通过在微型Ti载体上再引入一个含virB、virC和virG的区段,连同原有辅助Ti质粒,这个系统中共有2个vir区段,具有更强的激活T-DNA转移的能力,这种改进的双元载体称为超级双元载体(super binary vector)。这种载体系统现多用于单子叶植物的转化。
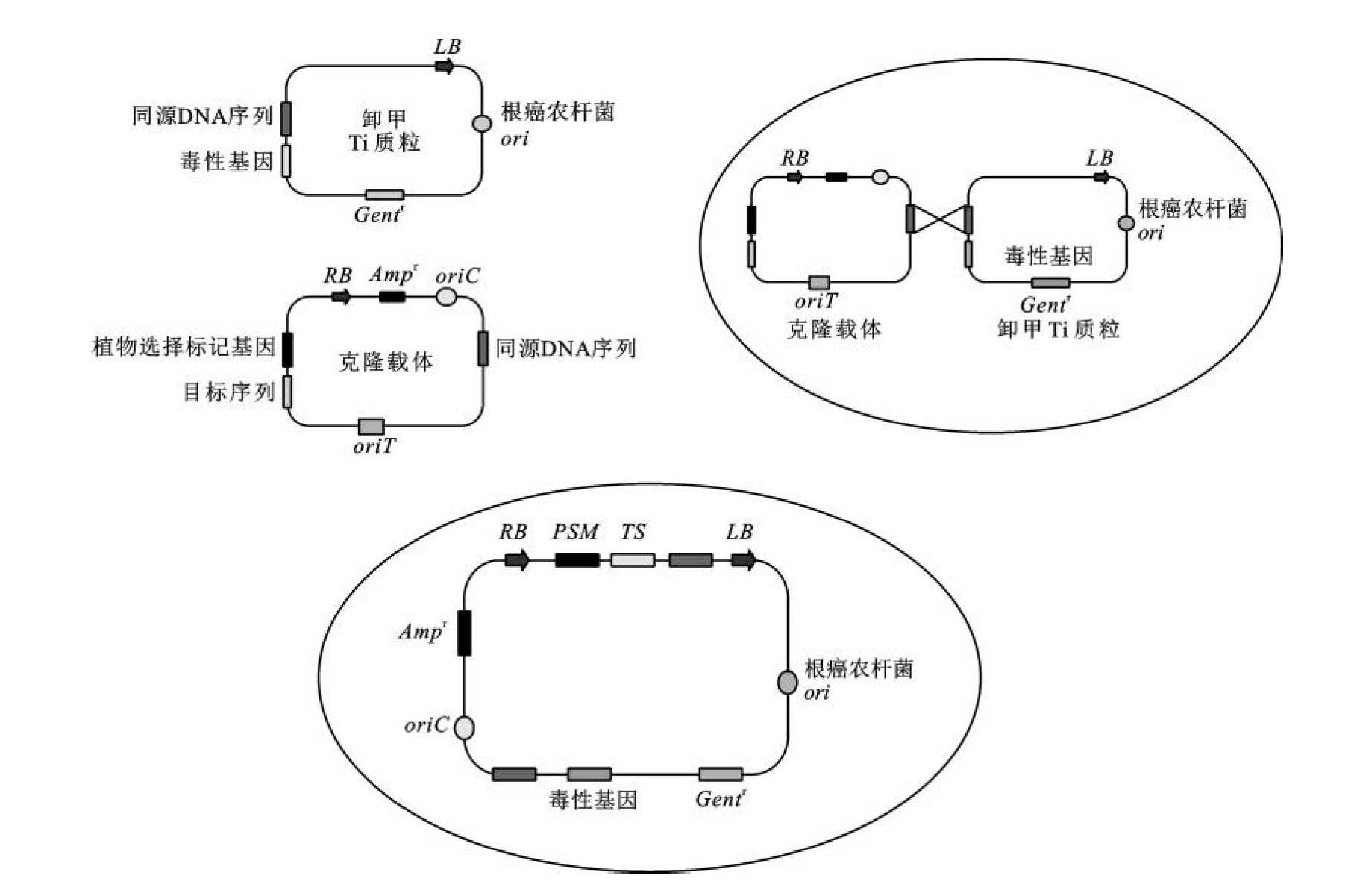
图9-7 共整合载体系统
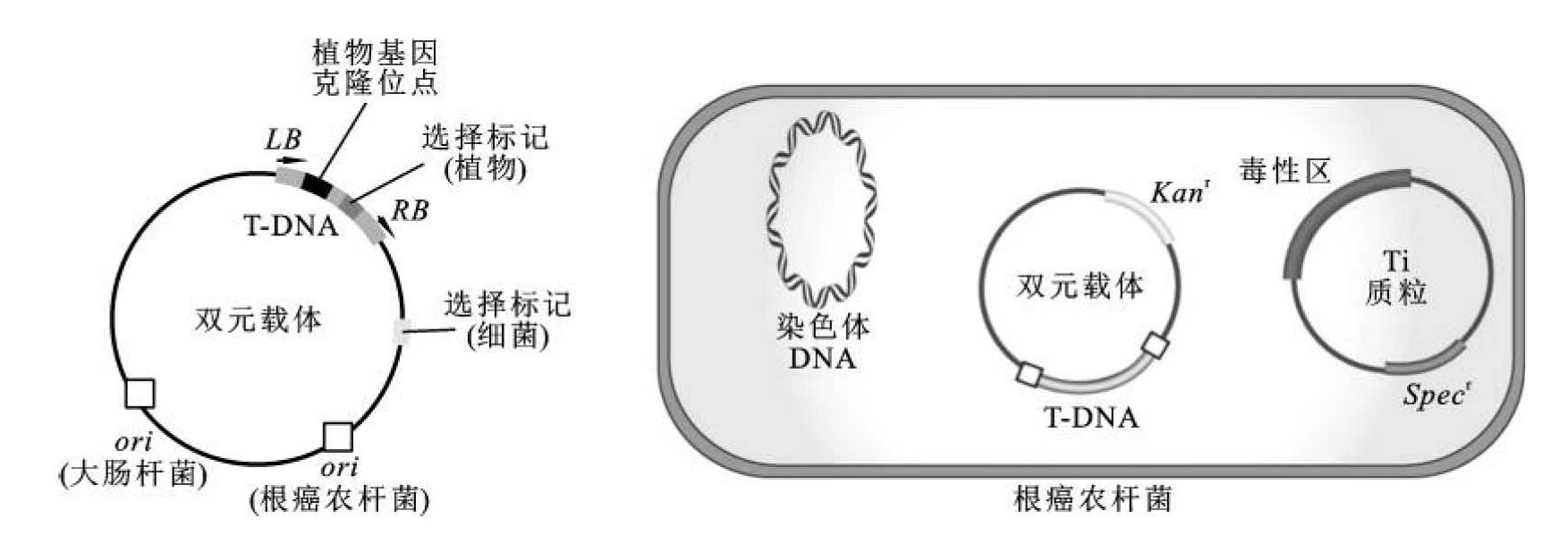
图9-8 双元载体系统
与共整合载体不同的是,双元载体不依赖两个质粒之间的同源序列,不需要经过共整合过程就能在农杆菌内独立复制,因此构建的操作过程比较简单;由于微型Ti质粒较小,并无共整合过程,因此质粒转移到农杆菌比较容易,且构建的频率较高;另外,双元载体在外源基因的植物转化中效率高于共整合载体。
(5)农杆菌介导常用的转化方法。
目前已建立多种转化方法,其基本程序为:含重组Ti质粒的根癌农杆菌培养,选择合适外植体,根癌农杆菌与外植体共培养,外植体脱菌及筛选培养,转化植株再生及鉴定等。
①叶盘法(leaf disc transformation):叶盘法为Monsanto公司Morsch等于1985年建立起来的一种转化方法。其操作步骤为:首先用打孔器从消毒叶片上取下直径为2~5 mm的圆形叶片,即叶盘。再将叶盘放入培养至对数生长期的根癌农杆菌菌液中浸泡几秒钟,使根癌农杆菌侵染叶盘。然后用滤纸吸干叶盘上多余的菌液,将这种经侵染处理过的叶盘置于培养基上共培养2~3 d,再转移到含有头孢霉素或羧苄青霉素等抑菌剂的培养基中,除去根癌农杆菌。与此同时,在该培养基中加入抗生素进行转化体的筛选,使转化细胞再生为植株。对这些再生植物进行分子检测,就可确定它们是否整合有目的基因及其表达情况(图9-9)。叶盘法已在多种双子叶植物上得到成功的应用。实际上,其他多种外植体,如茎段、叶柄、胚轴、子叶、愈伤组织、萌发的种子均可采用类似的方法进行转化。该方法的优点是适用性广且操作简单,是目前应用最多的方法之一。

图9-9 叶盘法培育转基因植物技术流程
(引自Steven Strauss)
②真空渗入法:将健壮植株倒置浸于装有携带外源目的基因的工程农杆菌转化液的容器中,经真空处理、造伤,使农杆菌通过伤口感染植株,在农杆菌的介导下,发生基因转移。它是一种简便、快速、可靠而且不需要经过组织培养阶段即可获得大量转化植株的基因转移方法,具有良好的研究与应用前景。
影响真空渗入法转化率的因素主要包括植物发育时期(多数采用初花期的植株)、农杆菌生长时期(一般以静止期的农杆菌为宜)、转化介质构成、转化后的植株培养等。
③原生质体共培养转化法:在原生质体培养的早期,将携带外源目的基因的农杆菌与原生质体进行短暂的共培养,洗涤除去残留的根癌农杆菌后,置于含抗生素的选择培养基上筛选出转化细胞,进而再生成植株。与叶盘法相比,此法所获转化体不含嵌合体,一次可以处理多个细胞,得到相对较多的转化体。应用此法进行基因转化时,其先决条件就是要建立起良好的原生质体培养和再生技术体系。
④创伤植株感染法:这是用根癌农杆菌直接感染植物而进行遗传转化的一种简单易行的方法。其做法(图9-10)如下:人为在植株上造成创伤,然后把含有重组质粒的工程根癌农杆菌接种在创伤面上,或把含有重组质粒的根癌农杆菌注射到植物体内。使根癌农杆菌在植物体内进行感染来实现转化。为了获得较高的转化率,一般采用无菌种子的实生苗或试管苗。用去除了致瘤基因的根癌农杆菌进行整株感染后,受伤部位一般不会出现肿瘤。在筛选转化体时,可将感染部位的薄壁组织切下放入选择培养基上及诱发愈伤组织的培养基上,分别进行筛选和愈伤组织诱导。最后将转化的愈伤组织转移至含合适植物激素的培养基上诱导再生植株。
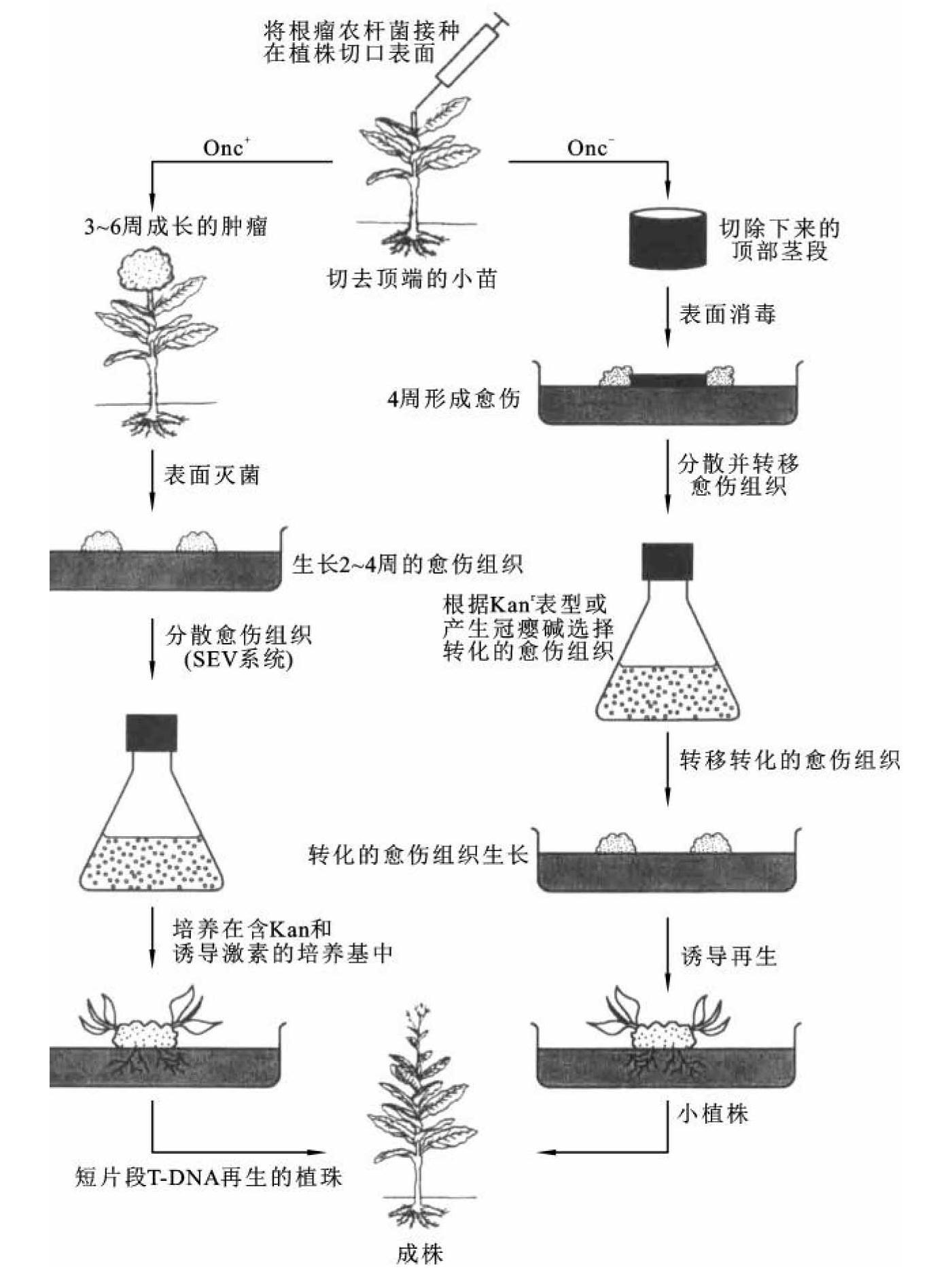
图9-10 根癌农杆菌感染创伤植株实现基因转移
(引自吴乃虎,2001)
(6)影响农杆菌介导转化效率的因素。
农杆菌介导的遗传转化是农杆菌、植物受体及环境条件共同作用的结果。影响农杆菌介导的转化效率的因素较多,总体上可分为农杆菌菌株及载体、外植体的类型和生理状态,以及组织培养体系和条件这三个大的方面。
①农杆菌菌株及载体。(https://www.daowen.com)
不同类型的农杆菌菌株的侵染力不同。一般而言,四类农杆菌菌株的侵染能力顺序为:农杆碱型菌株(如A281)>琥珀碱型菌株(如EHA101、EHA105)>胭脂碱型菌株(如C58)>章鱼碱型菌株(如Ach5、LBA4404)。但不同植物物种差异比较大。对于难以转化的品种,菌株的选择尤为重要。但对于某一特定植物品种,超毒力菌株并不总是具有高的转化效率,这还与载体的选择有关。比如在Hiei等的水稻转化实验中,普通菌株LBA4404与超级双元载体pTOK233构成组合的转化效率明显高于其他组合,而超毒力菌株EHA101与pTOK233组合比普通菌株与双元质粒组合的转化率还低。针对不同的转化受体构建高效的转化载体并选择合适的菌株与载体组合,可适当提高转化效率。
②外植体的类型和生理状态。
农杆菌对植物细胞的成功转化需要两个条件:一是植物细胞受损伤后分泌足够浓度的vir基因诱导物;二是细胞正在进行活跃的DNA合成或分裂。目前作为转基因受体的外植体材料包括叶片、叶柄、幼茎、子叶、胚轴、幼穗、成熟胚、幼胚、胚性愈伤组织、小孢子、原生质体等,涉及植物的各组织和器官。不同外植体材料的转化率有明显差异,应根据具体植物种类选择最佳的外植体类型。一般来说,发育早期的组织(如分生组织、维管束形成层组织、薄壁组织及胚、雌和雄配子体等)的细胞具有较强的分裂能力。当这些组织创伤或受环境诱导时,加速分裂,即处于转化的敏感期。已经分化的组织细胞的转化能力与其发育程度有重要关系。比如在高粱的转化中,来自大田的幼胚具有较高的转化效率。对易于转化的水稻品种来说,来自盾片的胚性愈伤组织是最常用的外植体。
③组织培养体系和条件。
组织培养体系和条件如感染方式、vir区基因活化诱导物的添加及共培养基成分、农杆菌菌液的浓度、共培养条件等都能对转化效率产生很大影响。针对特定的植物和组织,成功的转化往往需要对诸多因素进行优化。
a.vir区基因活化的诱导物。
酚类是vir区基因表达的主要信号物质,是诱导细菌附着到受体的重要因子之一。在众多的酚类物质中,乙酰丁香酮(AS)和羟基乙酰丁香酮诱导能力较强,AS的促进效果与菌株类型、植物材料种类和共培养基的pH值有关。没食子酸、间二羟基苯甲酸、香草酚、儿茶酚、对羟基苯酚等多酚混合处理农杆菌也有很强的作用,但不同酚类物质是否有累加效应在不同研究结果中不尽相同。不同农杆菌类型对酚类物质的敏感性不同,章鱼碱株系比胭脂碱株系需要更高的酚类物质诱导。AS的使用浓度多为5~200μmol/L,浓度过高会降低转化率且损伤转化受体;一般在农杆菌液体培养基和共培养基中加入。
糖类等小分子一方面可作为化学源吸引农杆菌的趋化运动,另一方面可诱导或抑制农杆菌vir基因的表达。而糖类的主要作用是与农杆菌染色体毒性蛋白ChvE结合,激活VirA蛋白进而诱导vir基因高水平表达和扩大农杆菌的宿主范围。特别在AS浓度很低的情况下,它可强烈诱导vir基因的表达,并且与AS存在协同效应,可显著提高AS诱导效果。糖类在不含酚类化合物的情况下效果较明显,但是糖类和酚类化合物同时存在时没有明显的协同效应。
多胺也参与植物宿主和病原之间的相互作用。Kumar等曾用多胺物质对农杆菌进行活化后感染烟草,GUS瞬时表达研究表明农杆菌的感染活力显著提高。
b.外植体的接种。
外植体预培养有利于提高遗传转化的效果。接种前将外植体在含有外源激素的培养基上预培养一段时间(一般以2~3 d为宜),使植物组织代谢活跃,促进细胞分裂,分裂状态的细胞更易整合外源DNA,从而提高外源基因的瞬时表达和转化效率。另外,预培养有利于外植体与培养基平整接触。这是因为外植体在开始培养过程中,由于其迅速生长而出现上翘和卷曲,使农杆菌的接种切面离开培养基,致使农杆菌生长受抑制而影响对受体的转化,预培养则有利于改进这种状况。
外植体接种农杆菌的方式也会影响转化的效果。比较常用的接种方式是将外植体置于浸染液中浸泡。有研究者在浸泡的基础上结合振荡进行接种,振荡培养能打破细胞表面的气泡,使农杆菌与外植体的接触面增大,利于侵染。另外,利用超声波辅助农杆菌介导法、负压与农杆菌介导结合法以及基因枪与农杆菌介导结合法等,均可增强农杆菌侵染,提高转化效率。
外植体的接种时间和接种农杆菌菌液的浓度根据物种和外植体类型不同而异。接种时间过长及接种菌液浓度过高,容易引起农杆菌细胞间的竞争性抑制,抑制受体细胞的呼吸作用,并容易引起后续培养中的污染。而接种时间太短和接种菌液浓度过低则造成受体细胞表面农杆菌附着不足,转化效率变低。一般处在对数生长期,即OD6000.3~1.8范围(1.0 OD600相当于每毫升1×109个细胞)具有较高侵染活力,接种时间一般为1~30 min。
侵染培养基的pH值一般采用5.1~5.7。研究人员普遍认为酸性培养环境有利于农杆菌的侵染。这是因为植物细胞释放对农杆菌有趋化作用的化学物质(如酚类、糖类),虽然在不同pH值下比较稳定,但在pH值为5.0~5.8时对vir基因的诱导能力最高。
c.共培养。
共培养需要足够的时间以确保T-DNA的转移和整合,但共培养时间也不宜太长,否则会导致农杆菌的过度生长,使植物细胞受到毒害而死亡或共培养后不容易去除。一般共培养时间为3d。多数在共培养基中加入AS和单糖类物质作为诱导物,并加入较高浓度的生长素(如2,4-D),而避免使用细胞分裂素(如BA和TDZ),因为生长素能促进T-DNA的转移,细胞分裂素则抑制T-DNA的转移。共培养基同时还应该能支持外植体细胞进行活跃的分裂,并使之保持胚性状态。共培养温度对转化效率的影响也很大。农杆菌的最佳生长温度是28~30℃,植物组织培养也多在25~30℃进行,而vir基因的活性诱导对温度的要求是15~25℃。通过T-DNA转运机制进行的质粒转移在19℃时最为活跃,因此,T-DNA转移在25℃以下可能更为有效。较低的共培养温度有两个优点:一是不易发生质粒丢失;二是比较容易控制细菌的过度生长。但缺点是植物细胞的生长也受到抑制,所以应综合考虑T-DNA转移效率与植物细胞和农杆菌的生活力这两个方面的因素。
④其他影响因素
表面活性剂也影响农杆菌介导的遗传转化的效果。此类物质能增强细胞通透性,有效清除受体表面的杂质,促进农杆菌在植物细胞表面的黏附,增加植物受体表面单位面积上农杆菌细胞的数量,提高转化效率。在农杆菌转化中常用的表面活性剂有Tween 20、Silwet 77、Triton X、MES、Pluronic F 68等。
转化过程中常用的抗生素也会影响转化效率。抗生素浓度过高或过低都不利于农杆菌的转化。农杆菌侵染对受体植物来说是一个抗逆的过程,会导致植物受体组织发生胁迫响应,产生一些次生代谢物质(如过氧化物、乙烯和自由基等)阻碍或抑制转化。添加次生代谢物质清除剂有利于转化。如添加一些抗氧化剂消除或抑制羟自由基、超氧自由基、过氧化氢等活性氧(ROS),有利于组织细胞的发育生长。常用的抗氧化剂包括抗坏血酸、过氧化物酶、超氧化物歧化酶、过氧化氢酶等。
农杆菌介导法和其他方法相比,T-DNA链在转移过程中受到蛋白质的保护及定向作用,可免受核酸酶的降解,从而完整、准确地进入细胞核,转化效率较高,使用费用低;导入基因拷贝数低,表达效果好,农杆菌介导的转化导入的外源基因拷贝数大多只有1~3,而其他方法往往有几十,大量拷贝会导致转基因的沉默;导入植物细胞的基因片段明确,且能导入大片段的DNA,Ti质粒上位于2个边界序列之间的外源基因片段均会转移到植物细胞中,可避免其他理化方法将非目的基因片段导入植物细胞而造成潜在遗传物质扩散的危险。
2)发根农杆菌
发根农杆菌(Agrobacterium rhizogenes)与根癌农杆菌属同一种病原土壤杆菌,不同的是其含有Ri质粒,能够诱发植物产生许多不定根,这些不定根生长迅速,不断产生分支,呈毛状,故称之为毛状根或发状根(hairy root)。Ri质粒属于巨大质粒,其大小为200~800 kb,与Ti质粒比较,不仅结构、特点相似,而且具有相同的宿主范围和相似的转化机理。与Ri质粒转化相关的也主要为vir区和T-DNA区两部分,所不同的是vir区和T-DNA区所含基因及其同源性不同(图9-11),并且T-DNA上的基因不影响植株再生,因此,野生型Ri质粒可以直接作为转化载体。根据诱导的冠瘿碱的不同,Ri质粒可分为三种类型:农杆碱型、甘露碱(mannopine)型和黄瓜碱(cucumopine)型。
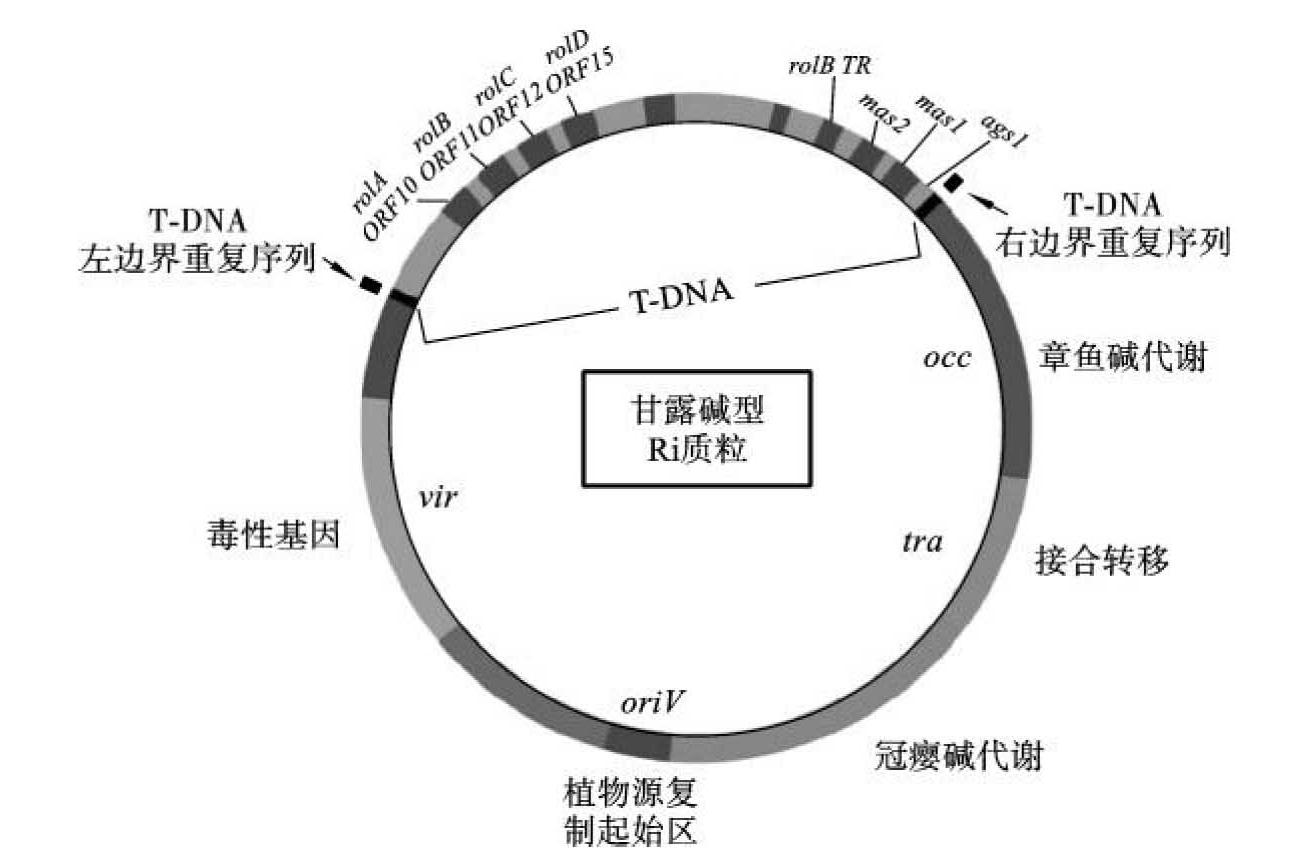
图9-11 发根农杆菌甘露碱型Ri质粒结构
(引自Ibrahim)
(1)转化机制:发根农杆菌感染植物诱导毛状根的过程可分为以下几个步骤:损伤的植物组织通常会产生一些小分子的乙酰丁香酮等酚类物质,其作为诱导信号被发根农杆菌识别,发根农杆菌识别了信号分子后,向受伤细胞做趋化性运动,与宿主细胞发生黏接;发根农杆菌Ri质粒上的vir区的virA基因被AS等物质活化并诱导其他基因的活化,同时virA基因会与细菌基因组中的chv基因共同作用,将Ri质粒上的T-DNA片段切割下来并转入植物细胞,T-DNA进入宿主细胞的细胞核并整合到核基因组中;T-DNA基因在寄主细胞基因组中表达。由于T-DNA含有植物生长素合成基因(tmsl、tms2),因此能使宿主细胞无限繁殖,从植物感染点诱导出毛状根。
(2)发根农杆菌的植物转化方法:诱导毛状根生成的过程包括外植体培养和农杆菌感染两个阶段。农杆菌感染植株常采用以下方法:①直接注射法:用活化好的新鲜菌液对发芽后数天的无菌幼苗茎部进行2~3次注射接种,一般2周左右注射处会产生毛状根。②接种感染:对胚轴、子叶、子叶节、幼叶、未成熟的胚等外植体进行常规灭菌,用刀片切成小块或小段,用活化好的菌液进行注射涂抹或与菌液共培养,然后将外植体转移到无外源抗生素的培养基上,诱导毛状根。3~4 d后,将外植体转移至含有相应抗生素的除菌培养基上进行除菌培养,1~4周后,诱导生成的毛状根迅速伸长,并长出很多侧根。③与原生质体共培养。将叶肉细胞获得的原生质体培养3~4 d后,加入100倍量的活化好的菌液进行共培养,这种方法常常是为了获得愈伤组织而采用。
Ri质粒作为载体,与Ti质粒相比有许多优点:①野生型Ri质粒T-DNA区的基因不会影响植株再生,不需卸甲即能直接作为转化载体,操作起来更方便;②转化产生的根能够再生植株,每条发根都是一个单细胞克隆,可以避免嵌合体,且再生植株的染色体很少发生畸变;③Ri质粒诱导的发状根适于离体培养,而且具有原植株的次生代谢物合成能力,可用于次生代谢物生产;④毛根的无性系可以通过产生激素进行选择。
2.植物病毒作为载体介导的转化
病毒感染细胞后将其DNA导入宿主细胞,病毒DNA能在宿主细胞中进行复制和表达,其本身就是一种潜在的基因转化系统,因此,病毒可以作为植物转基因的一种载体。植物病毒载体的研究开展得较晚,1984年才诞生了第一例由花椰菜花叶病毒构建的载体。但是植物病毒载体具有很多优点,例如:短时间内可以生产大量成本低廉的外源蛋白,满足医药及工业用蛋白日益增加的需求;不受宿主范围的限制;克隆外源目的基因的病毒载体可能扩散到感染植株的所有细胞中,通过此途径培育转基因的植物,就可避免从转化细胞再生植株的烦琐过程。随着植物病毒分子生物学及遗传学研究的不断深入,用病毒基因组作为载体转化植物细胞日益受到人们的重视。
在已知的300多种植物病毒中,单链RNA病毒约占91%,双链DNA病毒、单链DNA病毒各占3%左右。RNA不太适合用作载体,因为RNA的操作非常困难。目前较为成熟的植物病毒载体是花椰菜花叶病毒(cauliflower mosaic virus,CaMV)和番茄金色花叶病毒(tomato golden mosaic virus,TGMV)。
1)CaMV DNA载体转化法
CaMV为直径50 nm的球形颗粒,含有双链环状DNA分子。将外源目的基因插入CaMV DNA,重组分子在体外包装成有感染力的病毒颗粒,就可高效转染植物原生质体,进而通过原生质体培养再生为整株植物。但CaMV作为基因转化的载体也存在以下缺点,从而限制了其应用:①CaMV容纳外源DNA的能力非常有限,即使是切除了非必需序列,也只能插入很小的片段,可以稳定表达的外源基因的大小为1 kb左右;②CaMV的宿主范围非常窄,主要是芸薹属(Brassica)植物如甘蓝和花椰菜等;③CaMV是一种病原体,它的感染会使宿主植物患病,降低产量和品质;④目前还没有发现一种植物病毒DNA是可以整合到宿主染色体上的,也就不可能通过有性生殖过程将插入的外源基因稳定地传递给感染植株的后代;⑤尽管CaMV DNA可以感染植物,但带有外源基因的CaMV DNA重组体一般不能感染植物,这就必须通过原生质体予以克服,但通过原生质体再生植株对有些植物是非常困难的,并且植物病毒在植物组织中的传播也是受到限制的;⑥目前判断CaMV DNA是否感染,唯一的办法就是靠“症状”的表现,因此,对CaMV DNA载体来说,还需要一个更好的选择标记。
多年来有关CaMV克隆载体的设计思想,主要集中在以下三个方面。
(1)由缺陷型的CaMV病毒分子同辅助病毒分子组成互补的载体系统。其中缺陷型CaMV DNA分子仅具有少数几种病毒的功能,外源基因可以在其上克隆。而辅助CaMV DNA分子则携带除缺陷型CaMV DNA分子编码的一两种病毒功能以外的全部CaMV病毒的功能。在共感染植物细胞时,外源基因能在CaMV 35S启动子驱动下表达,由于辅助病毒的协助,可组成重组病毒颗粒。该系统两种分子不能够单独感染敏感的植物细胞,只有彼此依赖对方基因组提供的产物,才能发生有效的感染作用。
(2)将CaMV DNA整合在Ti质粒DNA分子上,组成混合的载体系统。将CaMV DNA插入Ti质粒的T-DNA中,通过根癌农杆菌导入植物细胞,可以表现出典型的病毒感染症状。这种途径有以下优点:①扩大了CaMV的正常宿主范围,使人们有可能在其他植物中研究该病毒的行为;②克隆在Ti质粒上的CaMV DNA可以整合到植物基因组上,避免了不同的CaMV突变体之间重组,进而形成野生型CaMV的麻烦。
(3)构成带有CaMV 355启动子的融合基因,在植物细胞中表达外源DNA。CaMV 35S启动子能够在被感染的植物组织中产生高水平的35S mRNA,是一种理想的启动子。将CaMV 35S启动子同目的基因重组转化到植物受体细胞中,由GMV35S启动子直接指导目的基因进行有效的表达,这种方法既避免了重新出现野生型病毒的麻烦,又不需要严格的组织特异性,并且能够高水平地表达。
2)TGMV DNA载体转化法
植物双生病毒(geminiviruses)为单链DNA病毒,成熟时呈双颗粒状,每个颗粒中含有一条DNA单链,互不相同。其中A链能单独在植物细胞中复制,并含有一部分病毒包衣蛋白基因;B链含有另一部分包衣蛋白基因及感染性基因。A、B两条链必须同处于一个植物细胞中,才能形成有感染力的病毒。双生病毒具有广泛的宿主细胞范围,对单子叶植物及双子叶植物都有感染力,因此是一种有很大潜力的植物病毒载体。
双生病毒的基因组比较小,其分子大小为2.5~3.0 kb,而且主要是由环状DNA分子组成,是一种二联的基因组(bipartite genome)。番茄金色花叶病毒(TGMV)是一种双生病毒,是最有可能被发展为植物基因转移载体的病毒。这种病毒在同一个蛋白质外壳内存在着两条各长2.5 kb的单链DNA。单链DNA A,又称TGMV A组分,编码病毒外壳蛋白质及参与复制的蛋白质;单链DNA B,又称TGMV B组分,则编码着控制病毒从一个细胞转移到另一个细胞的运动蛋白质。
DNA分子仅能在植物细胞中复制,但只有存在DNA B的情况下才具有感染性。这就是说,要形成TGMV的感染性,就必须在细胞中同时存在DNA A和DNA B两种基因。双链复制型的TGMV DNA处于没有外壳蛋白质的环境中,仍然具有感染性。因此,外壳蛋白质编码基因的大部分序列可以从DNA A中删除掉,以便为外源基因的插入留出必要的空间。
利用TGMV将外源基因克隆到植物体内的程序如下:从成熟的病毒颗粒中分离其单链DNA A,并在体外复制成双链形式;以外源基因和标记基因(例如npt Ⅱ)取代A链DNA上的病毒包装蛋白基因;将重组分子克隆在含有T-DNA和根癌农杆菌复制子的载体质粒上,并转化含有辅助Ti质粒的根癌农杆菌;将农杆菌注射到已含有TGMV B链植物的茎组织中,此时重组DNA分子在植物体内被包装成具有活力的病毒颗粒,后者分泌后再感染其他细胞和组织,使外源基因迅速遍布整株植物(图9-12)。在上述工作的基础上,随后又发展出同时含有单链DNA A和单链DNAB两种组分的另外一种双元载体系统。使用这类载体就不需事先用单链DNA B转化植物,简单、便捷。此外,病毒可引起破坏性的感染,需要严格防护,防止载体从宿主中逃逸,感染自然中的植物。所以CaMV和TGMV作为克隆载体还需要进一步的改造。
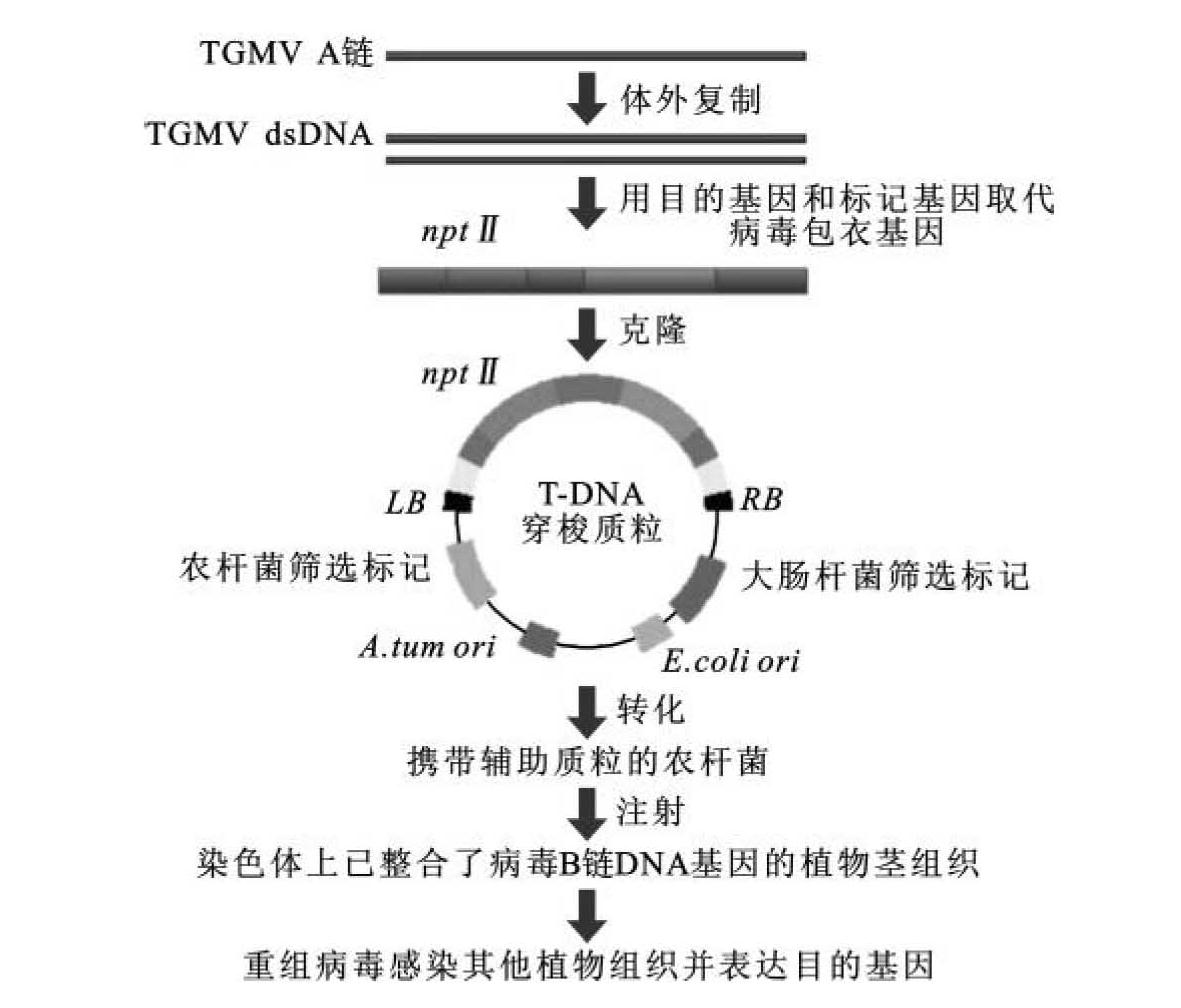
图9-12 番茄金色花叶病毒(TGMV)克隆表达载体的构建程序
