9.3.2 直接转化法
不依赖于生物体将裸露的DNA直接转移到受体细胞中导致细胞转化的方法称为直接转化法,包括基因枪法、电击法、PEG介导法、脂质体介导法、激光微束穿刺法、碳化硅纤维介导法、超声波介导法、显微注射法等。
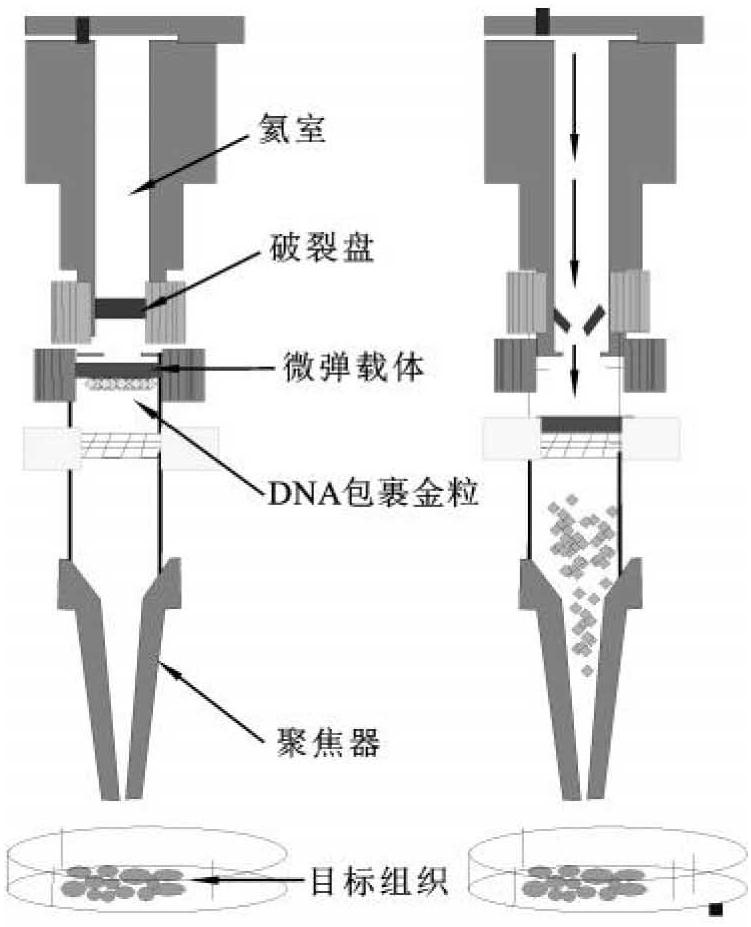
图9-13 基因枪转化的原理
1.基因枪(particle gun或biolistics)法
该转化方法是美国康乃尔大学生物化学系J.C.Sanford等于1987年研制成功的,其原理(图9-13)是通过高压气流的作用加速金属微粒的运动,将吸附在其表面上的DNA射入受体细胞中,伴随而入的DNA分子便随机整合到宿主细胞的基因组上。
相对于其他遗传转化方法,基因枪法有以下优点:①受体材料十分广泛,包括成熟胚、幼胚、幼穗、花药、分生组织、根或茎的切段、原生质体等具有分化能力的组织或细胞;②没有宿主限制,基因枪不仅可以对单子叶植物和双子叶植物进行轰击转化,还可以对动物、微生物进行有效转化;③可以转化线粒体、叶绿体等植物细胞器;④基因枪法转化得到的T0代植株大多是可育的;⑤基因枪法操作简单,而且在轰击过程中可以调节轰击参数,用最佳的轰击参数使转化效率达到最高。
当然,基因枪法也有其缺点:具有转化的多拷贝特性,基因的多拷贝插入容易引起基因的失活,影响基因的表达水平,可能引起基因的沉默;外源基因整合位置是随机的,会发生DNA丢失、环化和甲基化等;容易产生嵌合体;受体材料受到机械损伤,导致分化率降低;转化成本很高。
影响基因枪法转化率的因素有很多,主要是基因枪轰击参数(粒子速度、射程、轰击次数等)、受体的生理因素、金属微粒、DNA沉淀辅助剂及其浓度、DNA的纯度及浓度等。
(1)基因枪轰击参数:DNA包裹和射击过程中的各种物理参数因基因枪类型不同而有差别。以目前使用较为普遍的PDS-1000/He型基因枪为例,DNA包裹所用的金属粒子主要有金粒和钨粒,金粒形状较均匀,对受体细胞没有太大的损伤,转化效果较好。一般认为金属粒子大小以0.6~4μm为宜。氦气的压力是决定金属粒子飞行速度的主要因素,压力过大时会对植物细胞造成伤害,压力过小时金属粒子不能进入细胞。PDS-1000/He型基因枪提供了不同压力类型的可裂膜,在使用中可根据不同的转化材料进行选择。此外,金属粒子大小、载体膜的位置和受体靶材料的位置等参数也与其他射击参数相互联系,应根据实验具体设置。微弹射程是指基因枪挡板与靶细胞间的距离,也是影响基因转化率的重要因素。植物受体中只有特定的细胞具有再生能力,因此必须调节射程来转化这类细胞。在动力来源恒定时,射程越短,穿透力越大,对细胞的损伤也越大,因此必须根据受体材料选择合适的距离。
转化率与弹膛内的真空度呈正相关,但要考虑靶细胞对真空度的耐受性;轰击次数对转化率也有影响,适当的轰击次数有利于目的基因的转化,轰击次数过多往往使轰击细胞损伤严重,降低转化率。
(2)受体的生理因素:主要是指受体细胞或组织的生理状态。一般认为,生理活性高的组织或细胞有利于外源DNA的摄入与整合。选用再生能力强的外植体作为转化受体,在轰击前将受体预培养一段时间,可明显提高转化率。另外,高渗和脱水处理可使细胞质壁分离,从而减少轰击后,因细胞质溢出而导致细胞损伤,提高转化率。
(3)DNA的纯度及浓度:DNA纯度越高,转化效果越好;适宜的DNA浓度有利于提高转化率,高浓度DNA容易使微弹粘结成大凝结团而降低转化率,目前普遍采用的DNA浓度为1 mg/mL。
(4)DNA沉淀辅助剂及其浓度:最早使用的DNA沉淀剂是CaCl2和亚精胺。DNA沉淀辅助剂的浓度不仅对DNA在金属粒子上的黏附有重要影响,而且对植物受体细胞的伤害也至关重要。现在,普遍采用2.5 mol/L CaCl2、100 mmol/L亚精胺。但也有报道用Ca(NO3)2代替CaCl2,PEG400代替亚精胺可显著提高gus基因的瞬时表达水平。
2.电击法
电击法又称为电击穿孔转化法(electroporation transformation method),是20世纪80年代初发展起来的一种遗传转化技术。此法转移外源基因时,利用高压脉冲作用,在原生质体膜上“电击穿孔”,细胞膜上会出现短暂可逆性开放小孔,当外源DNA附着于细胞质膜上靠近电击点处时,DNA分子就有可能通过小孔进入细胞内,进而整合到受体细胞的基因组上(图9-14)。此通道形成的数量和大小与电场强度有关。
通过电击法介导外源基因转化植物原生质体应用范围广,适合于不同基因型的植物,特别是对农杆菌介导不敏感的植物,电击法是外源基因转入原生质体的一种理想方法。该方法操作简便,转化效率较高,没有化学物质对原生质体的伤害,非常适合于瞬时表达的研究。但是电击会造成原生质体的损伤,从而使植板率降低,同时仪器也较昂贵。
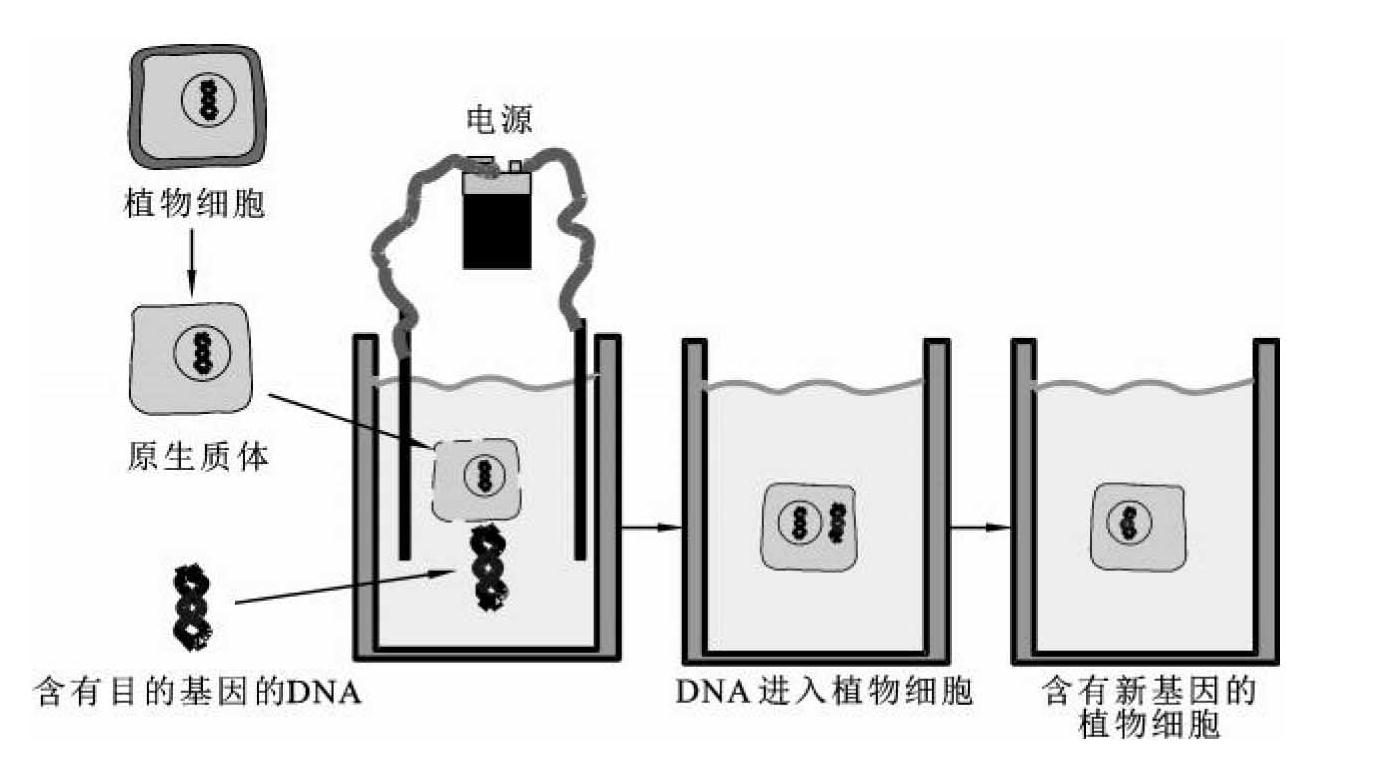
图9-14 电击法的原理示意图
经过努力尝试,研究者已经可以将电穿孔法运用于植物组织细胞的转基因,如近年有部分研究采用细胞悬浮系、发芽的种子和分割的成熟胚做转化的受体,这些外植体的应用使遗传转化更加简化。近年来,在电击法的基础上又发展了电注射法,可以直接在带细胞壁的植物组织和细胞上打孔,将外源基因直接导入细胞。使用该技术可以不制备原生质体,提高了植物细胞的存活率,而且简便易行。
影响转化率的主要因素如下:①电场强度。它影响通道形成的数量和大小,影响进入原生质体内的外源物质数量,是影响转化率的重要参数。电场强度增大,吸收外来DNA的能力增强,但同时细胞的存活率也会随之降低。②脉冲时间。脉冲时间是影响细胞膜透性的主要因素之一,对转化率有一定的影响。③DNA浓度。外源基因转化率会随着外源基因浓度的增加而上升,外源基因的浓度过高(大于100μg/mL),可能对受体细胞活力产生影响,所以外源基因浓度一般在10~50μg/mL。(https://www.daowen.com)
3.PEG介导法
PEG(polyethylene glycol)即聚乙二醇,具有细胞黏合及扰乱细胞膜的磷脂双分子层的作用,它可使DNA与膜形成分子桥,促使相互间的接触和粘连;引起膜表面电荷紊乱,干扰细胞识别而有利于细胞膜间的融合和外源DNA进入原生质体,进入原生质体的外源DNA随机地整合到基因组中,经培养再生可形成转基因的植株。以PEG6000最为常用。PEG介导法需要的设备简单,易于操作,结果也较稳定,所以在植物原生质体遗传转化中是应用最普遍的方法之一。
PEG介导法转化原生质体的转化率受很多因素的影响,主要有以下几个方面:①外源基因的浓度和构象。在一定浓度范围内,转化率随外源基因浓度的提高而增加,呈线性关系,线形DNA的转化能力可能高于环状质粒DNA。②外源DNA序列的重复性。外源DNA的重复性越高,转化率越高。③携带DNA的作用。小牛胸腺DNA起携带DNA的作用,其作用不能被相同浓度的质粒DNA代替。④PEG溶液浓度和pH值。PEG溶液浓度对转化率影响极大,太高对原生质体有伤害作用,太低则影响到转化效果。而高pH值的PEG溶液虽然有利于原生质体的瞬时表达,但导致原生质体分裂困难,培养一段时间之后破裂,因此不同植物应选择不同的PEG浓度和pH值。⑤加入DNA和PEG的顺序。先加入DNA可把转化率提高15倍左右,现在一般是先加入携带DNA,再加入质粒DNA,最后加入PEG溶液。⑥转化介质中二价阳离子的影响。在转化介质中加入Mg2+比加入Ca2+转化率高,但也有研究出现相反的结果。⑦原生质体的质量。转化效率与原生质体的质量呈正相关。另外,热激处理、射线照射等也影响到转化效率。总之,以原生质体为受体进行的遗传转化对环境条件等十分敏感,每个步骤都会影响到最后的转化效率,因此需对转化的各个环节进行严密的探究,才能获得一个完善、成熟的转化系统。
4.超声波介导法
低强度脉冲超声波可以击穿细胞膜,形成瞬时通道,从而使得外源DNA能进入细胞。现在对超声波击穿细胞膜的机制还不是很清楚,但一般认为有以下两种可能性:①超声波的生物学效应是由空化现象产生的。超声波引发的空化泡破裂时会产生瞬时的高压与高温,这种瞬时的高温高压冲击可能导致局部细胞膜的破裂,进而有可能吸收周围物质如DNA分子等,从而发生转化。②在超声波作用下,细胞膜内的流体静压力引发细胞膜的可逆性破裂,从而引发细胞与周围介质的物质交换。总之,超声波引发细胞转化的机制有可能是瞬时空化泡破裂时产生的高温高压或者是流体静压力导致细胞膜的机械破裂,又可能是两种作用同时存在导致细胞膜的机械破裂。
超声波转化是一个复杂的过程,在超声波作用下,会引起外源DNA分子断裂。因此,在转化时首先必须采用适当的超声波处理参数,以保持外源目的基因的完整性,使外源基因在转基因植物细胞中能够正确表达;其次才考虑能使细胞壁形成大量小孔的超声波参数;再次转化反应中加入二甲基亚砜(DMSO)或携带DNA,则超声波转化率还能提高。
超声波介导法具有操作简单、设备便宜、不受宿主范围限制、对受体机械损伤小、转化率高等优点,已成为烟草、玉米、甜菜等作物的基因工程中有效的转基因途径。但该法也存在外源DNA随机整合、多拷贝转化等问题,进而导致外源基因的丢失及基因沉默现象,尚待进行更深入的研究,使之完善。
5.激光微束穿刺法
激光的诞生为生物学提供了一个有效的研究工具。激光是一种相干性很强的单色电磁射线,一定波长的激光经过显微聚焦可形成微米级光斑,微米级的激光微束可对组织进行穿刺,从而导入外源DNA,这就是激光微束穿刺法。它可对生物靶体,如植物细胞壁、花粉粒等进行穿刺,引起膜的可逆性穿孔。
为保持生物体的活性,一般应用脉冲激光,脉冲激光与生物靶体作用时间很短,热效应小,冲击效应大,在照射到靶体组织的瞬间,组织首先被激光融化,形成气、液、固三相共存状态,气体分子反冲量变化产生压力把液体推向边缘,激光的热效应又把该部分液体汽化,进而使照射部位物质被切除,形成穿孔。当激光脉冲作用后,冲击力消失,由于膜具有一定流动性,细胞膜从“亚稳定”状态恢复到天然膜的原始状态。对植物受体材料而言,在激光辐射之前,受体组织或细胞必须进行高渗缓冲液预处理,将受体材料在适当浓度的高渗缓冲液中浸泡一定时间,使其体积缩小到原来的80%左右,其目的是形成细胞内外渗透压梯度,当微束激光在细胞表面形成穿孔时,外源基因可以依赖于渗透压梯度流入细胞内,而受体细胞的穿孔又在短暂的时间自行闭合,从而使细胞接受外源DNA。
同其他转化技术相比,激光微束转化系统有许多独有的特点:①光斑直径可聚焦到1 μm以下;②聚焦后的激光束可击穿细胞壁,甚至可在花粉上穿孔;③激光束耦合进入显微镜后,可对细胞膜进行可恢复性穿孔,导入外源基因,大大减小基因工程的难度;④激光束可被聚焦至细胞内,不必打开细胞膜即可对细胞核及细胞器进行操作,因此也可用于细胞器的转化;⑤激光束可对染色体进行切割,切割后的片段可构建基因文库;⑥激光微束有“光钳”的作用,可用来“捕捉”及操作细胞、细胞器、生物大分子等;⑦可以接受激光显微照射的受体材料来源广泛,不受种的限制,操作方便。基于激光微束穿刺法这些突出的优点,它一开始出现就引起了人们的广泛注意。随着该技术的不断完善和发展,它已成为植物转化方法中重要的组成部分。但该法需要昂贵的仪器设备,技术条件要求高,稳定性、安全性等目前还不如电击法和基因枪法。
6.脂质体介导法
脂质体(liposome)也称人工细胞膜,是由脂质双分子层组成的。磷脂分子在水中可自动生成闭合的双层膜,从而形成一种囊状物,被称为脂质体。将外源基因包裹在脂质体中,通过植物原生质体的吞噬、与细胞膜交换脂质或融合作用把内含物转入受体细胞,实现基因的转化。这种方法的影响因素相对较少,大体有以下几个方面:脂质体的类型和浓度、脂质体与原生质体相互作用的方式等。
虽然应用脂质体介导法已成功将外源基因导入植物原生质体中,但此法有其自身的缺点:在包装DNA时必须用短时间的超声波处理,会使相当多的DNA断裂;必须使用具有全能性的原生质体作为受体细胞,转化效率较低,操作复杂且专一性的脂质体不易制备,造成转化的烦琐和低效。
7.碳硅纤维介导法
碳硅纤维(silicon carbide whisker,SCW)介导的基因转化技术是近几年发展的新技术。SCW是一种细长的纤维状粉末,由它介导的转化简便、快捷,不需要昂贵的设备,是植物转化中最富吸引力的方法之一。组成SCW的碳硅有很高的内在硬度和断层,易形成尖锐的切面,经碳硅纤维处理的细胞,细胞壁被穿透。碳硅纤维表面带负电荷,使其同带负电荷的DNA无相互吸引力。SCW不携带DNA到细胞中,而是作为大量的微针通过振荡在细胞上打孔,从而帮助DNA进入细胞。该方法主要局限于几种植物(如玉米、烟草等)的悬浮培养细胞,其余受体研究较少。
