11.1.1 完全基因敲除技术
完全基因敲除技术是以基因打靶技术、胚胎干细胞(ES细胞)的分离和培养技术为基础,通过基因工程方法使得动物体内(一般为小鼠)某一基因功能缺失的技术。以小鼠为例,首先需要获得小鼠ES细胞,然后构建打靶载体,采用基因打靶技术转染ES细胞后,在ES细胞中通过同源重组,用突变基因将原有正常的内源基因替换掉,从中靶ES细胞中筛选阳性细胞株后,再将阳性细胞株通过显微注射技术导入早期胚胎,移入小鼠子宫内完成胚胎发育过程。最终可以通过回交和杂交等方式,获得完全基因敲除的纯合体(图11-1)。
1.胚胎干细胞的获得
基因敲除技术中使用的动物一般是小鼠,其中129种系及其杂合体是最常用的种系,主要因为129种系及其杂合体小鼠具有自发突变形成畸胎瘤的倾向,是基因敲除中的理想胚胎干细胞来源。自1981年Evans首次分离得到小鼠ES细胞后,哺乳动物ES细胞的分离技术日渐成熟,目前已广泛应用于各个研究领域。ES细胞是分子遗传学、基因工程、细胞工程、组织工程等研究的重要工具,在基因功能研究、基因治疗、转基因等领域具有重要意义。
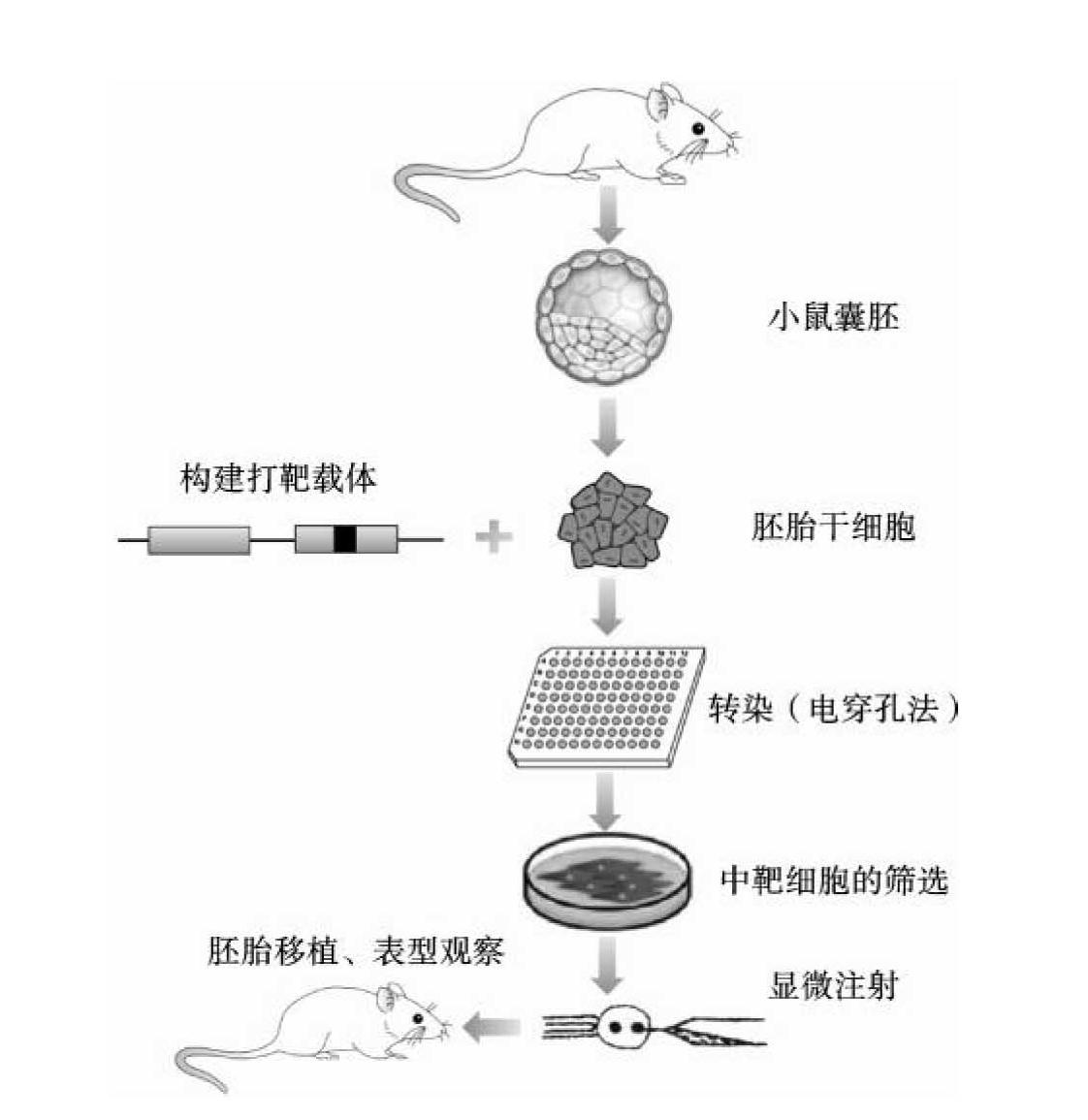
图11-1 完全基因敲除技术的基本流程
目前哺乳动物ES细胞较常用的分离方法包括全胚培养法、免疫外科法和酶消化法。其中全胚培养法是最早用于分离培养ES细胞的方法,又称为显微剥离法,此方法在分离前需将早期胚胎透明带脱去,然后将胚胎内细胞团和滋养层细胞共同培养,待胚胎内细胞团增殖到出现生长集中、细胞团隆起明显的细胞集落后,通过显微操作将囊胚的胚胎内细胞团与周围的滋养层细胞剥离开,使用胰酶消化后,离散并接种。研究表明,此方法获得的ES细胞贴壁率达到60%以上。
免疫外科法是指采用免疫法去除滋养层,进而分离ES细胞的方法。将脱去透明带的囊胚分别置于抗体和补体中作用一段时间(一般为30 min)后,转移到培养基中,轻轻吹打以除去溶解的滋养层细胞,然后将纯的胚胎内细胞团转入ES细胞培养液中培养,待其增殖后消化、离散以获得ES细胞。免疫外科法培养时不受滋养层细胞的影响,因此获得的ES细胞纯度较全胚培养法更高。
酶消化法是采用酶消化除去滋养层,进而分离ES细胞的方法。将脱离透明带的囊胚置于0.25%胰蛋白酶-0.04%乙二胺四乙酸的细胞消化液中,消化约5 min后将囊胚移入培养液中,此时滋养层细胞已经脱落,使用吸管和拨针分离胚胎内细胞团,离散并接种。酶消化法操作简单,效果明显。据报道,采用酶消化法分离ES细胞的获得率达到85%以上。
2.打靶载体的构建
在基因敲除过程中,需要将目的基因和与细胞内靶基因特异片段同源的DNA分子都重组到带有标记基因的载体上。此载体也称为打靶载体,在基因敲除技术中用于和打靶位点重组。在设计载体时,可根据基因打靶目的的不同,设计不同种类的载体,包括替换型打靶载体和插入型打靶载体。为了使某一基因失去其生理功能,应将打靶载体设计为替换型打靶载体。绝大多数完全基因敲除技术选用的是替换型打靶载体。打靶载体的基本组成包括载体骨架、靶基因的同源序列和选择性标记,其中选择性标记用于筛选打靶重组后的转化子,常用的标记基因有新霉素磷酸转移酶(neo)基因、单纯疱疹病毒的胸苷激酶(TK)基因、lac Z基因等。
3.基因的导入和中靶ES细胞的筛选
在获得ES细胞和打靶载体后,需将基因打靶载体导入同源的ES细胞中,使ES细胞基因组和外源DNA发生同源重组,导入成功后才能将打靶载体中的DNA序列整合到内源基因组中得以表达。一般可采用电穿孔转化法或显微注射法。显微注射法命中率较高,但技术难度相对较大,电穿孔转化法便于操作,因此常用电穿孔转化法导入基因。
在完成基因导入后,快速、高效地筛选中靶ES细胞是重要的步骤。为了将同源重组的中靶细胞筛选出来,可用选择性培养基筛选已击中的细胞。一般情况下,可选用正负选择系统筛选中靶细胞,即设计具有正、负两个选择性标记的打靶载体。常用的正选择标记包括lacZ、新霉素磷酸转移酶(neo)基因等,其中neor基因是应用最多的正选择标记,因其对新霉素具有抗性,常将neor基因置于载体的同源靶基因内,若同源重组成功,中靶的ES细胞会表现新霉素抗性;负选择系统常用tk基因,即胸苷激酶基因,其表达产物为胸苷激酶,胸苷激酶能够将核酸类似物如丙氧鸟苷代谢为毒性物质,影响细胞存活。通常在设计载体时,将tk基因置于靶基因同源区域外,未发生同源重组时,打靶载体与ES细胞的染色体会产生随机整合,位于打靶载体中的正负选择基因整合到ES细胞染色体中,tk基因会导致细胞中毒死亡。当上述正负选择系统存在时,中靶的阳性ES细胞株被筛选出来(图11-2)。
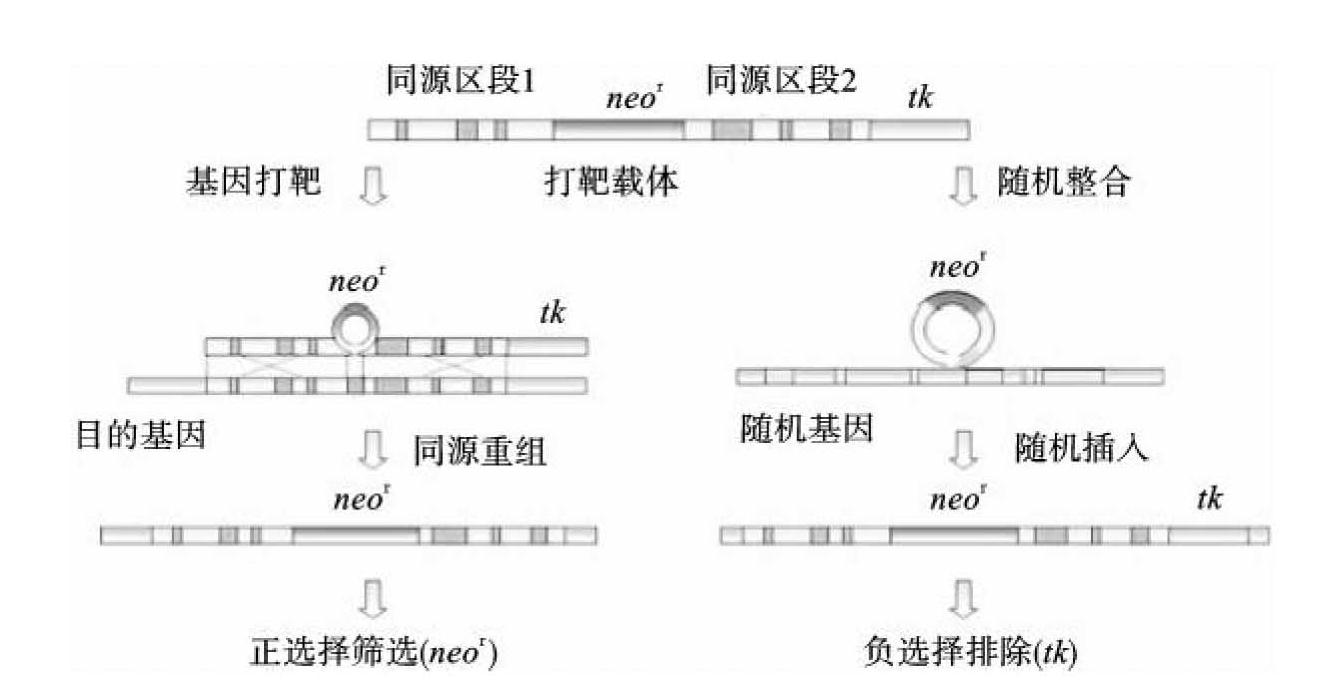
图11-2 正负选择系统
(改自Cherng-Shyang Chang)
