免疫系统对神经、内分泌系统的调节作用
免疫系统是除神经系统外,机体能特异地识别“异己”刺激、对之做出精确应答,并保留记忆反应的功能系统。免疫细胞间的信息沟通和功能调节分子主要是细胞因子和抗体。细胞因子通过其多效作用形成的细胞因子网络,以及抗体通过其独特型决定基因形成的独特型网络是免疫系统功能稳定的主要机制。这种“免疫稳态”机制在保证免疫应答的精确性,完成其免疫防御、免疫监视和免疫自稳功能,从而在维持机体内环境稳定方面发挥重要作用。
细胞因子在神经、内分泌与免疫系统的双相关系中起重要的调节作用,免疫系统对神经、内分泌系统的调节作用主要是指细胞因子对神经、内分泌系统的调节。
(一)细胞因子对神经活动的调节作用
1.细胞因子对脑电和行为的影响·IL-1可明显延长动物的慢波睡眠(SWS)时相,而缩短快速眼球运动睡眠(REM)时相,并使脑电图中慢波成分增强。将IFN-α或IL-1注入脑室,可引起大鼠典型的睡眠行为和皮质脑电图同步化改变,而IFN-β和IL-6则无此作用。进一步研究发现,IFN-α催眠作用是部位特异性的,小剂量IFN-α注入蓝斑核即可引起明显的睡眠行为及皮质脑电图改变,而相同剂量的IFN-α注入其他脑区则无此作用。预先应用纳洛酮处理动物,可阻断IFN-α催眠作用,提示在蓝斑核水平的作用是由阿片受体所介导。静脉或脑室注射TNF也可使SWS增强、REM减弱及脑电图中慢波增强。
IL-2能引起神经元放电的改变。将重组人IL-2注射入大鼠第三脑室后,即能引起下丘脑腹内侧核放电频率降低,而视上核和室旁核则增加。由于视上核和室旁核能分泌血管升压素,因此可能解释IL-2治疗肿瘤患者过程中出现的水潴留现象。脑内微量注射IL-2能引起行为迟钝反应,对清醒大鼠产生与剂量成正比的催眠作用和相应的皮质电图(ECoG)变化,其中最敏感的脑区是蓝斑。用10-12 M浓度的IL-2注入大鼠第三脑室后,产生的催眠作用和相应的ECoG慢波睡眠开始于IL-2注射后5~10分钟。通过对不同脑区注射IL-2所引起的效应观察,发现蓝斑是介导催眠作用的部位,仅10-13 M浓度IL-2注入蓝斑就能产生上述行为反应和ECoG变化,同样剂量IL-2注入其他脑区则不能引起明显的效应。由于蓝斑与觉醒—睡眠周期有关,IL-2所引起的上述变化可以解释IL-2治疗肿瘤患者过程中产生的催眠效应。IL-2诱发的催眠反应和ECoG变化,可能是由作用于特异性受体所致,IL-2的这一作用与阿片受体有关。IL-2微量注入尾核或黑质致密层部位,可以看到同侧转动和周期性同侧旋转这些不对称体位等行为反应,表示IL-2可能单侧抑制黑质、纹状体多巴胺能通路。
2.细胞因子的致热原作用·脑室注射IL-1β时引起的发热反应较静脉注射时强烈且持久,提示IL-1可直接或间接作用于中枢神经系统。静脉或脑室注射重组IL-1β引起的发热反应持续时间都小于30分钟,且是单相的,即只出现一次发热高峰。小剂量静脉注射或脑室注射IL-1α也可引起单相发热反应,但大剂量静脉注射时诱发双相发热反应。IL-1致热作用的这种差别说明IL-1α与IL-1β存在功能差异。体内外实验均表明,IL-1可影响脑组织的花生酸代谢并刺激PGE2的生成,因而IL-1诱发的发热反应可能由PGE2及PGD2介导。
早期用TFN治疗肿瘤患者时发现有致热不良反应。有研究表明,此作用并非TNF制剂被致热源污染所致。TNF的致热作用与IL-1很相似,静脉或脑室注射引起的发热反应持续仅48~54分钟,小剂量静脉注射或脑室注射TNF引起单相发热反应,大剂量静脉注射时诱发双相发热反应,但同剂量IL-1的致热作用较TNF强。TNF还能刺激下丘脑体外培养薄片分泌PGE2,所以TNF也可能是通过刺激脑组织释放PGE2引起发热反应。
3.细胞因子的镇痛作用·采用不同动物模型、不同测痛方法,均观察到IL-2具有中枢和外周镇痛作用,而且IL-2的这一作用主要由阿片受体所介导。人IL-2分子第62位Glu、20位Asp以及126Gln残基是IL-2与IL-2受体结合、信号传递和发挥免疫调节作用的关键残基,采用基因定点突变方法,将这三个氨基酸残基分别突变为Leu、Leu和Asp。获得的3个IL-2突变体对IL-2依赖的CTLL-2细胞株的增殖能力显著下降或消失,即免疫学活性显著下降或消失,但它们仍具有明显的镇痛功能。结果表明,IL-2具有相互独立的免疫和镇痛功能位点,分别介导免疫和镇痛活性。进一步研究发现,IL-2分子的镇痛功能位点是IL-2分子通过空间折叠形成内源性阿片肽分子N端样结构所构成。
IFN-α具有中枢镇痛作用,此作用可被纳洛酮阻断或翻转,因此IFN-α对中枢神经系统的这一作用与阿片受体有关。给予吗啡成瘾大鼠脑室注射IFN后,可减轻动物纳洛酮戒断引起的行为反应,且有剂量依赖关系,脑室注射IFN还影响下丘脑腹内侧区、上丘及视皮质的诱发电位,在有吗啡或纳洛酮存在时,IFN对上述部位的电活动的影响有所不同。IFN-α的镇痛作用也是由类似于IL-2的独立于免疫调节功能位点的阿片样功能位点与阿片受体直接作用所介导。
(二)细胞因子对下丘脑-垂体轴的调节作用
细胞因子能够作用于下丘脑和(或)垂体腺而影响神经内分泌,它们主要有IL-1、IL-2、IL-6、TNF和IFN。
1.白细胞介素-1(IL-1)对下丘脑-垂体轴的影响·垂体腺分泌的ACTH主要受下丘脑CRH和糖皮质激素的负反馈控制和调节。任何形式的应激包括感染、炎症可以激活下丘脑-垂体-肾上腺轴。致热原、白细胞分泌介质特别是细胞因子可以刺激ACTH和皮质类固醇的释放。
IL-1通过CRH的介导,刺激ACTH的释放。IL-1静脉注射可刺激小鼠、大鼠ACTH和糖皮质激素的释放,这一作用可以通过中和CRH所抑制,提示CRH介导IL-1引起的ACTH的释放。IL-1脑室注射可导致CRH的立即释放,静脉注射后可在门静脉测出CRH浓度的升高。下丘脑存在着IL-1β免疫反应性物质,其中浓度最高的是室旁核、弓状核和正中隆起。大鼠下丘脑存在着IL-1特异性高亲和力受体,抗IL-1受体拮抗剂可以抑制IL-1引起的ACTH的释放。IL-1和抗CRH抗体同时使用,可以减轻IL-1所致的厌食症状,表示CRH也介导IL-1对食欲抑制的作用,这一机制可以解释急、慢性疾病中的食欲减退症状。
大鼠腺垂体的促甲状腺素细胞内存在着IL-1β和IL-1βmRNA,垂体腺内也存在着IL-1α高亲和力结合位点,提示IL-1在此水平有直接作用。IL-1α、β均能刺激大鼠垂体培养细胞ACTH的释放。
IL-1对下丘脑-垂体-性腺轴的主要作用是抑制促性腺激素释放激素(GnRH)的分泌。女性GnRH波动的频率和幅度对排卵至关重要。IL-1β能抑制GnRH波动频率和幅度,抑制动情前期促黄体生成素(LH)高峰。阿片受体拮抗剂纳洛酮可以阻断IL-1对GnRH的抑制作用,提示IL-1的作用与内源性阿片肽有关。
垂体生长激素分泌主要由生长激素释放激素(GHRH)的刺激作用和生长抑素的抑制作用之间的平衡关系所控制。IL-1能特异地刺激大鼠下丘脑GHRH和生长抑素的释放,增加胚胎下丘脑生长抑素的合成。IL-1主要作用于生长抑素的释放,且在下丘脑水平面发挥作用。
IL-1β皮下注射,可引起血清促甲状腺激素(TSH)水平的下降,而甲状腺素和三碘甲状腺原氨酸在短暂升高后下降。IL-1脑室注射亦可抑制TSH释放。IL-1对甲状腺释放甲状腺激素也有直接抑制作用。IL-1主要作用于下丘脑,对之有持续的抑制作用。
2.白细胞介素-2(IL-2)对下丘脑-垂体轴的影响·IL-2与垂体细胞孵育可使其前阿黑皮素原(POMC)基因转录增加,CRH基因转录亦有提高,对At T-20细胞株也有类似的效应。
IL-2能促进大鼠下丘脑CRH的释放,也能改变垂体腺激素的释放。IL-2能够刺激PRL、TSH和ACTH的释放,抑制LH、FSH和GH的释放。各种类型的腺垂体细胞均能表达IL-2受体。
在使用IL-2治疗肿瘤患者的过程中,会发生明显的神经内分泌反应,如引起ACTH和皮质酮的释放。IL-2还能直接刺激肾上腺释放皮质酮。
3.白细胞介素-6(IL-6)对下丘脑-垂体轴的影响·IL-6静脉和脑室注射均能刺激大鼠ACTH释放。抗CRH抗体和IL-6同时注射大鼠,可阻断IL-6的上述作用,表示IL-6可能与IL-1一样,其促进ACTH的分泌是由CRH所介导。IL-6在体外能刺激大鼠下丘脑CRH的分泌。IL-6还可直接刺激肾上腺释放皮质酮。
IL-6能直接刺激大鼠腺垂体培养细胞释放GH,对LH的分泌也有直接刺激作用。IL-6在体外能刺激腺垂体细胞分泌TSH,脑室注射亦能刺激TSH释放。
大脑IL-6主要由腺垂体folliculo-stellate细胞产生,此细胞所在区域接近PRL和GH分泌细胞,IL-6作为旁分泌因子控制垂体激素释放。IL-1、VIP、垂体腺苷酸环化酶激活多肽(PACAP)和降钙素基因相关肽(CGRP)可以刺激腺垂体释放IL-6。皮质类固醇、地塞米松可抑制IL-6分泌。约2/3体外培养的人垂体腺瘤细胞可分泌、释放IL-6,它们往往是分泌激素肿瘤。IL-1是垂体腺瘤培养细胞释放IL-6的强刺激因子。IL-6能促进GH3大鼠垂体瘤细胞的生长,而抑制正常大鼠腺垂体细胞的生长。
4.肿瘤坏死因子(TNF)对下丘脑-垂体轴的影响·TNFα不但对下丘脑CRH的释放有刺激作用,还可以直接刺激肾上腺释放皮质酮。TNFα静脉注射可增加ACTH的释放,作用机制与IL-1相类似,即抗CRH抗体可以阻断TNFα的激活作用,因而认为其作用于下丘脑,通过释放CRH而激活HPA轴。
TNFα能够刺激下丘脑体外培养细胞释放GnRH和IL-6,在雌二醇存在下,这一作用加强。TNFα脑室注射卵巢切除术大鼠,血清LH浓度降低。TNFα能刺激大鼠腺垂体培养细胞分泌PRL,但对下丘脑多巴胺释放没有作用。TNFα对甲状腺分泌甲状腺激素有直接的抑制作用。
5.干扰素(IFN)对下丘脑-垂体轴的影响·IFN-α与ACTH存在着结构的同源性,在功能上亦有交叉。IFN-α有类似ACTH的促进肾上腺肿瘤细胞株合成和释放糖皮质激素作用。IFN-α还具有内源性阿片肽的生物活性。
IFN-α对大鼠垂体培养细胞CRH所致的ACTH分泌起抑制作用。IFN-α和IFN-γ总的来说,抑制HPA的神经内分泌活动,而且阿片受体μ亚型拮抗剂可以阻断IFN的作用,提示IFN的作用与阿片受体有关。
IFN-γ对下丘脑-垂体-甲状腺轴能起持续的抑制作用,IFN-α亦能明显地降低血中T3、T4水平。但是IFN-α、β、γ均能刺激大鼠腺垂体培养细胞分泌PRL,抑制TRH和VIP刺激产生PRL的释放。
大量证据表明,细胞因子能够调节下丘脑-垂体轴功能,并直接作用于靶腺。总体而言,细胞因子对下丘脑-垂体-肾上腺轴有显著的刺激作用(IFN起抑制作用),对下丘脑-垂体-甲状腺、性腺轴起强烈的抑制作用,并可能抑制GH的释放。细胞因子对神经内分泌的调节作用可概要地用图6-2表示。
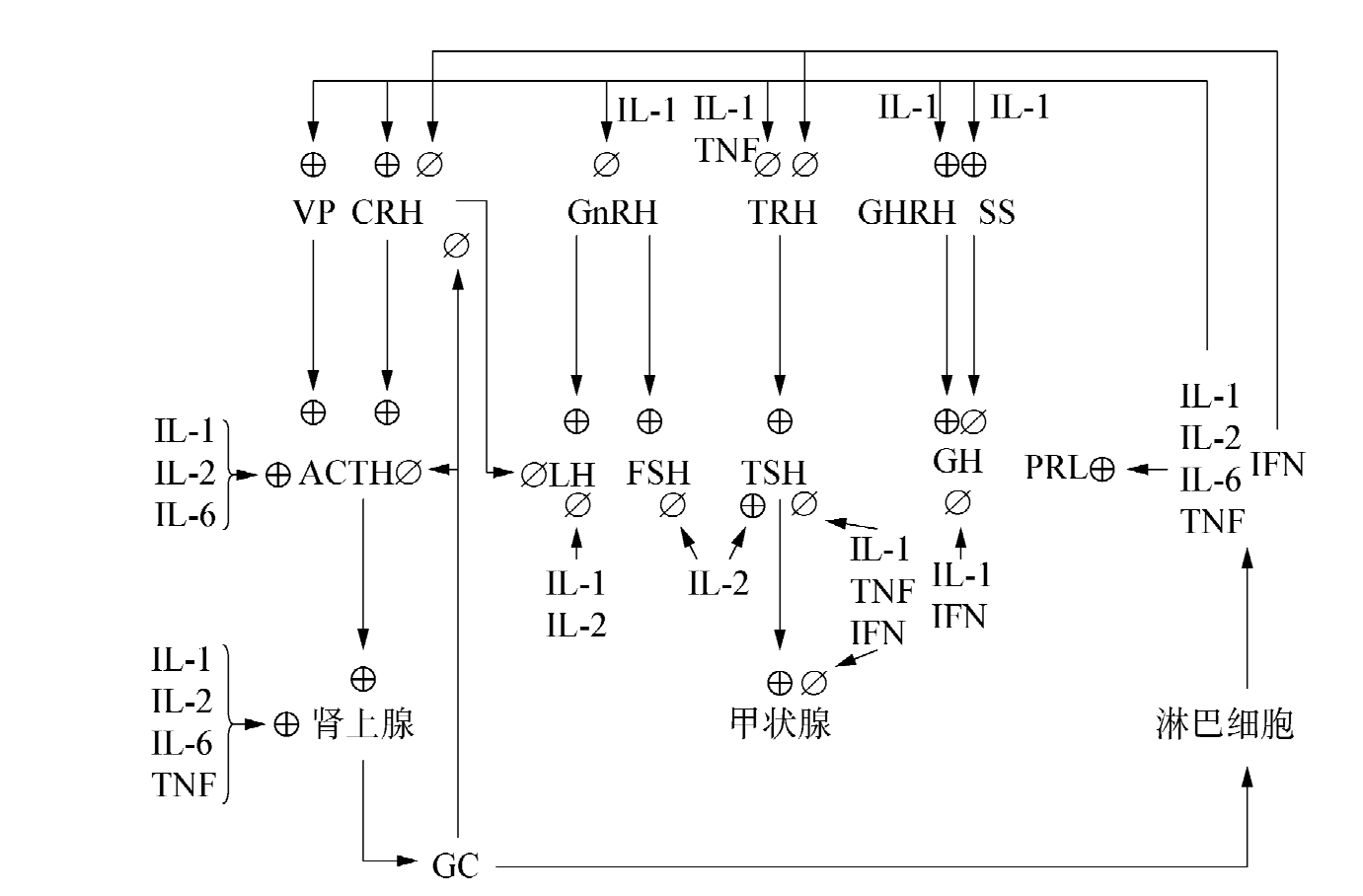
图6-2 细胞因子对神经内分泌的调节作用
(IL:白细胞介素;IFN:干扰素;TNF:肿瘤坏死因子;CHRH:促生长激素释放激素;TRH:促甲状腺激素释放激素;CRH:促皮质激素释放激素;GH:生长激素;PRL:催乳素;TSH:促甲状腺素;FSH:促卵泡刺激素;LH:黄体生成素;ACTH:促肾上腺皮质激素;VP:升压素;SS:生长抑素;GnRH:促性腺激素释放激素;⊕:促进;∅:抑制)
(三)细胞因子对神经细胞活动的调节作用
1.细胞因子对神经元和神经胶质细胞的作用·IL-1、IL-2、IL-6等均具有神经营养作用。IL-6在体外同NGF一样,可促进嗜铬细胞瘤株PC12细胞轴突生长、分化以及c-fos基因表达。IL-1与成纤维细胞或施万细胞共育一定时间,可促进细胞内神经营养因子NGF mRNA表达,并增强该mRNA的稳定性。无论是胶质细胞来源还是巨噬细胞来源的IL-1,在体外均可促进星形胶质细胞的增殖,重组IL-1对新分离的胚胎期胶质细胞亦有促进作用。
IL-2能够支持大鼠胚胎海马神经元的存活,并促进轴突生长,IL-2还能支持皮质、纹状体和隔区神经元的存活。IL-2还能明显地影响神经胶质细胞的生长,10-9 M浓度的IL-2能刺激新生大鼠少突胶质细胞的增殖和成熟,并引起髓磷脂碱性蛋白(MBP)的增加。IL-2通过促进基因表达的方式来影响胶质细胞的生长,促进mRNA的转录来调节胶质细胞MBP的表达。
星形胶质细胞、少突胶质细胞、小胶质细胞、感觉和运动神经元、垂体细胞等能对多种细胞因子起反应,这些细胞因子还包括IL-3、TNF、IFN-α、IFN-β、IFN-γ、神经白细胞素等,提示细胞因子可能在中枢神经系统的损伤修复、生长发育和生理功能中起重要作用。
2.细胞因子对神经递质产生的影响·由于在大鼠海马区存在高密度的IL-2、乙酰胆碱及其相应受体,提示两者在功能上可能有一定的联系。外源性IL-2能明显降低钾离子诱发的乙酰胆碱释放,这一作用是区域依赖性的,即它只抑制海马区组织切片释放乙酰胆碱。腹腔注射IL-1α及IL-1β可引起在大脑前额叶皮质、下丘脑及脑干内的去甲肾上腺素代谢产物3-甲基氧、4-羟苯乙二醇含量升高,说明去甲肾上腺素能神经元活动增强,下丘脑尤为显著。外源性IL-2在体外能有效地抑制钾离子诱导的内源性乙酰胆碱从海马释放。临床长期用IL-2治疗肿瘤,发现有严重的识别障碍,由此推测,海马中的IL-2与胆碱能系统可能有相互作用。给予海马外源性IL-2还能产生很强的抑制长时程增强(LTP)作用,结果显示海马在学习和记忆形成过程中,IL-2可能具有重要影响。
3.细胞因子对神经肽产生的影响·IL-1和IL-2在体外与正常垂体细胞及垂体瘤细胞株At T-20共育均可促进阿片肽、黑素细胞刺激素(MSH)及ACTH的共同前体POMC的基因表达。IL-1可增强CRH、去甲肾上腺素等诱导的At T-20细胞分泌β-内啡肽。IL-1β与大鼠的颈上神经节组织共育可明显增加神经节细胞释放P物质及其基因表达。
至于大分子的细胞因子能否通过或如何通过血脑屏障而发挥作用,还不是非常清楚,目前已有证据并提出了几种可能性。
(1)细胞因子可在血脑屏障薄弱环节——下丘脑前区终板血管器水平处通过血脑屏障。
(2)细胞因子可能通过血脑屏障部位的细胞转运功能而进入脑实质。
(3)细胞因子刺激中间媒介的产生,并传递信号至下丘脑等部位。
(4)细胞因子刺激下丘脑等部位的细胞因子释放而发挥作用。
