神经、内分泌与免疫系统间相互调节的结构基础及其机制
(一)神经系统对免疫系统的神经支配
目前已知,中枢免疫器官、外周免疫器官和免疫细胞都受神经系统的支配。神经支配主要来源于去甲肾上腺素能的交感神经链和大血管的交感神经丛,亦有人认为还存在副交感神经的同时支配,它们沿血管进入相应的免疫器官。
1.胸腺的神经支配·胸腺在其发育的早期就接受自主神经的支配。当胸腺由其起源的颈部下降时,迷走神经的胸腺支于其皮质和髓质交界处继续发展为复杂的神经网。于其发育的晚期,由位于颈和胸交感神经链神经节衍化而来的交感纤维于髓血管周围形成神经丛。于围产期和青春前期,自主神经系统的其他神经开始穿入胸腺的实质。支配成年小鼠胸腺的神经由膈、喉返神经,也由颈和胸交感神经链的颈上和星状神经节衍化而来。
胸腺内除了主要由副交感神经性神经支配,尚有交感神经性神经支配。其递质包括乙酰胆碱、去甲肾上腺素、P物质、血管活性肠肽、生长激素抑制激素、血管紧张素和γ-氨基丁酸等。支配胸腺的交感神经纤维随大血管进入胸腺,分布于胸腺皮质,少量进入髓质,神经纤维的末端终止于富含淋巴细胞的基质中,这些细胞表面具有β肾上腺素能受体。
2.骨髓的神经支配·骨髓的交感神经支配随小动脉进入骨髓,分布于骨髓髓质,到达造血细胞。刺激动物的交感神经干可引起骨髓血细胞进入体循环。
3.脾脏的神经支配·脾脏主要由源于胸髓内侧柱经上和下内脏神经的太阳神经节所支配。其大部分神经与小梁动脉相伴而进入实质,一般终止于白髓的小动脉树。大部分去甲肾上腺素能神经纤维从脾门和动脉一起进入脾脏,然后沿血管到达脾脏白髓的中央动脉周围,再与中央动脉周围的交感纤维分别进入富含淋巴细胞的区域。切除鼠的脾脏交感神经可以增进抗体生成反应。
祁海和胡霁等发现了一条神经系统调节适应性免疫应答的解剖学通路,从小鼠大脑杏仁核和室旁核CRH神经元到脾脏存在直接的神经通路,去除脾脏神经的小鼠在疫苗接种后产生的抗体分泌细胞数量剧减,脾脏中B细胞表达的乙酰胆碱α9受体对脾神经的这个促进作用不可或缺。这一结果揭示了CRH神经元的双重免疫调节功能,除了经典的HPA轴的神经内分泌免疫调节作用,还有经神经环路直接作用于脾的免疫增强作用。
4.淋巴结的神经支配·交感神经纤维终止于富含T淋巴细胞的副皮质区。交感神经末梢与淋巴细胞相紧邻,它们之间的距离小于典型的突触间隙,形成类突触结构并产生相应作用。支配淋巴结的自主神经系统不如在胸腺或脾脏中那样致密和均一。乙酰胆碱酯酶阳性纤维局限于胞膜或胞膜下区,而儿茶酚胺纤维游离神经纤维则进入淋巴结并形成血管周围丛。
免疫组织的神经支配作为神经、内分泌系统对免疫系统调节作用的神经解剖学基础,在免疫系统器官的发育、身体内环境的稳定,以及特异性免疫应答的调节中发挥重要作用。
(二)神经、内分泌与免疫系统共用的化学语言
1.免疫细胞上的神经递质、神经肽和激素受体·免疫细胞上存在着神经递质、神经肽和激素受体,这为神经、内分泌系统对免疫功能的调控作用提供了结构基础。神经、内分泌系统的各种神经递质、神经肽和激素可能是通过免疫细胞上的各种相应受体起调控作用的。
T、B淋巴细胞以及血液中其他白细胞上均存在着肾上腺素β受体、组胺特异性结合的受体。人多形核白细胞及小鼠脾小结中的淋巴细胞上可能存在着肾上腺素α受体。哺乳动物淋巴细胞上还有多巴胺受体。
早在1985年发现人T淋巴细胞上有阿片类受体。吗啡及甲硫脑啡肽在10-9 M的水平上就可以影响人T淋巴细胞的玫瑰花结花率,而且纳洛酮可以翻转这种反应。进一步研究表明,淋巴细胞、多型核白细胞、肥大细胞、自然杀伤细胞、单核细胞和巨噬细胞等免疫细胞上不仅有阿片受体,而且存在着不同的亚型。免疫细胞上还有P物质、生长抑素、VIP、胰岛素、胰高血糖素、TRH、GH、LH、FSH、CRH等肽类受体。
淋巴细胞和单核细胞内都发现存在糖皮质类固醇激素受体。这些受体在不同的免疫细胞及同一免疫细胞的不同活化阶段均可发生变化。生理浓度的糖皮质类固醇即可对淋巴细胞转化、T淋巴细胞介导的细胞毒等反应有抑制作用。
免疫细胞上还有乙酰胆碱、甲状腺素及5-HT等受体。另外,在免疫器官上亦发现有神经递质、神经肽和激素受体。
2.脑内存在着细胞因子受体·中枢神经系统不仅可产生多种细胞因子或免疫活性物质,而且可以表达细胞因子受体,这为免疫系统能够调节神经、内分泌系统提供了物质基础。
啮齿类动物大脑广泛存在着125 I-IL-1高亲和力结合点,未标记IL-1可明显抑制125 I-IL-1与脑片相应部位结合,提示IL-1结合的高度特异性。大鼠下丘脑和垂体存在着IL-1高亲和力受体。
在正常人和早老性痴呆患者脑中均检测到IL-2受体。大鼠脑内几个不同脑区有IL-2结合位点的存在,其中以海马最高。海马损伤后,IL-2R表达可提高到正常对照的17倍。脑内也存在着IL-6受体。
3.免疫系统可直接产生神经肽和激素·免疫系统可直接分泌神经肽和激素,这是一个重要的发现,因为过去一直认为这些激素只有神经内分泌系统才能分泌。现已证明这些由免疫系统分泌的激素,其结构与功能和神经内分泌细胞所产生的相一致。它们是神经内分泌系统与免疫系统之间双向作用的枢纽之一。由此,免疫细胞可以起一种流动脑(mobile brain)的作用。
早在1980年,Blalock和Smith的研究表明,人IFN-α分子中可能有ACTH的活性片段。他们以ACTH1~13血清与人IFN-α共同孵育,发现这种抗体可以中和IFN的抗病毒活性;反之,以抗人IFN-α的抗体与ACTH孵育,ACTH的活性也消失,这种与ACTH孵育后的抗IFN-α抗体也同时失去了中和IFN的作用。人外周血及小鼠脾细胞在受到病毒感染或与细菌LPS反应后可同时分泌免疫反应性ACTH,其抗原性、分子量、在体内停留时间及生物学活性等方面均与脑垂体分泌的相同。
人外周血及小鼠脾淋巴细胞在受到病毒感染或与细菌LPS反应后可分泌内啡肽,其抗原性、分子量、在体内停留时间及生物活性方面均与脑内分泌的相同。人白细胞产生的IFN除了有ACTH片段,还具有阿片肽样结构。人IFN-α具有阿片肽样生物活性,小鼠腹腔注射IFN-α,可以产生与阿片肽十分相似的镇痛、活动减少和木僵等反应,纳洛酮可以阻断IFN-α的这些反应。淋巴细胞产生的内啡肽样物质,一种可能来源于IFN。小鼠脾细胞的巨噬细胞内有免疫活性的ACTH和β-EP,内毒素可刺激淋巴细胞产生内啡肽。LPS对内啡肽产生的作用呈量效关系,在刺激后48小时达到高峰,并测得淋巴细胞产生的这些物质分子量与β-EP和γ-EP相同,它们可以与阿片受体结合,并被纳洛酮所阻断。免疫细胞内的β-内啡肽可能在内毒素休克时释放入血,而影响休克进程。在人慢性淋巴细胞白血病患者的白细胞、T细胞瘤、巨噬细胞瘤系、巨噬细胞、肥大细胞和T辅助细胞株中发现脑啡肽前体mRNA。
除上述几种神经肽和激素外,免疫细胞可产生促甲状腺激素(TSH)、生长激素(GH)、绒毛膜促性腺激素(CG)以及PRL、催产素、精氨酸加压素、生长抑素等。表6-2列举了免疫系统产生的神经肽和激素。
表6-2 免疫系统直接产生的神经肽、激素
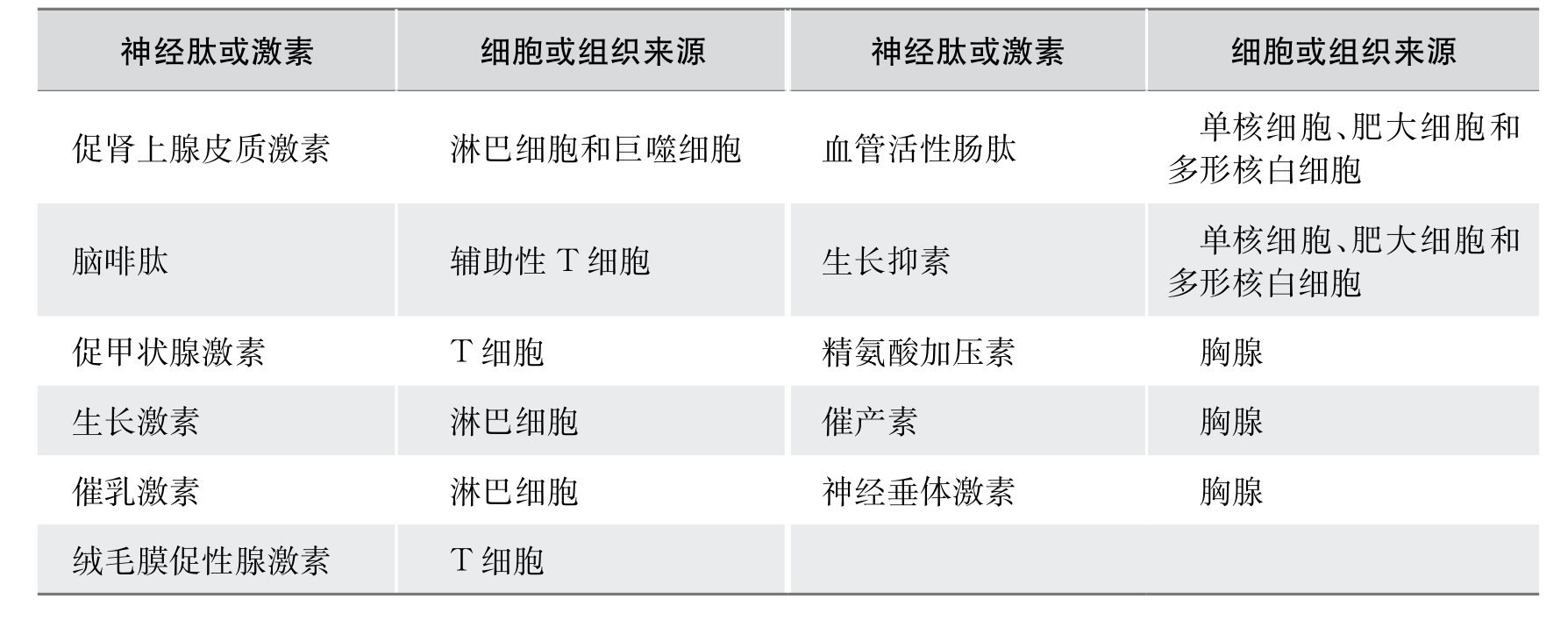
由于免疫细胞可以接受刺激产生激素或神经递质样物质从而影响全身其他器官的功能,所接受的刺激如毒素、病毒、细菌等都是神经系统难以感受到的。因此,免疫细胞可能作为机体的另一类感受器,在接受这些刺激后通过所产生的激素或神经肽等,不仅影响和调节免疫功能本身,而且还可以影响和调节机体其他功能。
4.中枢神经系统产生细胞因子·细胞因子主要是由免疫活性细胞产生的一系列免疫调节因子,但中枢神经系统也可产生这类因子。目前,对细胞因子在中枢神经系统中表达、产生的调控因素,细胞因子对中枢神经系统生理功能的影响,以及细胞因子在中枢神经系统病理情况下的作用的研究,已成为神经生物学和免疫生物学中又一活跃的热点。这类神经、内分泌和免疫系统共有配体的发现,为这些系统间的联系提供了又一物质基础。
中枢神经系统主要由神经元和神经胶质细胞组成,从所占体积来看,神经元和神经胶质细胞大致各占一半,但从细胞数量来看,神经胶质细胞几乎是神经元的10倍。目前发现的中枢神经系统内产生的细胞因子,主要来源于神经胶质细胞,其中又以星形胶质细胞和小胶质细胞占多数。神经胶质细胞充填于神经元之间,起到支持和营养神经元的作用,另外,具有吞噬、抗原提呈作用以及损伤后能发生增殖,起到修复损伤的作用。当胶质细胞受到外来刺激(如损伤、感染等)时,便可产生多种细胞因子。
IL-1主要来源于小胶质细胞,且发现脑内IL-1峰值与小胶质细胞出现的时间有明显的相关性。新生大鼠的星形胶质细胞在LPS刺激下,也可产生IL-1样活性物质。成年大鼠大脑皮质损伤时亦可促进胶质细胞产生IL-1。人脑海马区的神经纤维及大鼠大脑前皮质、海马、纹状体存在高密度的IL-1免疫活性物质。IL-1β样免疫反应性物质浓度最高的是室旁核、弓状核和正中隆起。
在正常人的白质和灰质中可以检测到IL-2及其受体,在多发性硬化症等神经性疾病的脑中检测到IL-2及其受体。正常大鼠脑中有低水平IL-2存在,并随育龄增大而提高,脑损伤后第10天,IL-2水平达到高峰,为正常的17倍。大鼠脑内几个不同脑区,IL-2免疫反应性和IL-2结合位点以海马最高。
从新生小鼠脑内胶质细胞的体外培养液中可分离到一种分子量为33的IL-3样物质,它能支持IL-3依赖细胞株32D细胞的生长,与T细胞来源的IL-3具有相同的生化特性和生物学活性。
胎脑胶质细胞体外培养,可自发分泌IL-6,LPS刺激可增加IL-6的产生。脑内IL-6 mRNA与免疫细胞来源一致。在垂体IL-6主要由腺垂体folliculo-stellate细胞产生,约2/3体外培养的垂体瘤可分泌、释放IL-6,它们往往是分泌激素的肿瘤。
LPS可诱导人星形胶质细胞表达TNF-αmRNA,产生TNF-α。实验性变态反应性脑脊髓炎(EAE)敏感大鼠的星形胶质细胞,在LPS诱导下能产生高水平的TNF-α,而EAE不敏感的则产生TNF-α的水平相对较低。
除上述细胞因子外,在脑内还发现有TNF-β、IFN(α、β、γ)、转化生长因子-β(TGF-β)、集落刺激因子(CSF)、白血病抑制因子(LIF)、神经生长因子(NGF)、血小板衍生生长因子(PDGF)等。
(三)神经、内分泌与免疫系统间相互作用的机制
1.通过共同的信息分子及相应受体构成神经-内分泌-免疫网络·综前所述,越来越多的证据表明,免疫系统与中枢神经系统间存在着双向调节作用。中枢神经系统通过自主神经对免疫器官、神经内分泌(神经递质、神经肽和激素对免疫细胞上的相应受体)两条途径对免疫系统进行调控,免疫系统则通过细胞因子、产生神经肽和激素两条途径作用于中枢神经系统。神经、内分泌和免疫系统间的相互作用是双向的,它们拥有一套共同的信息分子(神经肽、激素、细胞因子等)及其相应的受体,即共用的化学语言。这些信息分子可分别在神经、内分泌和免疫组织内合成和释放,与系统内或系统外的受体相结合,从而使得系统内或系统间得以呈网络状的联系和相互调节。此类事实提供了这些系统间信息交流、协调配合及相互渗透的物质基础。我们可以用一个简图来描述(图6-3)。
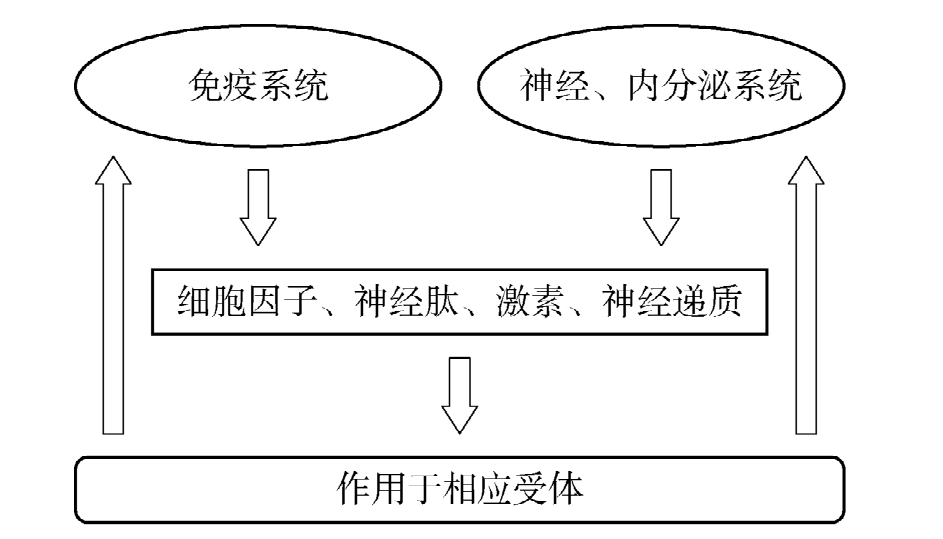
图6-3 神经、内分泌和免疫系统内及相互间联系模式(1)
(根据Blalock,1994改制)
2.通过信息分子的多功能位点与相应的不同受体相结合介导多样性功能·神经、内分泌与免疫系统间相互作用的机制,除了上述共用的化学语言以及共用配体与相应受体结合,是否还存在着其他机制?笔者认为神经、内分泌与免疫系统间的调节作用还存在一种信息分子的多功能位点及其多功能性机制。
(1)细胞因子的多功能位点和多功能性:细胞因子存在着多功能位点性且其结构上与神经肽和激素存在着相似性。细胞因子的多功能位点和多功能性是细胞因子对神经、内分泌系统调节作用的另一结构基础和可能的机制。
IL-2分子与内源性阿片肽(EOP)存在着结构的同源性和功能的交叉性。IL-2分子具有相互独立的免疫和镇痛功能位点,分别介导免疫和镇痛活性,其镇痛功能位点与EOP分子结构存在着相似性。ELISA检测显示,IL-2和四种抗EOP(β-EP、LEK、MEK和Dyn A1~13)之间存在着共同的抗原决定基。EOP分子一级结构的N端有一共同结构特征,即Tyr-×-×-Phe,其中芳香族氨基酸酪氨酸Tyr和苯丙氨酸Phe残基是镇痛作用所必需的。虽然从一级结构上分析,IL-2分子并没有Tyr-×-×-Phe序列,但从IL-2分子空间结构上分析,第45位Tyr残基附近区域恰好有44位和117位Phe残基以及107位Tyr残基。将IL-2的这些氨基酸残基分别进行突变,获得的4个IL-2突变体,仍然保留了很强的免疫学活性,但其镇痛能力显著下降或完全消失。人IL-2分子第45位Tyr残基以及空间结构上相近的44、107、117位等芳香族氨基酸残基是发挥镇痛作用的关键残基,这些残基通过空间折叠,形成类似与EOP分子N端的Tyr-×-×-Phe结构,组成IL-2的镇痛功能位点。
除IL-2外,其他细胞因子也存在着多功能位点性及其结构上与神经肽和激素存在着相似性。如IFN-α与EOP、ACTH存在着结构的同源性,在生物功能上亦有交叉。
细胞因子除与细胞因子本身受体结合外,还能与其他受体发生作用。
纳洛酮可以阻断IL-2的中枢和外周镇痛作用,而不能影响IL-2对CTLL-2细胞的增殖作用,提示IL-2的镇痛作用和免疫调节作用是通过不同的受体途径实现的,IL-2的镇痛作用与阿片受体有关。这存在着两种可能性:第一,IL-2首先与IL-2R结合,继发性引起EOP等水平的提高,EOP再和阿片受体结合,产生镇痛作用;第二,IL-2与阿片受体直接结合,产生镇痛作用。人IL-2分子第62位Glu、20位Asp以及126位Gln残基分别突变后,与IL-2Rα、β和γ亚基结合能力丧失,但这些IL-2突变体仍具有镇痛能力,说明IL-2的镇痛作用并不是由IL-2R所介导,可能是通过与阿片受体直接结合所介导。进一步通过竞争结合试验等表明,IL-2能与阿片受体发生特异性结合,并产生镇痛作用。
除IL-2可与阿片受体结合外,IFNα也可以与μ阿片受体结合。IL-1的致热和行为反应即是通过不同的受体机制所实现的。
细胞因子已被证实具有免疫调节和神经、内分泌调节等多种生物效应,具有多个功能位点或结构域,而且可以与不同受体或受体亚型相结合,产生相应生物效应。笔者推断,可能存在着这样一种机制,细胞因子上不同的功能位点或结构域与相应的不同受体结合后,产生多种生物学功能。细胞因子的多功能位点是其既有免疫调节又有神经、内分泌调节等多功能性的结构基础之一。
(2)神经介质的多功能位点和多功能性:细胞因子对神经、内分泌系统的调节作用存在着多功能位点和多功能性机制,神经、内分泌系统对免疫系统的调节过程中,作为小分子的神经肽或激素也存在这种现象。神经介质的多功能位点和多功能性亦是神经、内分泌系统对免疫系统调节作用的结构基础和另一可能模式。
β-内啡肽缺失N端的5个或17个氨基酸残基,其促进T淋巴细胞产生IL-2和IL-4的能力没有改变,结果表明β-内啡肽的N端并不参与这种免疫调节作用,但内源性阿片肽N端的4个氨基酸残基是其镇痛活性所必需,也说明β-内啡肽存在着产生镇痛作用和免疫调节作用的不同功能位点或结构域。
精氨酸加压素是一具有多种生物效应的九肽分子,其受体有V1和V2两种。精氨酸加压素与V1、V2受体结合通过不同的细胞内机制引起最终效应。V1受体介导血管收缩功能、免疫调节功能,而V2受体则介导抗利尿作用。不同受体已有特异性的激动剂和拮抗剂,推测构成与V1、V2受体结合的精氨酸加压素分子中特异性结合位点的氨基酸残基组成或结构可能是不一样的,即精氨酸加压素分子中存在着不同的特异性结合位点或功能位点,或者由于小分子多肽空间结构的随机性(如同蛇类扭曲游动但不能形成类似蛋白质的三级结构),由不同空间构型与相应的V1或V2受体相结合,产生不同的生物效应。
不少神经肽有类似精氨酸加压素的这种现象。因此进一步推测,神经介质的多功能位点和多功能性亦是神经、内分泌系统对免疫系统调节的一个可能模式。
笔者认为,神经、内分泌与免疫系统间相互联系、相互作用的结构基础之一,是这些系统共用配体的多功能位点性。细胞因子除了与细胞因子受体本身结合,还能与神经肽、激素等受体结合,反之亦然,从而构成了神经、内分泌系统与免疫系统间极为复杂的网络关系和相互调节作用(图6-4)。共用配体的多功能位点与不同受体相结合介导多样性功能,是神经、内分泌与免疫系统间相互联系、相互作用的一个分子生物学机制。
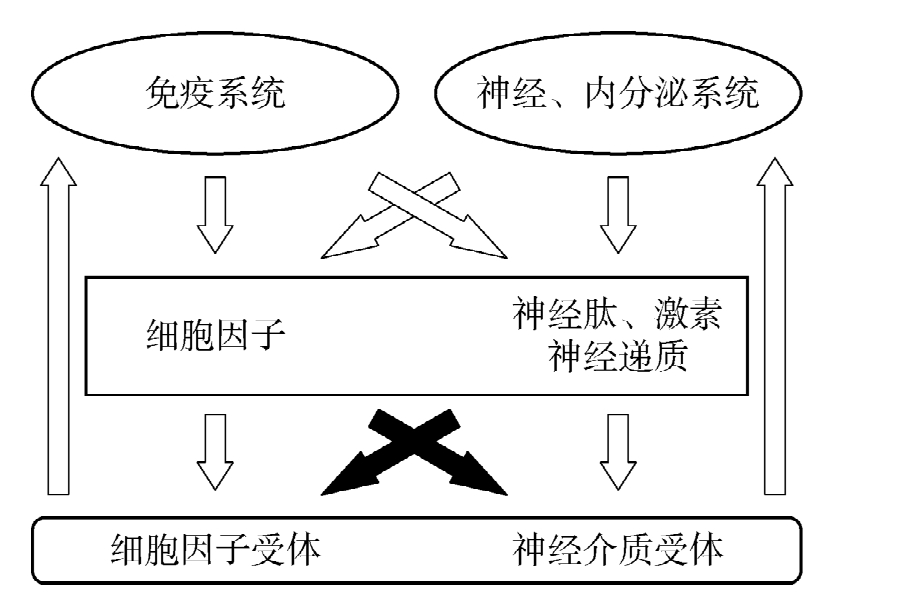
图6-4 神经、内分泌和免疫系统内及相互间联系模式(2)
(细胞因子、神经肽、激素和神经递质及其受体作为神经、内分泌与免疫系统共用的化学语言,免疫系统可以产生神经肽、激素和神经递质,神经、内分泌系统也可以产生细胞因子。神经、内分泌和免疫系统均存在着共用配体的受体,共用的配体可以交叉作用于相应的受体,构成极为复杂的神经、内分泌和免疫系统间的网络关系)
