国际上与药物安全性监测相关的重要组织
(一)乌普萨拉监测中心
乌普萨拉监测中心(Uppsala Monitoring Centre,UMC)的前身是成立于1970年的WHO药物监测中心(WHO Drug Monitoring Centre),1978年迁至瑞典东部城市乌普萨拉(Uppsala),更名为世界卫生组织国际药物监测合作中心(WHO Collaborating Centre for International Drug Monitoring),1997年再次更名并调整了内部组织结构,UMC的名字沿用至今。其最初目标是发现临床试验阶段未能发现的罕见药物不良反应,主要监测预防、诊断、治疗或调节生理功能的药品在正常用法用量下出现的有害的非预期不良反应,目前监测范围已扩大到药物警戒,即监测所有可能影响药物安全性的因素,包括超剂量服用、滥用、错用等所致的不良反应。该中心拥有一个国际性的药物不良反应数据库,其数据来自世界各国监测中心提供的药物不良反应报告。全球大多数国家的药物不良反应监测中心均与该数据库通过电子入口连接,沟通极迅速。UMC和WHO国际药物监测规划(WHO International Drug Monitoring Programme)正在联合促进和鼓励更有效的信息交流,截至2005年9月,全球已有75个国家先后参加该规划,UMC已收到来自各成员国的药物监测报表300余万份,这些报表已成为了解和评价药物安全性的重要依据之一。UMC还制订了统一的报告标准,便于国与国之间交流。1998年,UMC建立了一个高级的贝叶斯可信传播中枢网络(a sophisticated bayesian confidence propagation neural network,BCPNN),可使信号检测系统达到部分自动化,比既往方法更早地提供警戒信号,并成立了一个由临床专家组成的国际顾问小组,负责确定在每份报告中出现的信号是否确实和有价值。近几年,UMC拓展了它的作用,使之成为药物安全信息的交流、交换和培训中心;此外,还将建立一个草药(植物药)和传统药监测系统,将进一步突出药物管理的重要性。UMC在与众多国家一起工作中正起到更先进、更积极的作用,在超国界专家组主持下,使之对与药物安全性相关的国际性重要问题进行评估成为可能。
(二)国际医学科学组织委员会
国际医学科学组织委员会(Council for International Organizations of Medical Sciences,CIOMS)是由WHO和联合国教科文组织于1949年建立的非营利性国际组织,其主要工作目标为发起和促进生物医学领域的国际活动,保持与联合国及其分支机构的合作关系,并为国际生物医学团体的学术研究和科学利益服务。该组织于1987年建立药物不良反应报告制度,自1990年共制订了8种规范性文件。其整个报告体系从药物不良反应定义、报告表设计及工作程序与WHO国际药物监测规划均有所区别,不仅收集具一定因果关系的药物不良反应(adverse drug reaction)和无明显因果关系的药物不良反应事件(adverse drug event,ADE),还收集正常用法用量下的药物不良反应和超剂量用药、药物误用、药物滥用情况下的药物不良反应。其中主要收集严重、新发的药物不良反应,对其他药物的药物不良事件,只作一般性要求。CIOMS还规定制药企业进行报告,强调药物与药物不良事件之间的因果关系分析,如药物流行病学调查研究,还主张强化对药品进行综合性评价和利弊权衡。
(三)人用药品注册技术要求国际协调会
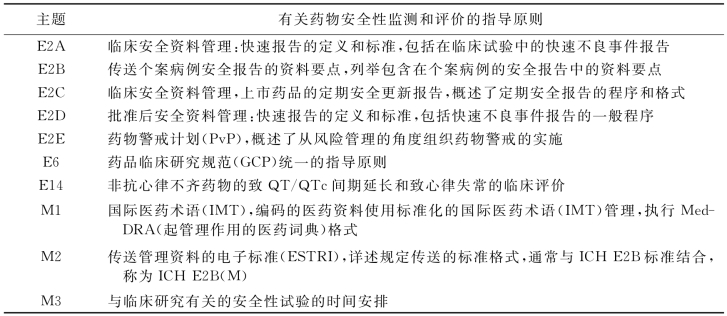
人用药品注册技术要求国际协调会(Internationl Conference on Harmonization,ICH)是由欧盟、美国和日本三方的药品注册和工业部门组成,主要任务是协调三方在药品注册时的一些共同的规范性文件,以便数据共享和相互认可。目前在已形成的56个规范性文件中,有21个文件涉及ADR/ADE,其中编号E2A、E2B、E2C、E2D、E2E、E6、E14、M1、M2、M3等文件(表3-1),均涉及药品安全性评价和术语等。其对严重ADR/ADE、快速报告等概念及程序均作出了要求。ICH代表先进的管理理念,对世界各国产生着较大影响。ICH对于药品注册的国际技术要求,大多来自CIOMS工作组的建议;其大量工作得到了WHO的认可,WHO对所有ICH成员国都派驻了观察员。
表3-1 ICH与药物安全性监测和评价有关的指导原则
(四)人用药委员会
人用药委员会(Committees for Human Medicinal Products,CHMP)隶属于欧洲药品局,前身为1975年成立的欧洲专利药品委员会(Committee for Proprietary Medicinal Products,CPMP),承担着欧盟药物警戒的职责。其主要目标之一是为患者、医务人员提供更完善的关于药品使用的正确信息,以达成促进公众健康的最终目的。CHMP在药物警戒工作组(Ph-VWP)的协助下,对向欧洲药品局申请上市许可授权的药物进行评估,形成一致意见,并最终出具评估报告。对已获得集中授权上市许可的药品,当出现新的药物安全性问题,CHMP也负责对新的证据进行评估,并形成最终意见。
(五)国际药物流行病学会
国际药物流行病学会(International Society for Pharmacoepidemiology,ISPE)是一个致力于发展药物流行病学的国际性非赢利组织。ISPE努力营造公正、科学的学术交流氛围。ISPE的人员来自药学各领域,行业包括制药工业、学院研究所、政府机构、赢利或非赢利机构团体。学科涉及流行病学、生物统计学、医学、兽医科学、护理学、药理学、医院药学、医学经济学和新闻业。成员分布53个国家。ISPE努力做到在全球范围内共享药物流行病学的知识和进展。目前,ISPE在因特网上设立了学会网站(http://www.pharmacoepi.org/index.shtml),提供药物流行病学学会工作和其他相关工作信息。
(六)国际药物警戒协会
国际药物警戒协会(International Society of Pharmacovigilance,ISOP)是一个最初由欧洲发起的国际性组织,成立的主要目的在于对药物警戒的科学概念、方法进行探讨,对临床医生、医学院学生进行药物不良反应知识的培训,提高公众对不良反应的认识,任何国家、企业、组织、团体及对药品不良反应关心的个人都可以参加。到目前为止,其成员已覆盖到5个洲的40个国家。ISOP从1993年起每年召开一次年会,会议上除开展培训外,还就一些热门话题和共同关心的问题进行讨论。
(七)欧洲药物警戒研究集团
欧洲药物警戒研究集团(Europe Pharmacovigilance Research Group,EPRG)由12个成员国的学术机构和药品监管机构组成,主要宗旨是在欧盟范围内发展新的药物警戒方法,承担公众健康领域特定药物警戒的课题研究。到目前为止,EPRG所承担的方法学研究主要包括进行欧盟范围内自发报告系统的调查;发展对观测到的资料进行系统性总结的分析方法;定量识别药物警戒信息的方法;以及发现罕见、严重药物不良反应事件的小规模病例监测方法等。
