如何填写药品不良反应/事件报告表
(一)国家制式纸质/电子报告表
国家现行的制式纸质报告表和电子报告表结构基本一致,关键信息项目多为主观填写,数据质量较难控制,院内ADR收集评价员的处理核实工作量大。基于这种状况,本节拟从一线报告人角度,以问答(QA)的形式对报告表填写的注意事项进行说明,为医疗机构ADR监测专兼职人员指导报告人正确填报提供参考(图5-7)。
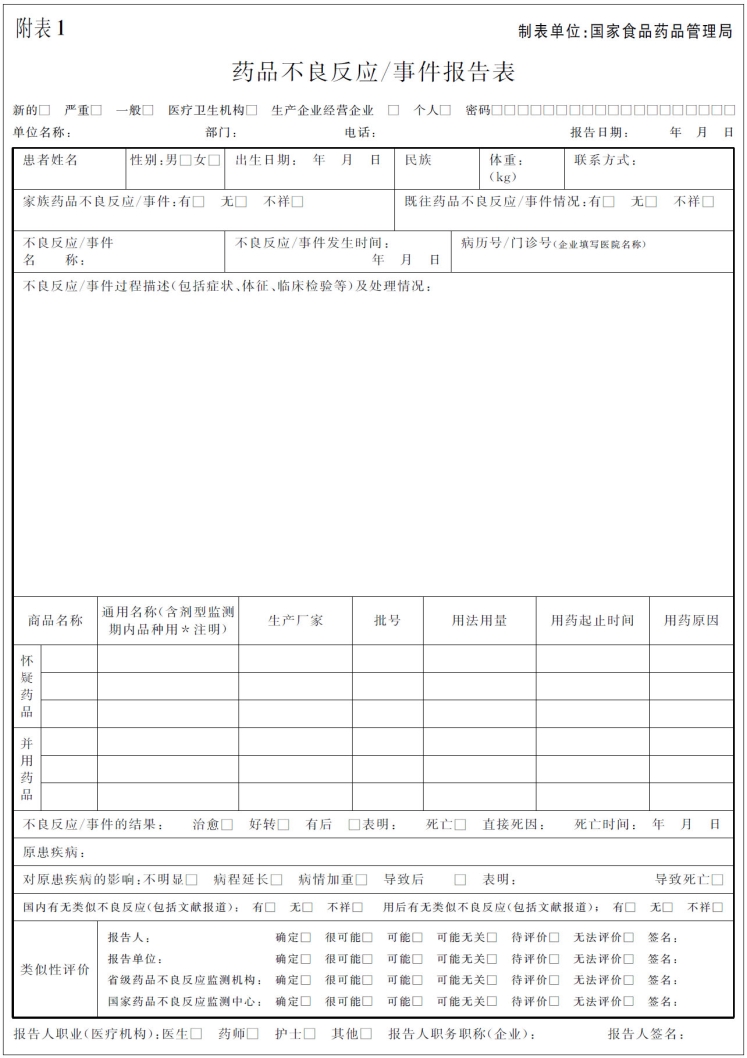

图5-7 药物不良反应/事件报告表(正、反两面)
1.填写报告表的基本要求 一份填报较好的ADR/ADE报告内容应包括事件(不良反应)的发生、发展的大体完整过程,即不良反应表现、动态变化、持续时间、相关治疗和有关的实验室辅助检查结果;要能反应出事件的时间联系、病程进展、合并用药、既往病史、撤药和再次用药及其他混杂因素。
填写药品不良反应的表现过程既要简明扼要,又要包括整个反应过程的动态变化,同时注意使用规范的医学术语。表格中所提供的内容,必须达到足以使评价人对该报告进行药源性疾病的诊断和鉴别诊断,才是填写合格的报表。
2.纸质报告表需要填写项目分为反正两面 国家制式《药品不良反应/事件报告表》可大致分为报表整体情况、患者基本情况、ADR信息、药品信息及ADR综合分析/关联性评价五部分。按国家要求,报告表中所列项目均为必填项,无法获得的内容可填写“不详”。
(1)报表整体情况:勾选报表上报类型(新的、严重的、一般的)、报告来源、报告单位信息(单位、部门、电话)、报告日期、报告人职业、报告人签名。
(2)患者基本情况:患者姓名、性别、出生日期、民族、体重、联系方式、家族/既往ADR史、病历号/门诊号、原患疾病。
(3)ADR信息:不良反应名称、不良反应发生时间、不良反应/事件过程描述、不良反应结果。
(4)药品信息:商品名、通用名(含剂型)、生产厂家、批号、用法用量、用药起止时间、用药原因。
(5)ADR综合分析/关联性评价:对原患疾病的影响、国内/外有无类似ADR、报告人关联性评价、不良反应分析5项(反面)、严重ADR/ADE情形选择(反面,严重报告填写)。
3.怎样认定要报告的事件是新的、严重的或一般的 按国家规定,新的是指药品说明书未载明的ADR。严重的是指因服用药品引起以下损害情形之一的反应:引起死亡;致癌、致畸、致出生缺陷;对生命有危险或能够导致人体永久的或显著的伤残;对器官功能产生永久损伤;导致住院或住院时间延长。
但此处填表人医学背景和专业水平不一,可根据个人理解和实际情况选择,如填表人认为事件是非预期的,即可勾选“新的”,以自身理解水平认为是给患者造成较大伤害,即可选定“严重的”,之后交由院级评价员复核校正。
4.如果是怀疑与药品有关的妊娠异常或出生缺陷的病例,患者姓名和不良反应发生时间怎么填写
(1)关于患者姓名:①当女性患者妊娠期间使用药物,且胎儿状态异常时,建立一个母亲病例并建立一个与母亲病例关联的胎儿病例,且ADR名称中适包括先天的、新生的、胎儿的等术语;②当一位男性患者使用药物时其女性伴侣妊娠,且胎儿状态异常时,建立一个父亲的病例,关联一个母亲和一个胎儿的病例;③分娩期并发症,即使与药物没有时间上的关联,也应该当作一个可疑药品不良事件,患者姓名是产妇。
(2)关于ADR发生时间:①当一个新生儿被发现有出生缺陷,发生时间就是该婴儿的出生日期;②当一个胎儿因为先天缺陷而发生早产或流产时,发生时间就是结束、终止妊娠的时间,也是孕妇不良反应出现结果的时间。
5.如果不良事件患者在院外用药,很多信息不详,怎样填表 应尽可能多的填写项目,其中必填项为患者姓名、患者联系方式、不良事件名称、不良事件发生时间、怀疑药品名称(最好提供通用名和厂家)、用药剂量、用药起止时间、院外就诊/购药单位、原患疾病、不良反应结果、报告人、报告人联系方式,并在报表(正面)底处注明“本例报告为院外用药”。
6.不良反应/事件名称一栏是填写症状、体征还是诊断
(1)如果没有作出诊断,就只能以症状作为首选ADR名称,不能假定诊断。
(2)如果有诊断,则以诊断作为首选ADR名称,不用单个的症状/体征。
【案例】 某患者服用药物A后出现黄疸、手掌瘙痒及肝炎。报告术语选择:肝炎。
(3)当有多个初步诊断时,只选择症状作为ADR名称。
【案例】 某患者使用药物B后出现呼吸困难,您认为呼吸困难可能是由充血性心力衰竭、肺栓塞或心肌梗死所致。报告术语选择:呼吸困难。
(4)当不良事件导致的结果/并发症与事件本身代表不同的医学概念,且能够对事件起到补充作用时,结果/并发症也应选入ADR名称。
案例:某患者使用药物A后出现上消化道出血及出血性休克。报告术语选择:上消化道出血和出血性休克。
(5)2个或2个以上的ADR名称,医学重要性较强的应置于首位;如具有同等医学重要性,则未预期ADR置于首位。
(6)根据报告者的医学判断填写能恰当描述事件的词语(一组症状时填写患者最突出的主诉症状)。
(7)如果报告者熟悉WHO-ART和MedDRA术语,请尽量选择。
7.不良事件的结果是死亡时,不良反应名称一栏的填写 死亡不作为一个ADR名称,只作为一种结果(猝死、胎儿或新生儿死亡除外),死亡病例的ADR名称尽可能选取描述主要死因的术语,而不是立即导致的死因。
【案例】 患者使用某药物后出现败血症,继发多器官衰竭,死亡。不良反应名称选择:致命性败血症。
8.不良反应/事件过程描述及处理情况应填写要点 应体现出3个时间、3个项目和2个尽可能。
(1)3个时间:①不良反应发生的时间;②采取措施干预不良反应的时间;③不良反应终结的时间。
(2)3个项目:①第一次药品不良反应出现时的相关症状、体征和相关检查;②药品不良反应动态变化的相关症状、体征和相关检查;③发生药品不良反应后采取的干预措施结果。
(3)2个尽可能:①不良反应/事件的表现填写时要尽可能明确、具体。如为过敏型皮疹,要填写皮疹的类型、性质、部位、面积大小等;如为心律失常,要填写何种心律失常;如为上消化道出血,有呕血者需估计呕血量的多少等;严重病例应注意生命体征指标(体温、血压、脉搏、呼吸)的记录。②与可疑不良反应/事件有关的辅助检查结果要尽可能明确填写。
如怀疑某药引起血小板减少症,应填写患者用药前的血小板计数情况及用药后的变化情况;如怀疑某药引起药物性肝损害,应填写用药前后的肝功变化情况,同时要填写肝炎病毒学检验结果,所有检查要注明检查日期。
9.原患疾病一栏是指既往病史还是入院诊断 原患疾病最好填写既往病史和现病史主要诊断,而不是只填写入院诊断或某次用药原因。
10.在使用怀疑药品过程中,如果改变了剂量或疗程时用药起止时间的填写 用药起止时间是指使用药品的同一剂量的开始时间和停止时间。如果用药过程中改变剂量应另行填写该剂量的用药起止时间,并予以注明。
11.使用怀疑药品不足1天时,用药起止时间的填写 如果使用某种药品不足1天,需注明用药的持续时间。
【案例】 肌内注射后或静脉滴注多长时间出现不良反应。
12.报告表中的并用药品具体所指范围及确定 患者同时使用的其他药品,即报告人认为这些药品与不良反应发生关系不明确。此外,可提供药品之间的相互作用线索,或者提供导致ADR的其他不利原因,注意其他药品不要遗忘非处方药、避孕药、中草药、减肥药等。
并用药品的信息可能提供以前不知道的药品之间的相互作用的线索,或者可以提供不良反应的另外的解释,如药品不良相互作用导致的ADR。
13.不良反应的结果选择
(1)是指本次不良反应经采取相应的医疗措施后的结果不是指原患疾病的结局。如患者的不良反应已经痊愈,后来又死于原患疾病或与不良反应无关的并发症,此栏仍应填“治愈”。
(2)不良反应经治疗后明显减轻,在填写报告表时没有痊愈,但是经过一段时间可以痊愈时,选择“好转”。
(3)不良反应经治疗后,未能痊愈而留有后遗症时,应注明后遗症的表现。后遗症即永久的或长期的生理功能障碍,应具体填写其临床表现,注意不应将恢复期或恢复阶段的某些症状视为后遗症。因疾病导致机体组织器官功能明显障碍,且持续半年以上未愈称为后遗症。
14.如果患者最终死亡,对原患疾病的影响是否填写死亡 患者出现死亡结局时,应注明死亡时间并进行死因分析;是原患疾病导致死亡,还是ADR导致,在分析基础上作出选择。
15.药品批号不详时的处理 因为不良反应作为一种结果滞后发生,药品包装可能丢弃,请报告人填写最近从药房领取/获得药品的时间,以方便追溯,另外,此处注意别把产品批号写成药品批准文号,如“国药准字H********”或“国家准字Z********”。
16.不良反应/事件分析及关联性评价的填写 不良反应/事件分析共五项,其中第三、四两项(去激发和再激发)应由报告人根据实际情况来选择,其余判断不明可由评价人员填写复核。
17.严重报告,后续事件的补充报告 请在报告底部写明初报告的怀疑药品、不良事件名称及报告日期。
ADR过程描述及处理情况示例
【案例一】 患者因败血症静脉滴注万古霉素(1g,2/d),6月5日(发生ADR时间)患者尿量明显减少,300ml/d。急查肾功能Cr 440μmol/L,BUN 21.6mmol/L(第一次ADR出现时的相关症状、体征和相关检查)。患者用药前肾功能及尿量均正常。立即(干预时间)停用万古霉素(采取的干预措施)。停药后患者尿量逐渐增多,至6月10日(终结时间)尿量恢复复正常。6月11日复查肾功能:Cr 138μmol/L,BUN 7.2mmol/L(采取干预措施之后的结果)。
【案例二】 患者因真菌性败血症(热带念珠菌)用5%葡萄糖溶液+两性霉素B脂质体25mg缓慢静脉滴注,于13:15结束。13:20(发生ADR时间)出现寒战,心率增至160/min,BP160/106mmHg,呼吸加至40/min(第一次ADR出现时的相关症状、体征和相关检查)。立即(干预时间)给予异丙嗪25mg肌内注射,地西泮、吗啡静脉注射(采取的干预措施)。于14:00(终结时间)上述症状缓解(采取干预措施之后的结果)。
【案例三】 患者因衣原体尿路感染于1月27日予注射用阿奇霉素0.5g qd,当天10:00静脉滴注完该药后,出现轻微药疹,未做处理。28日患者早上静脉滴注完该药后颈部、胸、大腿出现散在红色丘疹,瘙痒,予氯苯那敏4mg口服,下午症状缓解。29日患者早上静脉滴注完该药后使用后再次出现红色丘疹,遍及全身,瘙痒(不良反应动态变化)。立即给予给予异丙嗪25mg肌内注射,氯苯那敏4mg,3/d,并停止使用阿奇霉素。于2月1日皮肤基本恢复正常。
(二)军队医疗机构制式电子报告表
军队ADR监测管理系统的电子版《药品不良反应/事件报告表》对制式报表结构进行了报告项目模块化的规整,分为患者信息、ADR信息、药品信息、报告人信息4部分。并采用分层设计,对报告人和评价人填写项目进行归类区分,分别填写。强化报告人作为发现者的现场填报要素,弱化了其评价项目,此外,电子报告具有结构引导式填报,必填项审查(患者姓名、ID号、药品名称、不良事件名称、报告人姓名、联系方式)、格式审查、逻辑审查和标准化审查,力求通过计算机辅助让报告人做到概念清晰的简明填报。
1.填写时注意先输入ID(病历号)/住院号即可实现患者和药品信息自动提取,有助于简化填报过程。
2.药品不良事件信息栏为引导式填报,已列出报告关键点,须注意的是对于严重的报告在不良反应表现一栏要填写重要实验室数据的动态变化值。
