我国药品不良反应监测组织体系
我国的药品不良反应监测工作由国家食品药品监督管理局(SFDA)主管,省、自治区、直辖市(食品)药品监督主管部门主管本行政区域内的药品不良反应监测工作,各级卫生主管部门负责医疗卫生机构中与实施药品不良反应监测制度有关的管理工作。我国的药品不良反应监测专业技术机构由国家药品不良反应监测中心,各省、自治区、直辖市药品不良反应监测中心及基层监测机构组成,各级药品不良反应监测协调领导小组和专家咨询委员会也是我国药品不良反应监测体系的重要组成部分。我国药品不良反应监测工作的组织结构见图3-1。
(一)各级(食品)药品监督管理机构
1.SFDA 负责全国药品不良反应监测管理工作并履行以下主要职责:①会同卫生部制订药品不良反应的管理规章和政策,并监督管理实施;②通报全国药品不良反应报告和监测情况;③组织检查药品生产、经营企业的药品不良反应报告和监测工作的开展情况;④对突发、群发、影响较大并造成严重后果的药品不良反应组织调查、确认和处理;⑤对已确认发生严重不良反应的药品,SFDA可以采取紧急控制措施,并依法做出行政处理决定;⑥对违反有关规定的药品生产、经营企业和除医疗机构外的药品使用单位执行相应处罚,对医疗卫生机构违反有关规定的,移交卫生部进行处理。
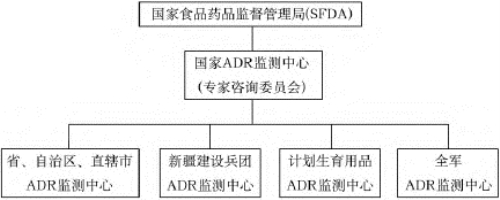
图3-1 我国药品不良反应监测工作的组织结构图
2.省、自治区、直辖市(食品)药品监督管理局 负责本行政区域内药品不良反应监测管理工作,并履行以下主要职责:①会同同级卫生主管部门制订本行政区域内药品不良反应报告及管理规定,并监督实施;②会同同级卫生主管部门组织本行政区域内药品不良反应报告和监测的宣传、教育、培训工作;③负责本行政区域内药品不良反应监测专业机构的设置;④组织检查本行政区域内药品生产、经营企业的药品不良反应报告和监测工作的开展情况;⑤对本行政区域内发生的药品严重不良反应组织调查、确认和处理;⑥对本行政区域内发生的群体不良反应立即会同同级卫生厅(局)组织调查核实,并向SFDA、卫生部和国家药品不良反应监测中心报告;⑦对在本行政区域内已确认发生严重不良反应的药品,采取紧急控制措施,并依法做出行政处理决定;⑧对违反有关规定的药品生产、经营企业和除医疗机构外的药品使用单位执行相应的处罚,对医疗卫生机构违反有关规定的,移交同级卫生主管部门进行处理。
3.县以上(食品)药品监督管理局派出机构 主要职责:①会同同级卫生主管部门监督实施本行政区域内药品不良反应报告和监测管理规定;②组织检查本行政区域内的药品生产、经营企业的药品不良反应报告和监测工作的开展情况;③参与本行政区域内发生的药品严重/群体不良反应组织调查、上报;④组织本行政区域内药品不良反应报告和监测的宣传、教育、培训工作。(https://www.daowen.com)
(二)各级卫生主管部门
1.卫生部主要职责 ①协同SFDA制订药品不良反应报告的管理规章和政策;②负责全国医疗卫生机构中与实施药品不良反应报告制度有关的管理工作;③在职责范围内,依法对已确认的药品不良反应采取相关的紧急措施;④对SFDA移交的违反有关规定的医疗卫生机构进行处理。
2.县以上各级卫生主管部门主要职责 ①协同同级(食品)药品监督管理部门监督实施本行政区域内药品不良反应报告和监测管理规定;②协同同级(食品)药品监督管理部门组织药品不良反应报告和监测的宣传、教育、培训工作;③负责本行政区域内医疗卫生机构中与实施药品不良反应报告制度有关的管理工作;④在职责范围内,依法对本行政区域内已确认的药品不良反应采取相关的紧急措施;⑤对同级(食品)药品监督管理部门移交的本行政区域内违反有关规定的医疗卫生机构进行处理。
(三)药品不良反应监测工作协调领导小组
各级(食品)药品监督管理局和卫生厅(局)联合成立药品不良反应监测工作协调领导小组,其人员由相关领导组成。其主要职责为:①组织落实SFDA、卫生部有关药品不良反应监测工作任务;②协调本行政区域内药品不良反应报告和监测工作重要事宜;③每年召开工作会议,审议工作报告,研究、协调、解决存在的问题等。
