药品不良反应报告的关联性评价技术标准
药品不良反应因果关系的评价是ADR监测工作的重要内容,其评价信号的可靠程度非常重要,应当是在分析报表相关资料、借助参考文献的基础上做出的综合性评价。ADR的表现叙述过于简单、怀疑引起ADR药品及其他信息资料欠缺者,都将直接影响评价结果。概括来讲,ADR因果关系评价准则主要从4个方面考虑。
1.时间方面的联系 即报表不良反应分析栏中“用药与不良反应的出现有无合理的时间关系”。除了先因后果这个先决条件外,原因与结果的间隔时间也应符合已知的规律,如氰化物中毒死亡仅需几秒;青霉素引起的过敏性休克或死亡在用药后几分钟至几小时发生;吩噻嗪类引发肝损害一般为服药3~4周或以后出现。另外还应注意,先因后果的先后关系不等于因果关系,而因果关系必须有先后关系。
2.是否为已知的ADR 与现有资料(或生物学上的合理性)是否一致,即从其他相关文献中已知的观点看因果关系的合理性,如动物实验的数据、病理生理学的理论、其他有关问题的研究成果等;另外以往是否已有对该药反应的报道和评述(即相当于报表不良反应分析栏中“反应是否符合该药已知的不良反应类型”)。
3.去激发和再激发 即发生事件后撤药的结果和再用药的后果(相当于报表不良反应栏中停药或减量后反应是否消失或减轻,以及再次用药是否再次出现同样的反应)。
4.有否其他原因或混杂因素 如并用药物、原患疾病及其他治疗的影响等。(https://www.daowen.com)
依据上述评价准则,我国《药品不良反应报告和监测管理办法》规定统一使用的制式报表中,将药品不良反应/事件的关联性评价结果分为肯定、很可能、可能、可能无关、待评价、无法评价6级(表5-2),需要具体掌握的分级要点如下。
(1)肯定:用药及反应发生时间顺序合理;停药以后反应停止,或迅速减轻或好转(根据机体免疫状态某些ADR反应可出现在停药数天以后);再次使用,反应再现,并可能明显加重(即再激发试验阳性);同时有文献资料佐证;并已排除原患疾病等其他混杂因素影响。
(2)很可能:无重复用药史,余同“肯定”,或虽然有合并用药,但基本可排除合并用药导致反应发生的可能性。
(3)可能:用药与反应发生时间关系密切,同时有文献资料佐证;但引发ADR的药品不止一种,或原患疾病病情进展因素不能除外。
(4)可能无关:ADR与用药时间相关性不密切,反应表现与该药已知ADR不相吻合,原患疾病发展同样可能有类似的临床表现。
(5)待评价:报表内容填写不齐全,等待补充后再评价,或因果关系难以定论,缺乏文献资料佐证。
(6)无法评价:报表缺项太多,因果关系难以定论,资料又无法补充。
表5-2 药品不良反应因果关系评价表
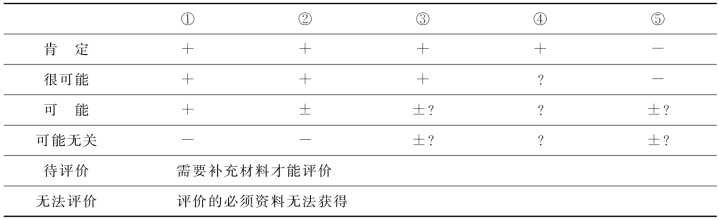
①用药与不良反应/事件的出现有无合理的时间关系;②反应是否符合该药已知的不良反应类型;③停药或减量后,反应是否消失或减轻;④再次使用可疑药品是否再次出现同样反应/事件;⑤反应/事件是否可用并用药的作用、患者病情的进展、其他治疗的影响来解释;+.表示肯定;-.表示否定;±.表示难以肯定或否定;?.表示不明
(马 亮)
