二、组织机构建设
1998年,我国组建了国家药品监督管理局,并于2003年成立国家食品药品监督管理局,负责对药品(包括中药材、中药饮片、中成药、化学原料药及其制剂、抗生素、生化药品、放射性药品、血清、疫苗、血液制品和诊断药品等)以及医疗器械的研究、生产、流通、使用等进行行政监督和技术监督。截至2007年底,全国有药品监管行政机构2692个,其中,省级药品监管行政机构31个,市(地)级药品监管行政机构339个,县(市)级(含直辖市区县)药品监管行政机构2321个。建立药品监管技术监督机构1000余个。全国共有监管人员6.4万人。2008年,按照《国务院机构改革方案》,国家食品药品监督管理局改由卫生部管理,进一步理顺了医疗管理和药品管理的关系。目前,我国已建成了中央政府统一领导、省以下垂直管理的药品监管行政机构。
国家不断加大药品安全监管的财政投入,重点提高药品安全检验检测能力和水平,为药品安全监管工作提供技术支撑。国家级药品技术监督机构主要包括国家食品药品监督管理局下属的中国药品生物制品检定所、国家药典委员会、药品审评中心、药品认证管理中心、国家中药品种保护审评委员会、药品评价中心、国家药品不良反应监测中心、医疗器械技术审评中心等。这些机构重点承担日常检验检测、检验技术方法研究、实验动物保种、标准化研究、注册申请技术审评、药品不良反应监测等工作。此外,还有19个国家口岸药检所承担进口药品的注册检验和口岸检验,33个省级药品检验所负责辖区内药品抽验、复验、委托检验、药品注册复核检验、国家计划抽验及国家药品标准起草等工作,325个地市药品检验机构负责辖区内药品抽验和委托检验。
目前,我国可生产原料药1500种,且多个药物品种产量位居世界第一。一批植物药和天然药物,已经在国内大量生产和广泛应用。抗生素、维生素、激素、解热镇痛药、氨基酸、生物碱等产品在国际医药市场上占有相当的份额。我国生产的青蒿素产品,在国际上被广泛使用,为防治疟疾作出了重要贡献。现今我国可以生产预防26种病毒、病菌感染的41种疫苗,年产量超过10亿个剂量单位,其中,用于预防乙肝、脊髓灰质炎、麻疹、百日咳、白喉、破伤风等常见传染病的疫苗产量达5亿人份。国产疫苗在满足国内居民防病需求的同时,已开始向世界卫生组织提供,用于其他国家的疾病预防。截至2007年底,我国共有药品生产企业6913家,其中原料药和制剂生产企业4682家。
药品监管部门积极探索推进药品再评价工作,对部分上市后品种开展安全性观察试验试点和回顾性分析调查。通过评价分析,修改了葛根素注射液、穿琥宁注射液、莲必治注射液等品种的说明书,取消了关木通药用标准,取消了乙双吗啉的生产许可,对一些品种采取了暂停销售使用的措施。国家不断加大对已上市药品的质量监督抽验力度,促进药品质量安全水平稳步提高。2007年,国家对中成药、化学药品、生物制品等开展了评价性抽验,共抽验13595批次,总体合格率为98.0%。其中,化学药品抽验7398批次,合格率为98.0%;抗生素抽验2586批次,合格率为98.1%;中成药抽验3611批次,合格率为97.6%。流感疫苗的抽验合格率,连续2年为100%。对抽验不合格的药品、医疗器械,药品监管部门采取了责令召回、撤市以及行政控制等措施,依法进行处理。同时,国家采取一系列措施严厉打击制售假冒伪劣药品行为,确保公众用药安全。
上海市食品药品监督管理局从2002年起,对药品质量抽查的机制进行了改革,经过6年的探索与实践,取得了明显成效(图7-1,图7-2)。(https://www.daowen.com)
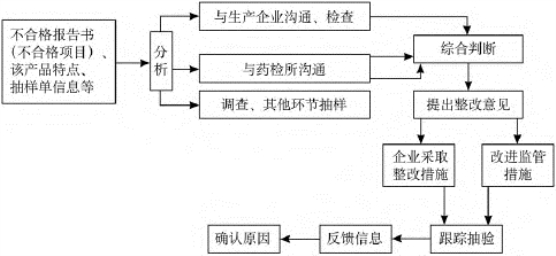
图7-1 上海市探索提高监督性抽查有效性的模式图

图7-2 上海市药品不合格原因分析方法示意图
国务院新闻办公室2008年7月18日发表《中国的药品安全监管状况》白皮书,对药品安全监管的政策措施进行了详细论述。我国从国情出发,借鉴国际先进经验,围绕提高药品安全性、有效性和质量可控性,制订政策措施,建立了涵盖药品研究、生产、流通、使用各环节的重要监管制度。
