围手术期意外和并发症
急性上呼吸道感染的病理生理改变主要表现在呼吸道分泌物增多和气道高反应性。尽管大多数上呼吸道感染(URI)属自限性疾病,但呼吸道感染后可以处于高反应性状态,并持续4~6 周[16],呼吸道阻力增高可持续达5 周。
合并上呼吸道感染时,气道处于高反应性,迷走神经兴奋性升高,围手术期的物理因素如插管刺激、拔管刺激、冷热变化、吸入刺激性气体等均可引起反射性咳嗽、支气管平滑肌收缩和分泌物增多。此外,上呼吸道感染还可以显著削弱呼吸道对细菌感染的抵抗力,从而容易使呼吸道继发急性化脓性感染,或使原有呼吸系统疾病加重[17-19]。
系列研究已经表明呼吸道感染是小儿麻醉中发生呼吸道并发症的危险因素。Parnis SJ等[20]通过分析2 051 例手术患儿的麻醉后指出,父母等监护人提供的“感冒”病史、咳痰、鼻黏膜充血都是预测麻醉风险的因素;Tait AR 等[16]分析了1 078 例小儿(年龄为1 月龄至18 岁)不同手术的呼吸道并发症相关危险因素,结果显示,正在或近期(4 周内)患有上呼吸道感染的患儿的意外事件如屏气、低氧血症(Sp02<90%)、严重呛咳等并发症的发生率明显高于非感染患儿。上述研究还表明,能预测活动期上呼吸道感染患儿呼吸道意外的独立危险因素有<5 岁且使用气管插管、早产儿(胎龄<37 周)、反复感染病史、父母有吸烟习惯、涉及呼吸道的手术、多痰和鼻黏膜充血。
据统计分析,患者术前有呼吸系统感染则术后呼吸系统并发症的发生率可较无感染者高出4 倍;另外,Cohen MM 等在一项前瞻性研究中纳入了1 283 例合并近期上呼吸道感染的患儿及20 876 例无上呼吸道感染症状的小儿,结果发现有上呼吸道感染症状的患者的呼吸道并发症是无症状者的2~7 倍,如果行气管插管,则升至11 倍[21]。
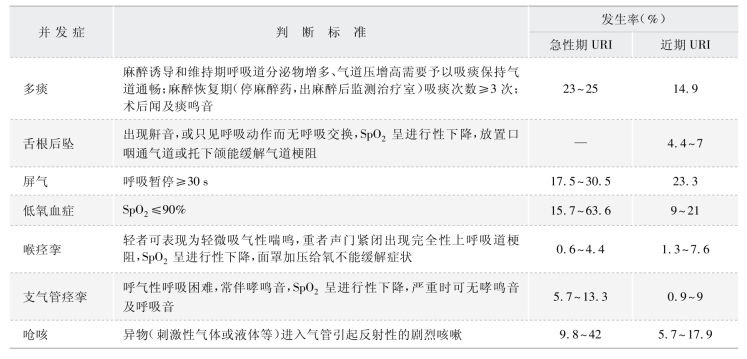
上呼吸道感染患儿手术中的呼吸系统不良事件包括喉和支气管痉挛、气道梗阻、屏气、呛咳、低氧血症、拔管后喉炎甚至肺不张等,近期有上呼吸道感染病史的患者在全麻期间发生各类并发症的概率明显升高,且处于上呼吸道感染的急性期和康复期(2 周之内)的患者,其围手术期各类呼吸道并发症的发生率存在较大的差异(表1-1-3)。
表1-1-3 急性上呼吸道感染围手术期并发症及发生率
 (https://www.daowen.com)
(https://www.daowen.com)
其他呼吸道并发症,如多痰、舌根后坠、咽喉痛等在合并上呼吸道感染的患者中的发生率都比较高。目前已有不少相关的临床研究,由于篇幅限制,本文以围手术期喉痉挛和呛咳为例,列举部分上呼吸道感染患者围手术期喉痉挛和呛咳发生率的相关研究,仅供读者参考(表1-1-4)。
表1-1-4 部分上呼吸道感染围手术期喉痉挛和呛咳发生率相关研究汇总
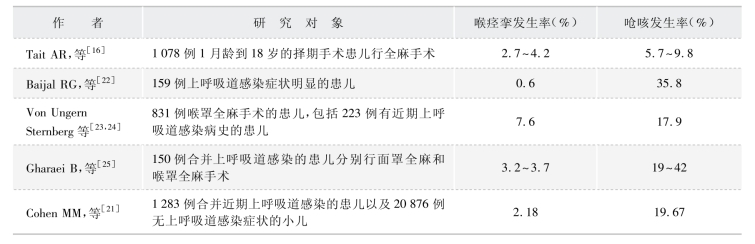
喉痉挛和支气管痉挛是围手术期最严重的并发症之一,Tait AR 等研究了1 078 例1 月龄到18 岁的择期手术患儿行全麻手术的相关临床资料,发现近期有上呼吸道感染病史的患者(包括活动性上呼吸道感染)全麻期间喉痉挛的发生率高达8.4%[16]。
喉痉挛多发生于全麻Ⅰ~Ⅱ期麻醉深度,喉头有异物刺激,如分泌物、血液、口咽通气道、插管和拔管的过程都是喉痉挛主要的诱发因素[26],轻度喉痉挛仅吸气时呈现喉鸣音,重度喉痉挛时吸气和呼气都出现喉鸣音,发生重度喉痉挛时声门紧闭气道完全阻塞。轻度喉痉挛者可在去除局部刺激后自行缓解;中度喉痉挛者可用双手托下颌,开放气道,面罩加压给氧治疗;重度喉痉挛者可用粗静脉输液针行环甲膜穿刺吸氧,或者静注肌松药迅速解除痉挛,然后加压给氧或行气管插管进行人工通气[27]。大多数喉痉挛发生后经过积极处理都能够得到缓解,并能继续手术,而不影响患儿的最终转归[28]。
上呼吸道感染时,在支气管平滑肌过度敏感的情况下,外来刺激如分泌物、气管插管、反流误吸、吸痰等都可引起支气管痉挛;手术刺激可引起反射性支气管痉挛;硫喷妥钠、吗啡等因可使气管及支气管肥大细胞释放组胺,也可引起支气管痉挛[29]。对轻度支气管痉挛者手控呼吸即可改善;严重支气管痉挛者不适合高浓度吸入麻醉药,因为药物很难在呼吸道中运输,而且在达到所需的支气管扩张效果以前可能已经出现严重的低血压;正确快速推注糖皮质激素,最好用氢化可的松琥珀酸钠100~200 mg 静脉注射,或者是给予β2 受体兴奋剂治疗[30];缺氧和二氧化碳蓄积诱发的支气管痉挛,施行间歇正压通气即可缓解;对浅麻醉下手术引起的支气管痉挛,需加深麻醉或给肌松药治疗,通过加深麻醉(提高吸入麻醉药浓度、氯胺酮、异丙酚等)可以缓解大部分支气管痉挛[29]。
