建立在临床研究基础上的围手术期处理意见
1.围手术期监护
(1)常规监测:在围手术期,除了常规的生命体征监测,建议留置动脉导管进行动脉血压监测以及进行血气分析和血糖监测。此外,中心静脉压(CVP)的监测也可能是有用的,尤其是在需要使用血管活性药的复苏过程。
(2)神经功能监测
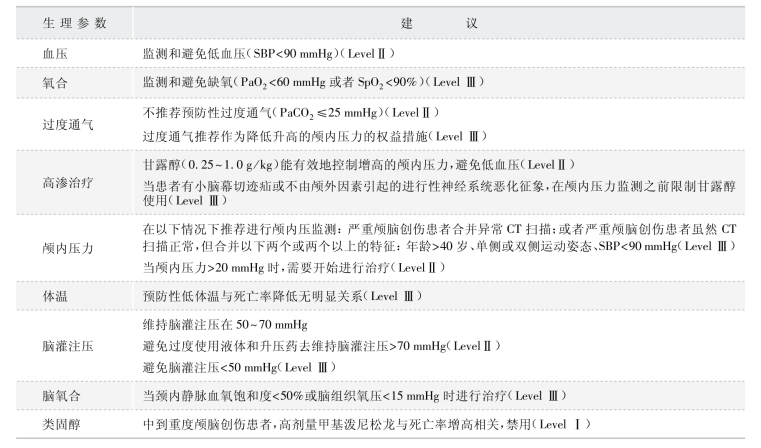
1)颅内压监测:根据当前的指南,在以下情况下推荐进行颅内压(ICP)监测:严重颅脑创伤患者(GCS 评分<9)合并异常CT 扫描(如血肿、挫伤、肿胀、疝形成或基底池受压等);或者严重颅脑创伤患者虽然CT 扫描正常,但合并以下2 个或2 个以上的特征:年龄>40 岁、单侧或双侧运动姿态、SBP<90 mmHg[49]。Khalili 等对1 级创伤中心2 年内共248 例严重颅脑创伤(GCS 评分3~8 分)患者进行了队列研究,并通过脑室引流术进行了颅内压监测,结果发现年龄、入院时GCS、高颅内压以及围手术期记录到的ICP 最大值是决定颅脑创伤患者结局的重要影响因素,并提示ICP 监测有利于协助我们靶向治疗和管理严重颅脑创伤患者[50]。另一项研究表明颅内压监测有利于降低老年严重颅脑创伤患者的住院期间死亡率以及改善6 个月的结局[51]。
2)脑组织氧监测:颅脑创伤可引起脑微循环障碍,导致脑组织的氧代谢异常,而氧代谢异常是造成继发性脑损伤的重要原因。以往研究表明,即使颅内压和脑灌注压正常的情况下,严重颅脑创伤患者脑组织缺氧的情况仍时常发生[52]。此外,对颅脑创伤死亡患者的尸检结果表明,脑组织缺血、缺氧的发生率高达90%以上。因此,临床上监测脑组织的氧代谢情况可及早发现脑组织缺血缺氧的情况,对降低患者的病死率、提高生存质量具有重要意义[53]。临床上监测脑组织氧代谢的方法有以下几种:颈内静脉血氧饱和度(Sjv02)、脑组织氧分压(Pbt02)、近红外光谱脑氧饱和度(NIRS)等。
颈内静脉血氧饱和度(Sjv02)是临床上最早使用的脑组织氧代谢监测方法,也是目前较常用的方法,主要反映整个大脑半球脑组织氧代谢的状况。该方法通过利用颈内静脉逆向插管,将导管的末端放置在颈内静脉球部,并通过采集混合脑静脉血进行血氧分析。研究认为Sjv02的正常值是62%,范围是55%~70%;当Sjv02>75%时,表明氧供超出脑代谢所需,提示过度灌注;而当Sjv02<54%时,表明氧供不能满足脑代谢所需,提示脑供氧不足[54,55]。但是,由于Sjv02 监测的导管探头容易发生移位、需要反复校准、光敏度弱、连续监测时间短、容易受到颅外静脉回流的影响等原因,测定结果的准确性下降。此外,Sjv02 作为颅脑创伤患者氧代谢的监测指标目前仍然存在争议[56]。
脑组织氧分压(Pbt02)是通过插入脑组织中的单电极或者多参数传感器测得的脑组织的氧分压,可以直接反映监测部位脑组织的氧代谢情况。正常人Pbt02 的范围是15 ~40 mmHg,当监测值在10~15 mmHg 为轻度缺氧,<10 mmHg 为重度缺氧,而<5 mmHg 的患者死亡率接近100%[57,58]。近年研究表明,对颅脑创伤患者,持续监测Pbt02,并根据监测结果指导治疗可以显著降低患者的死亡率,而且治疗效果优于传统根据颅内压/脑灌注压进行指导的治疗[59]。Pbt02 监测是目前脑氧监测最直接、最可靠的方法之一,可直接获得脑组织氧合与代谢指标,被一些学者认为是评价疗效的金标准[60]。
近红外光谱脑氧饱和度(NIRS)是一种无创、连续和实时的光学检测方法。一般认为,脑氧饱和度正常值为60%~75%。该方法具有一定的局限性,而且正常值在个体内和个体间存在10%的变异率,因此该法更适用于监测脑氧变化的趋势,用监测值来判定大脑缺血缺氧时应审慎。部分学者研究认为,NIRS 监测提供的脑氧代谢信息与Pbt02 是一致的[61];采用NIRS监测的脑氧饱和度结果与Pbt02 有显著相关性,但其精确性较Pbt02 差,尚不能取代有创的Pbt02 监测在临床上应用。
2.通气管理·术中通气应调整以保证足够的氧合和气体交换。吸入氧浓度应调整到维持Pa02>60 mmHg。文献推荐监测动脉二氧化碳分压,因为呼气末二氧化碳监测可能不可靠。在围手术期,麻醉管理应该避免高碳酸血症,但是低碳酸血症的使用也需要谨慎[62]。过度换气过度可能导致大脑血管收缩,从而导致缺血[62]。因此,过度通气应该理性地用于短期控制颅内压以及在颅骨切开术进行手术暴露时创造更好的手术条件。而在硬脑膜的关闭前应该恢复正常的二氧化碳水平,以避免张力性气颅的发展。当需要长时间使用过度通气时,推荐监测脑氧合状态[49,63]。在围手术期,我们可以监测颈内静脉血氧饱和度,以及在术后监测Pbt02或CBF(如使用经颅多普勒超声)等了解通气的情况[49]。
3.输液、血压管理·颅脑创伤后低血压可能影响脑血流动力学,甚至造成脑缺血。因此,围手术期血压管理,包括液体复苏和血管收缩药的选择至关重要。颅脑创伤的管理指南建议避免低血压(SBP<90 mmHg)和维持CPP 在50 ~70 mmHg[64,65]。对于颅脑创伤患者来说,温暖、不含葡萄糖的等张晶体液是可取的,而胶体液的作用目前是有争议的。一项研究有关生理盐水与白蛋白相比的因果分析研究表明,使用白蛋白进行复苏的死亡率更高,同时更不利于24 个月内的神经结局[66]。高渗生理盐水可能对颅脑创伤患者的液体复苏更有益,这主要是因为高渗生理盐水可以增加血管内液体以及降低ICP。目前研究证实在送往医院之前使用高渗生理盐水进行复苏可以降低血清生物标志物水平(S100B、神经元特异性烯醇酶、膜碱性蛋白),这都有利于患者的结局[67]。然而,也有双盲随机对照试验发现使用高渗生理盐水和标准液体对颅脑创伤患者进行液体复苏,6 个月的神经结局并没有明显区别[68]。
血管收缩药通常用于治疗低血压或增强CPP。然而,目前比较常用血管收缩药对颅脑创伤患者有效性的研究有限,而且这些研究的结果也互相矛盾。三个小的前瞻性随机交叉试验比较了去甲肾上腺素和多巴胺对颅脑创伤患者升压的有效性,发现尽管这两种升压药对脑血流速度[69,70]和脑氧合/代谢[71]没有明显差异,但去甲肾上腺素与预期的效果更一致[70],而多巴胺的使用会导致更高的ICP[69]。最近一项单中心回顾性研究发现,对于使用了苯肾上腺素、去甲肾上腺素或多巴胺进行治疗的重度颅脑创伤患者来说,使用苯肾上腺素后MAP 和CPP 从基础值增高幅度最大;此外,尽管目前仍不清楚使用了升压药能否改善MAP /CPP 以及改善CBP 或者氧合,但三组的ICP 水平没有明显差异[72]。总的来说,目前仍没有证据支持某种血管收缩药优于同类其他药物。(https://www.daowen.com)
4.输血·贫血与颅脑创伤患者住院死亡率增加[73]以及更差的结局[37,38]密切相关。然而,目前几乎没有证据支持颅脑创伤患者用于纠正贫血的红细胞输血实践标准。虽然有些研究表明,与其他危重患者相比,颅脑创伤患者可能并不受益于较高的输血阈值[37],但仍有学者提示不要在颅脑创伤患者中随意输血[38]。鉴于目前没有确切的有关颅脑创伤患者最佳的血红蛋白(Hb)水平,有学者建议红细胞输注以神经生理作为标准可能更为合理,并建议逐步取代以Hb 为基础的输血方式[74]。
红细胞输血可能通过一系列潜在机制影响颅脑创伤患者的脑氧合。红细胞输注不仅能增加血液的携氧体能力,还增加循环血量以及增加颅脑创伤后继发的大脑自动调节功能受损患者的CBF。近年来,红细胞输血对颅脑创伤患者Pbt02 的作用越来越受到重视,更为有趣的是,Pbt02 水平可能发展为输血的触发指标[75,76]。然而,大多数评估Pbt02 对神经外科患者输血的作用的研究由于样本量较小受到了限制,同时未能证明与输血一致和把Pbt02 的变化作为输血的预测指标[77,78]。
现有证据表明,贫血和红细胞输血与颅脑创伤后不良的神经结局密切相关[37,38]。贫血与患者住院死亡率增加、出院GCS 评分和G0S 评分降低密切相关;而红细胞输血与急性肺损伤、ICU 和住院天数延长以及死亡率增高相关[39]。目前颅脑创伤患者最佳的Hb 水平仍未明确,但是在中度到重度颅脑创伤患者使用自由输血策略(当Hb<100 g /L 时进行输血)并没有益处,因此不推荐[38]。
5.凝血管理·目前,没有有关颅脑创伤后凝血障碍的管理指南。目前常被用于治疗颅脑创伤后的凝血障碍的止血药物包括抗纤溶药物(如氨甲环酸)和促凝药物[如重组激活因子Ⅶ(rFⅦa)]。一个Cochrane 综述中提到两个随机对照试验评估了rFⅦa 的作用,但都因为样本量过小,不足以得到rFⅦa 对颅脑创伤患者是否有效的结论[79]。另一项有关抗纤溶药物治疗明显出血的临床随机安慰剂对照试验评估了氨甲环酸对成人颅脑创伤患者死亡率、血管闭塞事件和输血的作用,证实了氨甲环酸与死亡率的下降明显相关(RR 0.91,95% CI 085 ~0.97,P=0.003 5),同时显著降低因为出血导致的死亡风险(RR 0.85,95% CI 0.76 ~096,P=0.007 7)[80]。
6.颅内高压治疗·甘露醇是用于颅内高压的常用药物,推荐的剂量是0.25 ~1 g /kg。甘露醇主要通过影响血清渗透压来发挥作用,但由于渗透性利尿会导致血容量减少和低血压,目前建议只有当有小脑幕疝迹象或者当不归因于颅外因素的神经系统恶化时使用[81]。对于甘露醇治疗效果欠佳的严重颅脑创伤和颅内压显著升高的患者,可以使用7.5%高渗盐水作为二线治疗,可以增加脑氧合和改善大脑和全身血流动力学[82]。
7.血糖控制·2001 年,有学者报道强化胰岛素治疗(目标血糖4.44 ~6.1 mmol /L)与危重患者较低死亡率有关[83]。然而,最近的研究发现强化胰岛素治疗不仅不能降低死亡率,还增加了低血糖的风险[84,85]。Billotta 等将97 例严重颅脑创伤患者随机分为强化胰岛素治疗组(控制血糖在4.44~6.66 mmol/L)和常规胰岛素治疗组(控制血糖<12.21 mmol/L),结果发现两组6 个月的死亡率、神经系统的结局及感染的发生率相似;此外,尽管强化胰岛素治疗组ICU 停留时间较短,但低血糖(血糖<4.44 mmol/L)的发生率显著升高[85]。
因此,严格的血糖控制与强化胰岛素治疗仍然是有争议的。虽然有很多研究调查了不同环境下颅脑创伤患者的高血糖情况(入院vs.ICU,短时间vs.永久,早期vs.晚期等);但是没有具体针对围手术期进行调查和研究,以及围手术期高血糖症的患病率、术前血糖情况与成人颅脑创伤的关系尚不清楚。因为高血糖的发生归因于最初损伤的应激反应[86,87],以及麻醉状态下非糖尿病患者血糖水平升高[88],因此全麻和手术期间应激的加强可能会进一步加重高血糖和导致更差的结局。此外,个别麻醉药物已被证明对血和脑的葡萄糖水平具有不同的影响[89,90]。一项研究表明,对于因为颅脑创伤行颅骨切开术的成人患者,围手术期高糖血症(葡萄糖>11.1 mmol/L)的发生很常见(发生率约15%),而低血糖(血糖<3.3 mmol/L)现象尚未发现[91];同时其他研究证实术中高血糖的独立风险因素包括了重度颅脑创伤、硬脑膜下血肿、术前高血糖以及年龄≥65 岁,术中高血糖患者的住院死亡率更高[92]。鉴于目前有关围手术期血糖控制对颅脑创伤的证据,建议血糖控制在4.44~10 mmol/L 似乎是合理的。
8.治疗性低体温·低体温在应激期间可以降低脑代谢,减少兴奋性神经递质释放,减轻血脑屏障通透性。几十年前,治疗性低体温已被用于在颅脑创伤患者的脑保护;然而有关死亡率和功能结局的临床证据目前仍不明确。2008 年一项Meta 分析报道,颅脑创伤的低体温不能显著降低死亡率和增加良好的神经结局;虽然持续降低体温超过48 h 可能带来更大的好处,但低体温带来的潜在好处同时会被肺炎发生风险显著提高所抵消[93],这与最近的一项系统性回顾分析结果是一致的[94]。此外,最近一项重要的多中心随机对照试验发现,对复杂性颅内高压(颅内压>20 mmHg)的患者使用轻到中度治疗性低体温(32~35℃),基于6 个月G0S评分的良好预后比例更少(26%),而对照组高达37%(P=0.03);该试验提示在颅脑创伤患者相对于传统的低体温治疗,目标体温管理[控制正常体温或超温和低体温(36℃)]更为实用[95]。BTF/AANS 指南建议在成人颅脑创伤患者中可选择和谨慎使用低体温(Level Ⅲ)。
表8-2-4 2007 年严重颅脑创伤管理指南建议
(作者 葛缅,审校 罗晨芳)
