参考文献
第八节 器官移植患者行非移植手术的风险评估及处理
一、器官移植患者行非移植手术的流行病学
近年来,随着越来越多器官移植患者得以长期生存,其行非移植手术的机会逐渐增多,其中麻醉医师最可能遇到的是肾移植患者再手术,因肾移植是世界上所有器官移植中应用最普遍的[1]。近半个世纪以来,依托于现代外科手术、器官保存和围手术期处理技术的迅猛发展及移植免疫学的飞速进步,器官移植技术已经形成了一套较为成熟的技术程序。器官移植免疫学迅速发展,出现了许多有效的抗排斥药物;高效广谱抗细菌药物、抗真菌药物、抗病毒(巨细胞病毒、肝炎病毒等)药物的涌现为移植患者的康复创造了有利条件;危重患者心肺监护、麻醉、输血等的进步,外科技术、手术器械、缝线材料的开发和应用对移植手术的成功亦起着十分重要的保证作用。
(一)器官移植的现状
自1967 年Bernard 完成人类首例同种原位心脏移植术以来,心脏移植术已成为终末期心力衰竭患者的常规疗法,尤其是20 世纪80 年代末随着免疫抑制领域的全面发展,心脏移植(HT)的成活率明显提高。1982—2008 年全世界注册的HT 手术已经达8 万例。我国大陆虽然从20 世纪70 年代就开始了HT 的尝试,但早期进展缓慢,直到近十年来,随着我国社会经济发展水平的提高,国内为数不多的医院连续开展手术,总体HT 数量约有700 例。但由于国内没有统一的HT 注册系统,各家HT 中心患者的适应证的掌握情况、存活率、影响存活的危险因素不得而知。从1982 年开始注册登记以来,成人及儿童HT 后中位存活时间一般为10 年,那些存活超过1 年的患者中位生存期为13 年。中位生存时间呈现稳定的提高,从1980 年代的8.3 年至1990 年的10.4 年,2000 年又得到进一步提高。
1963 年6 月,首例人体肺移植手术在美国密西西比大学获得成功。1983 年加拿大多伦多大学单肺移植术的成功,标志着肺移植正式进入临床应用阶段。1986 年其又完成了世界上第一例双肺移植;20 世纪90 年代肺移植出现了快速的发展,出现双侧序贯肺移植术、心肺联合移植术。国际心肺移植协会(The International Society for Heart & Lung Transplantation,ISHLT)登记的肺移植例数在1985 年仅为14 例,而在2005 年达到历史最高的2 196 例。从1988 年起,术后生存率明显提高。在对术后1 年、5 年死亡危险因素的回归分析中,移植年代仍然是一个显著的独立影响因素,提示肺移植术后医疗在持续改善。尤其是2000 年之后,手术早期医疗的改善非常明显。ISHLT 对比1995—1999 年与2000 年后的两个时期,1 年生存率从74%增至81%,5 年生存率从47%增至54%[2]。
自1963 年Stazrl 行第一例肝移植手术后,肝移植技术得到了迅速的发展,在实质性大脏器移植中,已跃居第二位,累积例数仅次于肾移植,1 年存活率已达80%~90%,5 年存活率可达75%左右。肝癌肝移植1 年存活率超过80%,2 年存活率超过50%。到2002 年10 月底,全球有记载的肝移植数目已达到100 000 例,并以每年10 000 例的速度递增。Kim 等报告了1987—1994 年在Baylor 大学医学中心和Mayo Clinic 的143 例患者肝移植效果[3],患者随访到1995 年12 月,平均随访时间为35.8 个月,患者肝移植术后1 年生存率93%,2 年生存率90%,5 年生存率88%。我国自20 世纪90 年代后,随着新一代强力免疫抑制剂药物的出现,术后ICU 水平的提高,使肝移植在我国日益成为一种普通的例行手术,成功率达95%,良性肝病肝移植后1 年存活率可达90%,3 年存活率为80.5%。
肾脏移植是众多器官移植中最早开展并获得成功的器官。至2005 年年底,全球完成68万多例同种肾移植,每年进行约3 万例肾移植。我国肾移植工作开始于20 世纪60 年代,至今已开展近7 万例。由于外科技术的进步、新的免疫抑制药物及方案的应用,使肾移植术后患者的存活率显著提高,存活时间大大延长[4]。移植后一年肾存活率已从50%上升至90%以上,最长的移植肾存活已达20 余年。
(二)移植状态患者行非移植手术的流行病学
目前尚无文章回顾移植状态患者行非移植手术的原因,从有限的资料中获知:心脏移植状态患者非移植手术原因依次为急腹症(含择期)、妊娠及外伤;肺移植患者可能因活动受限暂无非移植手术的相关资料;肝移植患者非移植手术的原因依次为肝外肿瘤、胆道并发症、妇科疾病;肾移植患者相关资料较多,非移植手术原因为:其他脏器肿瘤(15%)、疝气(15%)、妇科疾病(15%)。
二、移植器官的功能状态评估
(一)心脏移植
目前全世界300 多个心脏中心进行心脏移植,总例数已超过7 万例,每年3 000 多例,30日手术死亡率5%~10%。国际心肺移植学会(ISHLT)2009 年对心脏移植统计结果表明,术后受者平均手术存活率95%,1 年、3 年、5 年存活率为84.5%、78.0%、71.4%[5],以后每年以4%死亡率递减,最长存活病例已超过30 年。根据国际多中心研究结果显示死亡原因22%为急性心力衰竭,22%为感染,15%为排斥反应,随着移植时间延长冠状动脉病变和恶性肿瘤等也是主要死亡原因。手术后6 个月内感染和排斥是大部分死亡原因,增加死亡率的其他相关因素为机械呼吸依赖、再次心脏移植、手术前应用心室辅助装置或球囊反搏、受体年龄>65 岁、供体年龄>50 岁、受体或供体为女性。对移植心脏进行功能评估时,以下因素应予考虑。
(1)心脏移植物血管病变(CAV)是影响心脏移植物长期存活的主要因素。冠脉造影结果显示,移植术后1 年、5 年、8 年、10 年CAV 的罹患率为8%、32%、43%、52%[5,6]。CAV 是一种加速型冠状血管阻塞性疾病,其组织学特点主要是冠状动脉内膜呈加速性、弥漫性同心圆样增厚,从而导致冠状动脉管腔狭窄,最终引起移植心脏供血不足[7],病变内膜中伴有从血管中层迁移而来并增殖的平滑肌细胞和浸润的单核炎症细胞,如淋巴细胞、巨噬细胞。病变主要影响移植心脏的动脉、小动脉、毛细血管和静脉,而不累及受者的其他血管。
因为移植心脏为去神经心脏,仅靠体液机制调节,供体心脏与受者之间无有效的疼痛反射弧,故CAV 往往无心肌缺血或心肌梗死相关的心绞痛发作,症状常表现为室性心律失常、充血性心力衰竭及猝死等。因此,病史的诊断价值就显得有限。目前对CAV 尚无特异性诊断指南。当前的诊断方法主要有侵入性和非侵入性两大类,侵入性诊断手段多为在移植后进行年度的常规冠状动脉造影,造影发现冠状动脉主要分支的任何一支,或其第一级分支管腔内径减少达50%以上时,即可以诊断为CAV。非侵入性诊断手段可改善诊断率,较为敏感的方法包括了多巴酚丁胺超声心动图负荷试验和运动核素显像。CTA 和MRI 在分级中的应用价值,使其在未来的研究中也具有积极的作用。
(2)免疫排斥反应是影响心脏移植术后存活率的最重要因素,应用免疫抑制剂具有不同的毒副作用,患者需终身服药,这不仅会导致严重的机会感染和恶性肿瘤的发生,而且长期使用免疫抑制剂所引起的移植器官血管病变将最终导致移植物功能丧失。关于免疫抑制剂对麻醉决策的影响将在下文详述。
(3)关于冠脉疾病及心功能不全患者的评估详见本书有关章节,本文不另赘述。
(二)肺移植
国际上肺移植的手术病死率<10%,ISHLT 公布的基准生存率分别为:3 个月88%、1 年78%、3 年63%、5 年51%、10 年28%;总体半寿期5.2 年,存活超过1 年者的半寿期7.3 年。值得提出C0PD 的肺移植取得较好的生存率,C0PD 受体1 年、3 年、5 年、10 年生存率分别是79.19%、62.14%、46.18%和33.17%,双肺移植受体的5 年生存率达66.17%±4.0%。至于生存质量,根据ISHLT 的统计,在那些报告功能状态数据齐全的中心,超过80%的生存受者在1年、3 年、5 年、10 年报告没有活动受限,超过35%的受者在移植后3 年、5 年仍在工作。
1.缺血再灌注损伤·在临床上大约25%的肺移植受体发生严重的缺血再灌注损伤(I/RI)。I/RI 以非心源性肺水肿为典型表现,发生于肺移植的12 h 内。它是早期死亡和长期ICU 的最常见原因。发生I/RI 的患者采用保护性呼吸机支持、利尿和吸入N0 等。在紧急情况下可用ECM0。美国华盛顿BJ 医院在12 个患者中应用ECM0,存活了7 例,7 例患者均是在不可逆的肺损伤发生前、移植后24 h 内开始使用ECM0 的。
2.急性排斥·尽管肺移植免疫抑制剂的剂量和药物浓度水平均超过了其他的实质性器官移植的水平,经活检证实肺移植后的1 年急性排斥反应发生率仍高达80%。急性排斥的病理学特征是血管周围淋巴细胞浸润。急性排斥反应的治疗是基于病情的严重程度、复发和患者的状态。典型的处理是前3 日静脉给予甲强龙(20 mg /kg),以后调整到维持剂量。
3.慢性移植体失去功能和细支气管阻塞综合征(B0S)·慢性移植体失去功能是组织学上以细支气管阻塞为特征的临床病理综合征。临床表现为移植后3 个月或更长时间排除支气管肺感染原因出现的进行性严重呼吸困难。肺移植1 年、3 年、5 年的无B0S 分别是85%、65%、47%。B0S 是成人肺移植术后移植肺功能不全的主要原因。在生存超过1 年后,80%以上的死亡是肺的原因引起的,其中30%是由于支气管阻塞,许多患者不能从肺感染中恢复是由于严重的气道阻塞,或是治疗B0S 相关的免疫抑制的结果,对B0S 治疗的限制正在改变免疫抑制药物的选择。B0S 是免疫介导过程的积累,是由慢性排斥反应引起的。
综上所述,移植肺功能的评估主要涉及2 个因素:肺动脉高压及细支气管阻塞综合征。因移植肺丧失了神经调节,体液因素如肺动脉血PH 对肺循环起主要调节作用,因而术前应高度重视患者肺部感染状态。细支气管阻塞综合征表现与C0PD 相似,其功能评估可参考本书相关章节。
(三)肝移植
虽然目前国内外肝脏移植的技术不断提高,围手术期死亡率降低和受体生存率升高,但长期生存率和术后生活质量与人们的期望仍有较大差距,患者获得80%的一年存活率和更低的长期存活率,所付出的是巨额医药费用和长期服用免疫抑制剂等药物,同时可能有各种移植术后的并发症发生,生活质量较差。国内外已有多项回顾性研究分析影响肝脏移植受体术后生存时间的主要因素,所分析的范围为受体术前、术中、术后各种影响移植术后生存的因素如受体术前状况、供肝质量、手术时机、供受体免疫学配型、术中处理方法、免疫抑制剂使用、术后并发症等。
(1)移植术前受体肝功能Child 分级每增加1 级,其相对危险度为前者的1.676 倍,但PS(移植前状态UN0S 分级)的差异无显著性,移植术前受体肝功能状况是影响术后生存时间的一个重要因素,尽量选择在患者肝功能较好时,或者当患者肝功能差时通过人工肝等措施使患者肝功能水平恢复到较好的程度可能有助于患者术后生存时间的延长。人工肝脏支持系统(artificial liver support system,ALSS)应用人工合成或设计的材料和方法对肝脏功能进行替代,对于晚期重型肝炎患者而言,有必要采用人工肝支持系统来暂时地发挥肝功能支持作用、改善内环境,延长患者的安全等待时间,提高手术耐受性,为肝移植提供桥梁性的过渡[8,9]。进行ALSS 治疗后,肝功能获得改善,血胆红素、内毒素水平明显下降,水、电解质紊乱得以恢复正常,机体术前的内环境失衡得到纠正,从而有效地改善了患者的一般情况,可以更好地耐受手术,为移植创造条件,术后对于移植肝功能发挥欠佳者为供肝细胞功能的恢复提供时间。发生急性排斥反应时,同时可以去除抗原及免疫复合物,帮助渡过排斥反应期,有利于移植肝功能的恢复。
(2)术后出现急性排斥反应的患者的相对危险度是没有出现急性排斥反应的2.537 倍,故合理地选择免疫抑制剂,制定个体化的免疫抑制剂治疗方案,预防和控制急性排斥反应的发生,有利于受体获得较长的术后生存时间。20 世纪90 年代,充满了CsA 和FK506 谁优之争,但没有结论,结果是出现两种方案即CsA+AZa+Pred 及FK506+Asa+Pred 并驾齐驱,任人选择。以后出现了晓悉(即MMF),其优点是和CsA、FK506 都有协同作用,没有骨髓抑制作用,不引起高血压、糖尿病,目前几乎替代了AZa,使移植物慢性失功能减少到3%,形成了新的标准方案,即CsA 十MMF+Pred 或FK506+MMF+Pred。随着移植术后长期存活者的增加,移植肝和联合移植的肾、肠功能丧失也增加,其常见原因是慢性排斥反应[10]。现在使用免疫抑制剂的观念有两点转变,一是改变急性排斥的“逆转”用药为“防止”用药,因为急性排斥发生次数越多,越容易增加慢性排斥的发生,二是在长期应用免疫抑制剂时,着眼于防止慢性排斥。
(3)经典原位肝移植需要把病肝连同肝后下腔静脉一并切除,同时要阻断门静脉的血流,这会导致部分患者严重的血流动力学和代谢功能的紊乱。患者在术前和术中是高排低阻型血流动力学障碍,在术前慢性肝病患者引起肺血管舒张,使肺循环阻力降低,同时伴有心排血量增加,无肝期前部分患者出现容量依赖性的肺动脉高压[11]。在无肝期间静脉回心血量减少引起血压下降,心排血量减少;肠道淤血、肠壁水肿;肾脏淤血可加重原有的肾功能损害;细胞无氧代谢加强,酸性代谢产物增加;门静脉压力的进一步升高,增加手术中的失血量等,术后循环阻力均增高,肺循环阻力比体循环阻力增高更显著。在无肝期中静脉-静脉转流时,由于离心泵的作用,体循环阻力显著下降,反射性地引起肺动脉高压,新肝期开始后,由于回心血量的增加,有严重的肺水肿倾向,易导致术后的呼吸功能不全和肺部感染。
(四)肾移植
影响移植肾长期功能主要是由于免疫或非免疫等因素造成慢性移植物肾病导致的慢性移植肾失功能(chronic allografts dysfunction,CAD)。有研究发现移植后1 年时的肾小球滤过率小于45 mL/min 的患者及移植物的长期生存率很低[12,13]。大量的研究表明,早期和反复多次发生急性排斥反应是CAD 的易感因素。冷缺血时间、移植肾功能延迟恢复、PRA 滴度过高等免疫和非免疫因素可增加急性排斥反应的发生率,从而影响移植肾长期存活[14]。与CAD 相关的非免疫因素还包括:供肾的肾单位数量不足、缺血时间延长、缺血再灌注损伤导致的急性肾衰(延迟肾功恢复)、CsA 和TAC 毒性,以及高血压、高脂血症[14]。有学者统计,CAD 的发生率为27.43%,是肾移植失败的首要原因。急性排斥、冷缺血时间、延迟肾功恢复、ATN、术后肌酐恢复时间及恢复情况、术后并发症和感染的发生等因素均可对移植肾的早期和远期存活产生重要影响。
CAD 主要的临床表现为慢性肾功能不全,其评估可参见本书相关章节。
三、围手术期器官移植患者的相关风险
心脏移植患者术后第5 年时冠状动脉病变发生率33%,这也可由于移植因素(如长时间缺血)、吸烟、高血压低血糖及高脂血症而加重。
现在主流的肺移植术式为单侧肺移植加对侧肺减容术,即使很好的移植肺也与正常肺存在生理差别,动脉高碳酸血症可持续至术后1 个月。而且支气管吻合处神经末梢缺失会导致咳嗽反射和气道自动调节功能消失。移植肺黏膜纤毛清洁功能障碍伴随免疫抑制及咳嗽变弱,使得患者围手术期肺炎的发生率大大增加。且患者淋巴回流功能障碍,更易出现肺水肿。
肝移植术后患者术后的治疗主要为支持治疗,常见的再次手术原因为胆道疾病。新肝的合成能力通常在肝移植术后2 周内恢复到正常水平,但是肝酶谱和血清胆红素则需要更长的时间才能恢复到正常水平。若肝移植术后短期内再次手术可能会引起肝功能的明显恶化,术前患者麻醉评估除肝功能外,应包括但不限于肾功能及神经系统评估。
大约有50%的接受尸体肾移植的患者6 个月后肾小球滤过率(GFR)约为50 mL /min,大约50%的患者在随后的几年中GFR 将逐渐降低,但30%的患者维持一个稳定的GFR。如果肾移植术后患者生存质量得到改善,那么快速进展的心血管病变也将得到缓解,但不可能完全终止疾病进程。这些患者与一般患者相比,仍存在很高的心脏风险。
四、麻醉决策和处理(https://www.daowen.com)
(一)麻醉前评估
对于移植患者,麻醉前评估的目的主要是以下4 点:①需要外科治疗的器官与移植器官的关系及功能评估;②免疫抑制剂的不良反应;③免疫抑制剂和麻醉药发生相互作用的可能性;④围手术期排斥反应及感染风险。器官功能评估前文已较完整地进行了介绍,本章着重介绍免疫抑制的不良反应、对麻醉决策的影响及围手术期排斥反应及感染风险。
1.免疫抑制剂的不良反应·移植后的免疫抑制用药是门极为高深和难以掌握的艺术。临床移植免疫抑制的目标不仅仅在于防止宿主免疫系统攻击移植器官,防止移植器官发生排斥,而且还应包括防止过度免疫抑制所带来的并发症(如感染和恶性肿瘤)和降低免疫抑制药物的非免疫系统毒性作用(如肾毒性、高脂血症、骨髓抑制及库欣效应)。目前,临床上使用的免疫抑制药及其用药组合大多数还是依赖于医师的经验和直觉,许多免疫抑制药物由于其复杂的毒性机制,使得移植物和患者的长期存活受到了影响。因此,通过对免疫药物和治疗方案的个体化,调整免疫抑制药物的免疫系统和非免疫系统反应是非常值得优先探讨的课题。作为临床移植学家,必须同时考虑最好的移植效果和最低的药物毒性。1998 年美国得克萨斯休斯敦的BarryKahan 教授在意大利的佛罗伦萨预言,新世纪免疫抑制治疗将不再应仅仅满足于患者和移植物的存活,而要追求实现三个“C”的治疗方案,即合并的疾病(生活质量)、方便、价格(co-morbidity,convenience and cost)。目前,常用的免疫抑制剂为硫唑嘌呤、环孢素A、霉酚酸酯、他克莫司、雷帕霉素等化学免疫抑制剂和生物制剂类免疫抑制剂。临床应根据不同个体对不同的免疫抑制剂耐受情况及经济承受能力等来选择不同的药物组合(表8-8-1)。
表8-8-1 常用免疫制剂的不良反应
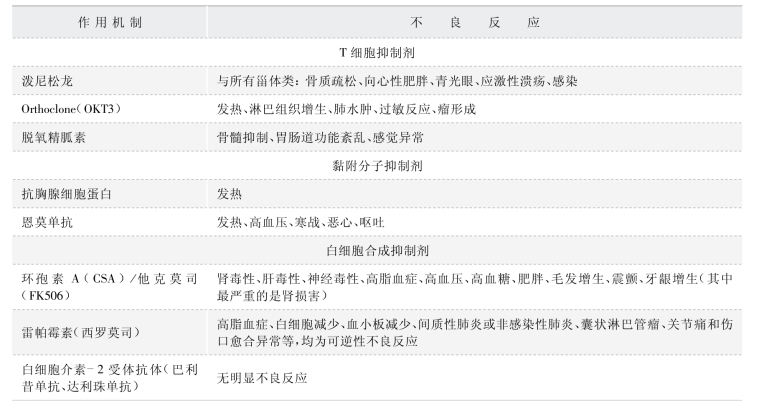
(续 表)

2.免疫抑制剂对麻醉决策的影响·有关麻醉剂和免疫抑制剂相互作用的研究不多。其中研究发现,环孢素A 的使用能增强或延长维库溴铵、泮库溴铵、阿曲库铵的神经肌肉阻滞作用,其机制尚不明确。有作者[17]报道了一6 岁0LT 后患儿在氯胺酮麻醉过程中出现惊厥,认为使用了环孢素的患者应慎用氯胺酮。另外,有报道指出环孢素A 能减少巴比妥类、芬太尼和异氟烷的用量,其机制可能和P-糖蛋白相关。另外,FK506 有显著的血管毒性,可使血管对肾上腺素的敏感性上升,降低对乙酰胆碱和硝普钠的敏感性。长期服用免疫抑制剂可能导致血管脆性增加,从而增加手术难度及围手术期出血量;其另一不良反应为血小板减少,这可能增加硬膜外麻醉和区域阻滞的风险。
3.围手术期排斥反应及感染风险·目前主流观点认为移植状态患者术前无须改变免疫抑制治疗方案。有医院在围手术期通过在术中静脉给500 mg 甲泼尼龙琥珀酸钠及术后连续3日静脉给予150 mg 甲泼尼龙琥珀酸钠的方法来抑制免疫排斥反应,同时可以发挥其在术中抗炎、抗过敏的作用。通过持续的免疫抑制治疗,术中排斥反应被有效地控制。其术后5 日的相关血清指标较术前无明显差异[18]。
在免疫抑制治疗中,非移植手术是否增加排斥和感染的机会,或者影响伤口愈合,目前尚无相关报道[19,20]。目前确定的是术前应排除感染的存在,虽然器官移植手术感染引起的死亡率已经下降,但感染仍然是移植受体发病和死亡的主要原因[1],主要为细菌和巨细胞病毒感染。大量免疫抑制剂的使用导致感染的征象不规则,发热往往是感染和排斥反应的主要特征,只有在彻底排除感染后才能考虑非感染因素。
(二)围手术期管理的相关建议
1.麻醉方式的选择·移植术后长期生存的患者一般无椎管内麻醉的禁忌证,选择复合麻醉方式有助于减少静脉麻醉药用量,有助于保护移植物功能。此外,应根据手术部位、术式及患者的身体状况,来选择麻醉方法。
2.术中管理的一般建议·移植术后早期的患者移植器官状态不稳定,术中应避免低血压引起的器官灌注不足。因此,需要通过合理的容量治疗和血管活性药物的使用来维持正常的血供和氧合。避免长时间的低灌注引起多器官功能衰减。移植术后中长期的患者一般病情较稳定,各脏器功能基本恢复,再次手术时主要防治长期应用免疫抑制剂引起的并发症,患者往往预后较好。因患者长期应用免疫抑制剂,患者易并发感染,术中任何有创的操作均应注意无菌术,特别是气管插管、动脉穿刺和中心静脉穿刺术,应严格掌握适应证。在围手术期,广谱抗生素的使用也是麻醉医生要考虑的方面。人工通气更易增加肺部感染的机会,对喉镜和呼吸环路严格消毒和更换,使用人工鼻或其他呼吸滤过器,术中加强吸痰,及早拔除气管导管。乌司他丁围手术期的使用可以抑制IL-6 和IL-8 和TNF-a 等促炎性细胞因子的生成和释放,及减少氧自由基的产生[21]。
(作者 宋福荣,审校 关健强)
参考文献
[1]古妙宁,刘怀琼,陈仲清.器官移植的麻醉及围手术期处理[M].北京:人民军医出版社,2002.
[2]Christie JD,Edwards LB,Aurora P,et al.Registry of the International Society for Heart and Lung Transplantation:twenty-fifth official adult lung and heart /lung transplantation report — 2008[J].The Journal of heart and lung transplantation:the official publication of the International Society for Heart Transplantation,2008,27(9):957-969.
[3]Kim WR,Wiesner RH,Therneau TM,et al.Optimal timing of liver transplantation for primary biliary cirrhosi[sJ].Hepatology(Baltimore,Md),1998,28(1):33-38.
[4]UNOS:Health Resources and Services Administration,Division of Organ Transplantation,1994.
[5]Stehlik J,Edwards LB,Kucheryavaya AY,et al.The Registry of the International Society for Heart and Lung Transplantation:twentyseventh official adult heart transplant report — 2010[J].The Journal of heart and lung transplantation:the official publication of the International Society for Heart Transplantation,2010,29(10):1089-1103.
[6]Schmauss D,Weis M.Cardiac allograft vasculopathy:recent development[sJ].Circulation,2008,117(16):2131-2141.
[7]Suzuki J,Isobe M,Morishita R,et al.Characteristics of chronic rejection in heart transplantation:important elements of pathogenesis and future treatment[sJ].Circulation journal:official journal of the Japanese Circulation Society,2010,74(2):233-239.
[8]Bjoro K,Ericzon BG,Kirkegaard P,et al.Highly urgent liver transplantation:possible impact of donor-recipient ABO matching on the outcome after transplantation[J].Transplantation,2003,75(3):347-353.
[9]Palmes D,Qayumi AK,Spiegel HU.Liver bridging techniques in the treatment of acute liver failure[J].J Invest Surg,2000,13(6):299-311.
[10]Riordan SM,Williams R.Extracorporeal support and hepatocyte transplantation in acute liver failure and cirrhosis[J].Journal of gastroenterology and hepatology,1999,14(8):757-770.
[11]King PD,Rumbaut R,Sanchez C.Pulmonary manifestations of chronic liver diseas[eJ].Digestive diseases(Basel,Switzerland),1996,14(2):73-82.
[12]Remuzzi G,Perico N.Protecting single-kidney allografts from long-term functional deterioration[J].Journal of the American Society of Nephrology:JASN,1998,9(7):1321-1332.
[13]Salvadori M,Rosati A,Bock A,et al.Estimated one-year glomerular filtration rate is the best predictor of long-term graft function following renal transplan[tJ].Transplantation,2006,81(2):202-206.
[14]Danovitch G M.Choice of immunosuppressive drugs and individualization of immunosuppressive therapy for kidney transplant patient[sJ].Transplantation proceedings,1999,31(8a):2s-6s.
[15]Barshes NR,Annambhotla S,Bechara C,et al.Endovascular repair of hemodialysis graft-related pseudoaneurysm:an alternative treatment strategy in salvaging failing dialysis acces[sJ].Vascular and endovascular surgery,2008,42(3):228-234.
[16]Song AT,Abdala E,Bonazzi PR,et al.Does mycophenolate mofetil increase the risk of cytomegalovirus infection in solid organ transplant recipients?— A mini-review[J].The Brazilian journal of infectious diseases:an official publication of the Brazilian Society of Infectious Diseases,2006,10(2):132-138.
[17]Agarwal A,Raza M,Dhiraaj S,et al.Is ketamine a safe anesthetic for percutaneous liver biopsy in a liver transplant recipient immunosuppressed with cyclosporine?[J].Anesthesia and analgesia,2005,100(1):85-86.
[18]Defraigne JO,Meurisse M,Limet R.Valvular and coronary surgery in renal transplant patient[sJ].The Journal of cardiovascular surgery,1990,31(5):581-583.
[19]Snell GI,Westall GP,Paraskeva MA.Immunosuppression and allograft rejection following lung transplantation:evidence to dat[eJ].Drugs,2013,73(16):1793-1813.
[20]Legris T,Picard C,Moal V,et al.Humoral immunity after kidney transplantation:impact of two randomized immunosuppressive protocols[J].Annals of transplantation,2013,18:622-634.
[21]张欢,乔青,杨拔贤,等.乌司他丁对原位肝移植术患者围手术期促炎性细胞因子和氧自由基代谢的影响[J].中华麻醉学杂志,2003,(05):4-6.
