创伤性休克的病理生理机制
在创伤性失血早期,甚至是在低灌注还未进展到细胞缺血阶段时,机体就开始启动局部和全身性的代偿反应。受损血管收缩限制出血,而侧支血管扩张增加缺血组织血流。创伤后疼痛、失血和大脑皮质反应激活神经内分泌系统,增加心脏的变时和变力效应,将血流从缺血耐受性血管床分流到中心循环。这种体液的再分布效应使机体在血管内容量大量丢失的情况下仍能够维持心、脑等重要脏器的血流灌注。但这种体液的分流也是导致再灌注损伤的潜在原因。强烈收缩的血管床突然恢复血流时,可能释放大量局部积聚的毒性代谢产物进入中心循环,引起心功能障碍或心律失常。
休克的重要标志是组织细胞低灌注。当低灌注引起的氧输送下降超过细胞的代偿范围时,就会导致组织细胞功能障碍,进而促发炎症级联反应(图18-1)。炎症反应一旦启动,便成为一种独立于初始促发因素而发展的疾病过程,这就是为什么在创伤出血后,即使出血得到控制而且患者恢复到正常生命体征和正常血流灌注时,却仍可能死于MODS的原因。
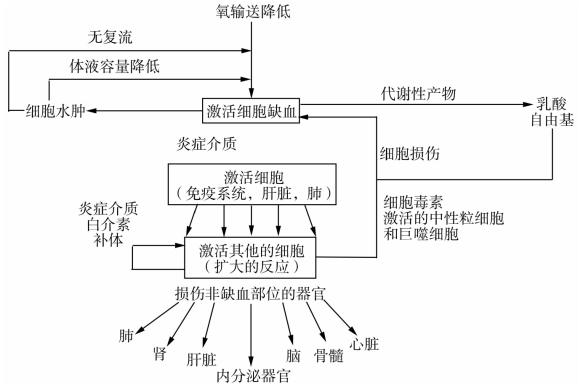
图18-1 休克级联反应(shock cascade)。机体局部的一个器官的缺血将激发全身性炎症反应,该反应甚至会在充分复苏后仍持续存在,这就是严重失血性休克导致多器官功能障碍的病理生理学基础
特定器官系统对创伤性休克的反应也有其特殊方式(表18-2)。
表18-2 机体各器官系统对缺血的反应
 (https://www.daowen.com)
(https://www.daowen.com)
续表

因为脑和脊髓的无氧代谢储备功能非常有限,含氧血流中断数分钟就会导致永久性神经损害。当氧供降低时,部分脑细胞可处于一定程度的冬眠(hibernation)状态并降低脑代谢率,这可以解释失血性休克进展过程中意识水平的变化:正常、激动、嗜睡、昏迷。血流完全中断的脑组织会发生细胞坏死和脑梗死,而缺血部位则发生细胞凋亡。脑是机体对缺氧最为敏感的器官,机体将尽最大可能调动全身的代偿机制来维持脑的血流灌注,所以休克复苏后存活的患者几乎不会出现永久性神经功能损伤,除非在脑内存在局部脑血流障碍(如脑卒中或直接脑损伤)。
心脏功能在休克早期代偿性增强,表现为心率增快、心肌收缩力增强和冠脉血流增加。与脑一样,除非氧输送完全停止,否则心脏很少会成为低灌注的前哨损伤器官。创伤患者如果出现心肌缺血的表现(如血肌钙蛋白升高、心电图ST段改变等)则提示直接的心脏损伤(心脏挫伤)或潜在的严重冠脉疾病。然而,随着休克的病情进展,代谢性酸中毒对心肌的抑制作用,以及快速大量液体复苏引起的低温、贫血和低钙血症等因素的作用,常会出现心力衰竭。由于血管的收缩是能量依赖性的,进行性的缺血将最终导致血管系统衰竭,即使快速输注复苏液体也会发生对肾上腺素无反应的异常血管舒张,这也是致死性急性休克的标志。如果失血得到控制,患者存活转入ICU,全身炎症反应综合征或脓毒血症毒素释放也可能导致心力衰竭。
由于肺毛细血管是血液循环的下游过滤器(downstream filter),因此肺也是缺血时易受炎症产物侵害的器官之一。免疫复合物和细胞因子在肺毛细血管的积聚会导致中性粒细胞和血小板聚集、毛细血管通透性增加、肺组织结构破坏和急性呼吸窘迫综合征(ARDS)。在创伤性休克患者中,肺通常是MODS的前哨受损脏器。
肾脏和肾上腺在休克时最早发生神经内分泌改变,产生肾素、血管紧张素、醛固酮、皮质醇、红细胞生成素和儿茶酚胺。在低血压时,肾脏通过选择性收缩血管、肾髓质和肾皮质部血液的自身调节以维持肾小球滤过率。持续性低血压会导致细胞能量下降、尿浓缩功能丧失,继而出现斑片状细胞坏死、肾小管上皮细胞坏死和肾衰竭。
肠道是受低灌注影响最早的脏器之一,并且可能是MODS的主要促发因素。休克早期即可出现强烈的血管收缩,并且常导致“无复流”现象(即使在体循环恢复的情况下仍然存在)。肠细胞的死亡会破坏肠黏膜的屏障功能从而导致细菌向肝脏、肺移位,进而可能导致ARDS。肝脏具有复杂的微循环,已证实在休克恢复期间会受到再灌注损伤。肝细胞新陈代谢活跃,在缺血性炎症反应和血糖调节方面发挥重要作用。休克后出现的肝脏合成功能衰竭甚至可能致命。骨骼肌在休克期间代谢并不活跃,而且耐受缺血缺氧的能力强于其他器官。当出血促发外周血管收缩但还不至于威胁中心循环时,创伤患者能够维持正常的神志和生命体征。但是在外周组织却不断积累着氧债(oxygen debt),大量骨骼肌持续性的缺血会产生大量乳酸、自由基及炎症介质,最终成为促发全身炎症反应综合征的重要因素。骨骼肌细胞持续性缺血还会导致细胞内钠离子和游离水增加,从而加剧血管内及组织间液的消耗。
