三、循环
(一)评估循环状态
创伤性休克患者早期最突出的矛盾是血容量不足,也是造成全身性生理紊乱的主要原因,纠正低血容量、维持循环稳定必须与气道处理同时进行。根据心率、脉搏、血压、意识及外周灌注的变化可初步判断循环系统状态。美国外科医师学会(American College of Surgeons)将急性出血分为4级(表18-4)。
表18-4 急性出血的分级
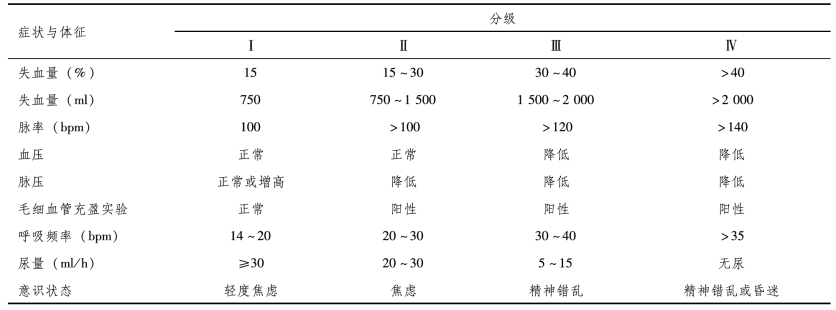
除症状和体征外,还可根据创伤的部位和性质判断出血量。如骨盆骨折可失血1500~2000ml;一侧股骨骨折可失血800~1200ml;一侧肱骨骨折失血达200~500ml;而一侧胸肋膈角消失可失血500ml;血胸失血可达1000~1500ml;腹腔内出血可达1500~2000ml,如伴有后腹膜血肿及复合创伤,甚至多达3000ml等。
(二)静脉通路
检查已建立的静脉通路以保证通畅,至少应开放两条大孔径静脉通路。腹部损伤和可疑大静脉破裂的患者,静脉通路应建立在膈肌平面以上。如果怀疑上腔静脉、无名静脉或锁骨下静脉梗阻或破裂,应将静脉通路建立在膈肌平面以下。如果外周静脉置管失败,则考虑中心静脉穿刺置管,颈内静脉、锁骨下静脉、股静脉可供选择,但对于可疑颈椎损伤的患者,应避免使用颈内静脉或颈外静脉通路。对已经中心静脉置管的患者(通常是从急诊室带入手术室),必须确认导管的位置正确。
(三)容量复苏
1.损伤控制性复苏策略 一旦确定了休克的诊断就应该尽快开始容量复苏治疗,创伤复苏治疗能否取得最终的成功则取决于出血的原因是否得到纠正。但是明确失血原因并控制出血的过程需要花费一定的时间(诊断性检查、开放补液通路、建立有创监测、转运入手术室和麻醉诱导等)。在这段时间里,液体治疗就好比向一个底部有漏洞的大容器内不断倾倒液体一样,所以这段时间是复苏治疗最为复杂、最为关键也是最容易被临床医师误解的阶段。在这个阶段,复苏的目标仅仅在于支持患者的生理功能,而不是一定要使患者的生理功能恢复到正常标准。对仍在活动性出血的患者过于积极地追求所谓的“复苏终点”(endpoints of resuscitation),则可能加重患者潜在的病理生理状态,并且使最终的治疗更为困难。因此,对于严重创伤性休克患者的治疗,应该采取损伤控制性复苏策略(damage control resuscitation,DCR)(表18-5)。DCR的目的在于尽量减少医源性的复苏损伤,预防已存在的创伤性休克和凝血功能障碍的恶化,并最终有效控制出血。一旦获得有效的止血,接下来的目标就是迅速逆转休克,纠正低凝状态,补充血管内容量缺失,维持合适的氧供和心排血量,从而达到减少损失、改善创伤患者预后的最终目的。
表18-5 损伤控制性复苏原则(damage control resuscitation principles,DCR)

续表

2.容许性低血压复苏策略 尽管高级创伤生命支持指南(advanced trauma life support,ATLS)一直倡导静脉快速输注液体,但是该治疗策略对仍在活动性出血的患者却是有害的。低血压是受损血管形成早期凝血的关键因素,快速输注大量晶体液在提高血压的同时有可能冲刷掉已经形成的血凝块,导致再出血,随之引起生命体征的进一步恶化。此外,初期复苏最常使用的等张晶体液通过稀释凝血因子和血小板、降低血黏度及低温而进一步加重失血。已有临床试验证实,对仍在活动性出血的患者采用容许性低血压复苏策略(permissive hypotensive resuscitation scheme)要比过度积极的液体治疗(aggressive fluid therapy)更具优势。因此,液体应该小剂量使用,以能够维持稍低于正常的血压(一般收缩压维持在90mmHg)为治疗目标,直至出血得到有效控制。在临床上通常可以看到下面的现象:一旦控制出血,机体通过所谓的自身复苏(autoresuscitation)机制,血压往往就会逐渐恢复正常,患者对麻醉药和镇痛药的耐受性也会不断改善。
3.复苏液体的选择 输注液体的性质和液体的量同等重要。目前可供使用的各种静脉补液都存在各自的优缺点(表18-6),麻醉医师应该根据临床需要权衡利弊后合理选择使用。
表18-6 失血性休克复苏的液体种类

续表

(1)晶体液:复苏时究竟应该输注何种液体一直存在着争议。通过回吸收体液进入毛细血管以部分恢复血管内容量是机体对失血的代偿机制,但往往引起组织间液的缺失。输注晶体液,如等张0.9%生理盐水(NS)或乳酸林格液(LR),可补充血管内容量和组织间隙容量。但是,目前还没有足够的相关临床资料比较输注NS和LR对临床结局的影响。LR轻度低渗,如果大剂量输注可能对脑外伤患者有害。LR包含3mmol/L的钙,传统上认为LR不宜用于稀释浓缩红细胞(RBCs)或与之共同输注。但有部分研究者对该观点提出了不同的看法。有研究显示,RBCs以2∶1(RBCs∶LR)比例稀释后在37℃下孵育2小时也未见血凝块产生,使用LR将RBCs稀释到35%(血细胞压积,Hct)也不会降低血液通过标准170μm过滤器的速度。输注LR后,肝脏将乳酸根转化为碳酸氢根能够增加机体对酸的缓冲力。输注大剂量NS(大于30ml/kg)将会导致高氯性酸中毒。与乳酸性酸中毒不同,高氯性酸中毒的阴离子间隙正常合并氯离子浓度升高。晶体液对凝血系统的影响比较复杂。使用晶体液将血液稀释20%~40%时,由于抗凝血因子稀释和血小板激活,会导致高凝状态。当稀释度达到60%,晶体液和胶体液都会导致低凝状态。分别输注NS和LR治疗未控制出血的失血性休克动物,结果显示NS减轻高凝状态并增加失血量。在腹主动脉瘤修补术的患者中分别输注NS和LR,结果显示输注NS的患者碳酸氢盐、血小板和血液制品的使用量增加,但是临床结局却无明显差异。在腹部大手术患者中分别输注NS和LR,对凝血功能监测指标也无明显差异。在大多数临床医学中心,NS主要用于脑外伤患者和与血液制品共同输注时使用,LR则用于其他的大多数情况。
(2)胶体液:需要手术的创伤患者,究竟选用胶体液还是晶体液进行复苏仍无定论。对复苏液体类型的选择取决于液体对凝血功能和代谢率的影响、微循环功能改变、容量分布和器官功能状态(如肾功能和内脏灌注)。既往对晶胶之争的关注点主要集中于临床结局,但更多的证据显示临床病死率并不是评估容量治疗方案是否理想的正确指标,而器官灌注、器官功能、炎症反应、免疫功能及伤口愈合等评估指标可能更为合适。与晶体液相比,胶体液具有更强的血浆容量扩充作用。胶体液增加血浆胶体渗透压,有助于维持血管内容量,同时可减轻重要脏器(如肺、心和脑)的组织水肿。术中输注胶体已被证明可改善预后、缩短住院时间,其可能原因在于减轻组织水肿、恶心、呕吐和疼痛。Hextend(以平衡盐为溶剂的6%羟乙基淀粉)的血浆半衰期超过30小时,发挥相同程度的容量扩充效应所需要的液体总量较少,并且组织水肿的程度也较轻。
Hextend在脑外伤患者中应用可能有益。在严重脑损伤猪动物模型中,与输注LR复合甘露醇相比,以Hextend作为单一的复苏治疗液体,阻止颅内压升高和维持脑灌注压的作用相似,但Hextend可显著改善脑组织的氧分压和神经功能预后,所需要的液体总量减少,并且未观察到对凝血功能的不良作用。与NS相比,在脓毒性休克动物模型中使用Hextend进行容量复苏,可减轻代谢性酸中毒,延长生存时间。与晶体液相比,大多数胶体液在相对较低的稀释度下就会造成凝血功能障碍。胶体液可不同程度地抑制自然发生的血小板激活和高凝状态。Hespan(以NS为溶剂的6%羟乙基淀粉)已被证明对凝血功能具有不良影响,如血小板聚集受损、Ⅰ型vW综合征。Hextend不抑制血小板功能,可能因为其溶剂中包含2.5mmol/L的二水氯化钙。一项关于围手术期液体治疗的随机双盲试验结果显示,LR导致高凝状态,Hespan导致低凝状态,而Hextend对凝血功能的影响则最小。
已有部分研究比较了胶体液或晶体液对组织氧分压的影响。在择期行腹部大手术的患者中,尽管血流动力学和氧合状态相似,与输注LR相比,采用低分子量的羟乙基淀粉(平均分子量为130kDa,取代级为0.4)进行容量治疗可显著提高肌肉组织的氧分压(其可能原因在于羟乙基淀粉减轻内皮细胞水肿、改善了微循环功能),并且组织氧分压在术中进行性改善且一直持续到术后第一天清晨。(https://www.daowen.com)
已有研究针对不同容量治疗方案是否会影响腹部大手术的老年患者的炎症反应和内皮细胞激活进行了评价。患者随机分为LR组、NS组和130/0.4羟乙基淀粉组,各组分别输注不同的液体维持中心静脉压在8~12mmHg。结果显示,尽管各组的血流动力学状态相似,但炎症反应、内皮细胞损伤和激活的指标,晶体液输注组则显著高于130/0.4羟乙基淀粉输注组。
单纯采用晶体液进行容量复苏可能会降低血浆胶体渗透压,增加自由水从血管内向组织间隙的转移,导致组织水肿。因此,大量输注晶体液引起的胶体渗透压的降低就有可能导致肺间质水肿等肺部并发症。在一项512例入院24小时内需要手术治疗的创伤患者的前瞻性研究结果显示,与Hextend相比,使用晶体液进行容量复苏,并不延长术后机械通气的持续时间,也不会增加术后肺泡-动脉氧分压梯度和氧合指数,两组患者中病死率均较低,这表明两种液体治疗方案在维持组织稳态方面效果相当。
(3)高张溶液:高张溶液应用于各类危重患者的相关研究已经有20余年。静脉输注高张盐溶液可将细胞内和细胞间的水再分布进入血管内,产生超过本身输注容量的扩容效应。因此,高张盐溶液的扩容效应要比等张溶液更为有效、更为持久。在高张盐溶液中加入胶体液将会进一步增加其扩容效应的程度和持续时间。在30分钟内分别输注包含6%右旋糖酐的7.5%高张盐溶液(4ml/kg)和LR(25ml/kg),二者的扩容峰值效应相似(约为7ml/kg)。但是,在30分钟后右旋糖酐-高张盐溶液的扩容效应是LR的三倍[(5.1±0.9)ml/kgvs(1.7±0.6)ml/kg];在2小时后,每毫升右旋糖酐-高张盐溶液和LR的输入液在血管内的存留量则分别为0.7ml和0.07ml。失血性休克的局部缺血性细胞会发生肿胀,吸收水、氯和钠离子,静息动作电位消失,采用高张溶液复苏比采用等张溶液能够更好地恢复细胞的正常容量、电解质平衡和静息动作电位。高张溶液复苏可使细胞水肿引起的毛细血管腔狭窄恢复到正常管径,而LR复苏则不能。此外,高张溶液在恢复血管内容量和血流动力学功能的同时可降低血管外容量、减轻组织水肿。采用LR进行容量治疗,在输注结束时和输注结束后2小时血管外容量分别增加输入容量的60%和43%;但是采用右旋糖酐-高张盐溶液进行容量治疗时,在输注结束和输注结束后2小时血管外容量则分别降低输入容量的170%和430%。在脑损伤并发肺水肿的患者中,高张盐溶液降低组织水含量的作用要优于甘露醇。在并发低血压的创伤患者中,入院前先输注250ml7.5%的高张溶液,然后按常规进行液体复苏,结果显示,与输注LR相比,输注单剂量的高张溶液可改善血压、降低液体需用量,增加出院的存活率(尤其是格拉斯哥昏迷评分小于8分的患者)。目前看来,尽管高张晶体液具有扩容、减轻水肿、抗炎和免疫调节等优点,但是现有的临床证据还不足以充分证明在创伤患者中使用高张溶液进行复苏要优于等张溶液。
4.容量治疗方案的制订 麻醉医师必须对患者可能需要的液体总量有一个合理预测,据此制订复苏计划,以使患者在复苏结束时能够维持合理的血液成分。一般来讲,根据对最初液体治疗的血流动力学反应,可将创伤患者分为三类(表18-7):①对液体治疗有反应;②对液体治疗有短暂反应;③对液体治疗无反应。
表18-7 ATLS休克分类(低血压患者对快速输注500ml等张晶体液的反应)

续表
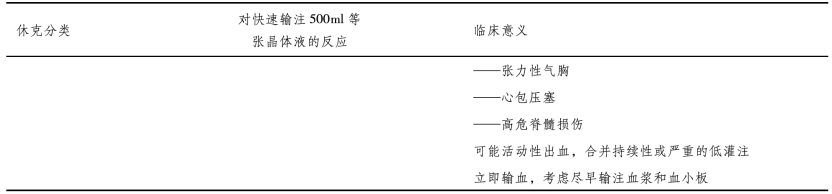
许多休克患者在治疗开始时出血已经停止,比如单纯性股骨骨折的患者。这类患者在受伤的当时失血800~1200ml,通过外周血管的强烈收缩、出血腔周围肌肉组织的限制作用及正常的凝血反应,出血在入院前就能够自动得到控制。只要所输注的液体不至于过量而冲洗掉血凝块或快速逆转局部的血管收缩,在整个过程中患者都能够始终维持血流动力学稳定。可逐步输入晶体液以补充细胞水肿和血管外转移所导致的体液丢失,并根据实验室检查结果决定所需要的浓缩红细胞(RBCs)和凝血因子的准确剂量。
存在进行性、活动性出血的患者(比如严重脾或肝破裂、大动脉或静脉穿透伤)将表现为对液体治疗有短暂反应。识别并明确诊断此类患者至关重要,因为有效控制出血的速度与这类患者的临床预后强烈相关。在积极止血的过程中,如果能够避免发生创伤致死性三联症并维持组织灌注,此类患者复苏成功的可能性非常大。对液体治疗有短暂反应的患者,其出血量不少于一个循环血量(成人约5000ml),必定需要输血。对于存在活动性出血但仍有一定程度代偿的创伤患者来说,过度输注晶体液是最具风险的。一旦确诊,一开始就应该尽量控制非血制品的使用(尽管出血量是在ATLS所推荐的2000ml阈值之下),并尽可能维持有效血液成分。未经交叉配血的O型RBCs可安全使用,并且在大多数大型医院也能够立刻获得,在开始复苏时应该积极使用。为了维持凝血功能和替代因广泛或多发创伤引起的内在丢失,早期使用血浆和血小板也是必要的。如图18-3所示,即使不用其他任何液体,仅采用RBCs、血浆和血小板按1∶1∶1单位比例输注的补液方案也并不能充分维持血液成分。此时唯一有效方法就是使用新鲜全血,以避免在成分血制备和贮存过程中导致的内在丢失和稀释,但是在大多数创伤中心不易获得新鲜全血。
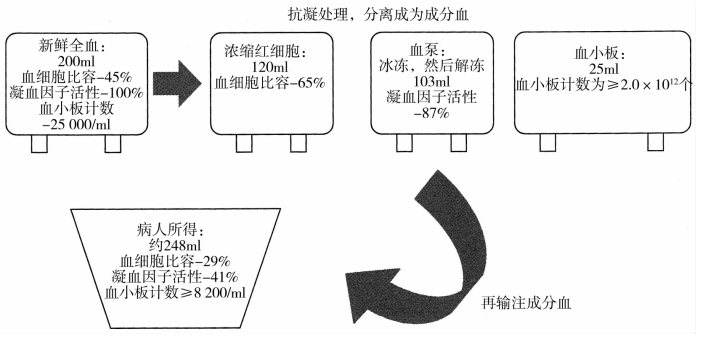
图18-3 一单位新鲜全血的分离和重构,显示在捐献和输注时稀释性和贮存损耗性变化
对输液无反应的患者,往往是因为活动性出血时间较长,已经耗竭了机体的代偿,或者创伤严重以至于患者在到达急诊室前已存在重度休克,这类患者可表现为以下特征:低温、尽管已经液体治疗仍存在低血压和代谢性酸中毒,入院第一个血常规报告示血红蛋白降低、凝血酶原时间延长。尽管积极诊断和治疗,这类患者的病死率仍相当高,不过也有少量患者能够存活。除了以RBCs和血浆等比例输注并采用上述的容许性低血压复苏策略之外,还必须即刻注重对凝血功能的支持。应尽早输注适量8~10U的冷沉淀和1~2U的单采血小板以提供凝血底物;应用单剂量的重组活性Ⅶ因子(FⅦa,100μg/kg)以激活血管损伤部位的凝血;输注碳酸氢钠可暂时逆转代谢性酸中毒,改善心脏功能和提高FⅦa的反应速度。尽管这种复苏策略还未得到前瞻性研究的证实,但却是美国军方和几大创伤中心目前所使用的方案,在这些极端危重患者的风险/获益比评估中也证明该方案是合理的。
(四)体温
维持创伤患者的体温是麻醉医师的重要职责。低温是创伤致死性三联症之一,持续性低温可导致酸中毒和凝血功能恶化。保持体温该方案比患者已经低温后再恢复体温更为容易,所以在复苏的整个过程中都应该关注创伤患者的体温问题。所有的补液都应加温,如果预期大容量输血应使用快速输液加温系统。尽可能覆盖患者体表,若要暴露患者体表,则应在患者到达手术室之前提前将室温调高。对流空气加热系统(forced air heating system)可对手术野之外的任何体表部位主动加温,因此强烈推荐使用。所有术野灌洗液都应加温后使用,外科医师也应知晓患者的体温情况。低温的出现也是对创伤患者采用损伤控制性策略(damage control maneuvers)的指征,其目的在于尽量缩短病情不稳定患者的手术时间。
(五)凝血功能及水、电解质与酸碱平衡
除了维持创伤患者的携氧能力和凝血功能之外,麻醉医师还必须精心调整患者的血浆生化成分。由于酸中毒和枸橼酸的作用,在大量输血患者中也常发生低钙血症。尽管全身的钙储备最终足以抵消这种影响,但是过快的大量输血,机体来不及代偿就会存在低钙血症的风险。在复苏过程中应定期检测血清电解质,如有必要可补钙(0.5~1.0mg,3~5分钟以上静脉注射)。对输液无反应性的低血压患者也应关注低钙血症问题,如果怀疑该诊断,可经验性予以补钙。大量或快速输注0.9%的生理盐水可引起高氯性代谢性酸中毒,应避免使用,可考虑使用乳酸林格液或勃脉力A溶液。高钾血症偶尔会在输注陈旧性RBCs时出现,但是导致高钾血症更为常见的原因却是低灌注、酸中毒和复苏失败。如果发生高钾性心律失常,应采用胰岛素、葡萄糖和钙剂积极治疗。复苏所使用的液体主要是血制品或等张晶体液,所以其他电解质紊乱在大容量复苏时并不常见。
创伤患者常发生应激相关性高血糖。既往认为创伤患者能够耐受高血糖,可让机体自身逐渐纠正而无需特殊治疗。但是已有研究表明严格控制血糖水平(低于10mmol/L)有利于降低术后感染的发生率;所以目前推荐采用静脉间断或持续输注常规胰岛素的方法治疗创伤性高血糖。
关于特异性促炎或抗炎药物在早期复苏中的作用尚不明确。已证实重组人类活化蛋白C治疗重症脓毒症无效。明确炎症级联反应全过程并掌握如何有效调控炎症反应的具体环节将是一个巨大挑战,因为影响患者伤口愈合和创伤恢复的理想炎症状态会受到患者的年龄、基因背景、营养状态和创伤发生时间等诸多因素的影响而存在较大差异。炎症调控治疗目前是创伤和重症治疗领域最为激动人心的研究热点,仍有可能为未来的临床实践带来变革。
在创伤性休克的复苏过程中,低血压、液体复苏和创伤性脑损伤的相互作用是非常值得关注的问题。许多失血性休克的患者常合并一定程度的脑损伤。脑损伤患者的脑灌注压降低将会导致致命性后果,容许性低血压复苏策略在这类患者中的应用就受到限制,因此,有研究者推荐在脑外伤合并创伤性休克的患者中维持较高的目标血压和给予更为积极的机械通气。然而,长时间过度积极的液体复苏也会导致出血恶化并产生其他问题,因此尽快止血仍是最佳治疗途径。脑外伤患者应避免使用低张晶体液,因为存在增加细胞水肿和脑容量的风险。高张晶体液具有扩容、减轻水肿、抗炎和免疫调节等效果,已有较多关于高张晶体液应用于脑外伤患者中的研究报道。大多数研究结果显示,如果以颅内压的控制、神经损伤的生化指标、炎症反应或淋巴细胞激活作为观察指标,高张晶体液比等张晶体液更具优势,但是最近的一项大样本随机对照临床试验则表明,高张晶体液并不能改善脑外伤患者6个月时的神经功能预后和患者的存活率,并且所有的这些研究都未包括脑外伤合并未控制的失血性休克患者。
总之,理解创伤性休克的病理生理,麻醉医师能够优化复苏治疗的策略,从而使患者获得最佳临床转归。尽快诊断休克并积极治疗失血至关重要。早期液体复苏的目标在于维持略低于正常的血压,并应强调维持正常的血液成分和生化指标,对于需要大量输血的创伤患者则予以RBC、血浆和血小板治疗,对于严重休克并存在生理失代偿的患者则必须采取更为积极的治疗措施,使用碳酸氢钠、冷沉淀和FⅦa因子以快速恢复有效的凝血功能。一旦出血停止,可通过监测组织灌注的实验室指标指导进一步的复苏治疗。将来治疗的方向在于通过直接调控全身炎症反应,使严重创伤快速恢复,并减少MODS的发生。
(六)血管活性药物的使用
对低血容量休克使用血管收缩药物以代替补充血容量是绝对禁忌的。当血压很低甚至测不到,而又不能及时大量快速补充液体时,为了暂时升高血压、维持心、脑血流灌注,以预防心搏骤停,可以使用少量血管活性药物。
